Заявления отвечающее принципу ле шателье
Обновлено: 30.06.2024
Устойчивость состояния обеспечивается тем, что при выводе системы из состояния равновесия в ней возникают факторы, стремящиеся вернуть ее в состояние ТД равновесия. Это положение было установлено Ле Шателье и обосновано Брауном и носит название принцип Ле Шателье-Брауна. Принцип позволяет предсказать направление, в котором под влиянием внешнего воздействия изменится ТД процесс, протекающий в произвольной системе.
Принцип Ле Шателье-Брауна: если на систему, находящуюся в устойчивом ТД равновесии, воздействуют внешние факторы, стремящиеся вывести ее из этого состояния, то в системе возникают процессы, стремящиеся уничтожить изменения, вызываемые внешними воздействиями.
Математически принцип выражается неравенством , где в системе сохраняется химический состав и масса, - параметры, определяющие состояние системы, - обобщенные силы, соответствующие этим параметрам. Если в системе, в которой поддерживаются постоянными параметры , мы начинаем внешним воздействием изменять параметр , то это вызовет изменение и , а мерой воздействия является величина . Но при внезапном увеличении происходящий процесс вначале можно рассматривать как при постоянном , следовательно, в это время приложенное воздействие характеризуется производной . Когда же снова наступит равновесие и параметр примет поддерживаемое внешней средой прежнее значение, то изменение величины за счет внешнего воздействия будет определяться производной . Принцип утверждает, что в новом равновесном состоянии, в которое переходит система, изменение параметра ослаблено за счет внешнего воздействия.
Примеры проявления принципа Ле Шателье-Брауна:
1. Увеличим внешнее давление на тело, уменьшая его объем. При этом возникает изменение температуры, которое направлено так, что стремится снова увеличить объем; поэтому те тела, которые от нагревания сжимаются (например, вода при 4°С), будут от сжатия охлаждаться.
2. Сообщим смеси из льда и воды некоторое количество теплоты. Тогда лед начинает таять, благодаря чему не происходит повышение его температуры, которое иначе имело бы место.
3. Если имеются два вещества в состоянии химического равновесия и им сообщили некоторое количество теплоты, то произойдет та реакция, которая охлаждает систему. Следовательно, при повышении температуры будут разлагаться вещества, возникающие путем экзотермической реакции, и, наоборот, будут возникать эндотермические соединения.
4. Для соли, находящейся в насыщенном растворе, повышение температуры вызывает растворе, если последнее связано с охлаждением; в противном случае происходит выпадение кристаллов.
5. Если электрический ток проходит через спай двух металлов, то температура спая изменяется в таком направлении, что возникающей термоэлектрический ток стремится ослабить ток, пропускаемый через спай (явление Пельтье).
Из примеров видно, что принцип Ле Шателье-Брауна обусловлен устойчивостью состояния. Если бы первичный процесс усиливался еще дальше благодаря вызванному им вторичному процессу, то это привело бы к полному расстройству равновесия в системе.
55.Начала статистической физики: исходные понятия теории вероятности.
Как мы раньше говорили, с одной стороны, информация о положениях и скоростях всех отдельных частиц системы идеального газа является наиболее полной мыслимой информацией, а с другой стороны, в своей непосредственной форме она неприменима для анализа свойств и поведения системы. Чтобы информацию, содержащуюся в этих сведениях, можно было использовать, необходимо свести ее к некоторым обобщенным характеристикам совокупности частиц таким образом, чтобы они отражали наиболее существенные свойства этой совокупности, были бы легко обозримыми и сформулированными математически. Эти вопросы разработаны в теории вероятностей и математической статистике.
Здесь существенно очень большое число испытаний в системе, находящейся в неизменных условиях. Вместо требований испытаний над одной и той же системой в неизменных условиях можно говорить о совокупности отдельных испытаний над большим числом одинаковых систем. Это большое число одинаковых систем называется ансамблем систем.
Для непрерывных случайных величин вводится понятие плотности вероятности. Плотностью вероятности равняется вероятность нахождения молекулы в бесконечно малом объеме, отнесенном к этому объему:
, где - координаты точки, к которой стягивается бесконечно малый объем .
Из этого определения следует, что если произвести наблюдений, то в объеме в окрестности точки молекула будет обнаружена в случаях.
В конечном объеме молекула окажется обнаруженной раз. Отсюда следует, что вероятность быть обнаруженной при наблюдении в объеме для молекулы равна: .
Если в качестве объема взять все пространство , то при каждом испытании частица окажется в какой-то точке пространства и, следовательно, число наблюдений частицы в объеме равно числу испытаний , т.е. и следовательно вероятность нахождения частицы в объеме равна единице. Условие
называется условием нормировки плотности вероятности. Оно выражает факт существования молекулы.
Среднее значение непрерывно изменяющейся величины (еще называют математическим ожиданием случайной величины с учетом вероятности):
где - плотность вероятности распределения случайной величины х.
Корень квадратный из дисперсии называется стандартным или среднеквадратичным отклонением.
Функция распределения вероятностей. Вероятность того, что случайная величина х принимает значения, меньшие некоторого заданного числа х0, т.е. определяется формулой:
Функция называется функцией распределения вероятностей.
56.Начала статистической физики: макро- и микросостояния, статистический ансамбль, микроканонический ансамбль, постулат равновероятности.
Состояние газа, характеризуемое его давлением, температурой и объемом, называется макроскопическим.
Состояние газа, характеризуемое положениями и скоростями всех его частиц, называется микроскопическим. Если число частиц n ( в 1см 3 при н.у.) то микроскопическое состояние газа характеризуется 6п числами (микропараметрами): 3п координатами всех частиц и 3п проекциями их скоростей . Все эти числа следует рассматривать как случайные величины.
В равновесном состоянии Р,V, Т – фиксированные величины, а вот и могут меняться. Возьмем очень большое число совершенно одинаковых сосудов, каждый из которых имеет объем . В каждом из сосудов находится одинаковое число n одинаковых частиц.
Сосуд с заключенными в нем частицами называется статистической системой.
Совокупность одинаковых статистических систем называется статистическим ансамблем.
Микроканонический ансамбль состоит из одинаковых изолированных систем с одинаковой энергией. Кроме микроканонических ансамблей в статистической физике рассматриваются также канонические и некоторые другие ансамбли.
Ø Допустим частицы, входящие в систему микроканонического ансамбля, считаются пронумерованными, пронумерованы также и ячейки, в которых могут находиться частицы.
Ø Известно, что атомы и молекулы имеют определенные размеры. Их диаметр имеет порядок м. Каждая молекула или атом занимает объем порядка м 3 , таким образом, в 1 м 3 имеется всего ячеек. С другой стороны в 1 м 3 воздуха при нормальных условиях находится частиц. Это означает, что в типичных условиях одна частица приходится на ячеек.
Ø В некоторый момент времени некоторая частица находится в различных системах ансамбля в различных ячейках. Если ансамбль содержит очень большое число систем , то число систем, в которых рассматриваемая частица окажется в ячейке 1, равна числу систем, в которых она оказалась в ячейке 2. Для данной частицы все возможные положения равновероятны. Микросостояние характеризуется положением всех частиц, входящих в систему, т.е. конкретным распределением этих частиц по ячейкам, на которые разбит объем.
Ø Поскольку все ячейки для каждой из частиц равновозможны, логично заключить, что все распределения частиц по ячейкам также равновозможны. А это означает, что все микросостояния равновероятны.
Одно и тоже макроскопическое состояние осуществляется в большом числе систем ансамбля, находящихся в различных микроскопических состояниях. Следовательно, данное макросостояние характеризуется большим числом микросостояний.
В основе всей статистической физики лежат не доказанные в общем случае постулат равновероятности и эргодическая гипотеза.В состоянии ТД равновесия все микросостояния равновероятны. Это постулат равновероятности.
57.Начала статистической физики: эргодическая гипотеза, статистический вес, статистическое толкование энтропии.
Пусть наша система состоит из одной частицы. Мы следим за скоростью частицы. Естественно нас интересует средняя скорость частицы:
Эргодическая гипотеза утверждает, что такая средняя скорость равняется средней скорости, вычисленной по ансамблю систем, т.е. среднее значение величины, вычисленное по времени равняется среднему значению величины, вычисленному по ансамблю систем.Пусть число систем в ансамбле , в некоторый момент времени :
Впервые эта гипотеза была высказана в 1871 г. Л. Больцманом (1844-1906). Затем Дж. Максвелл в 1879 г. проанализировал возможность замены средних значений по времени средними значениями по ансамблю. Используя эту гипотезу, мы можем вопрос об изучении параметров системы, меняющихся со временем, свести к одномоментному усреднению по ансамблю!
Статистический вес Г: определяется числом микросостояний, реализующих данное макросостояние. Причем справедлив постулат равновероятности всех микросостояний.
Общее число микросостояний равно, очевидно, числу способов, которыми можно разместить частиц по ячейкам, где - объем занимаемый системой из частиц. Конкретную формулу дает комбинаторика. Отметим, что статистический вес для моля кислорода при нормальном атмосферном давлении и комнатной температуре 20°С
Статистический вес Г еще называют термодинамической вероятностью состояния системы. Т.к. это число способов, которыми может быть реализовано данное макросостояние системы, по определению, . Таким образом, термодинамическая вероятность не есть вероятность в математическом смысле (т.к. ).
Будем отличать макросостояния номерами , - статистический вес -го макросостояния.
Используя это понятие, Больцман в 1872 г. Предложил статистическое толкование энтропии. Это более глубокое толкование.
Согласно Больцману, энтропия системы и статистический вес Г связаны между собой соотношением
- если система состоит из подсистем с .
Она определяется логарифмом числа микросостояний, с помощью которых было реализовано данное макросостояние.
Тогда статистический вес системы выражается через произведение подсистем.
Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы.
Формула Больцмана позволяет дать энтропии следующее определение (статистическое толкование).
Энтропия является мерой неупорядоченности системы. Энтропия есть количественная мера беспорядка системы многих частиц.
В самом деле, чем больше число микросостояний реализующих данное макросостояние, тем больше энтропия.
В изолированной ТД системе все процессы идут в направлении возрастания энтропии, в направлении наиболее вероятного макросостояния (равновесного). Энтропия возрастает по II началу ТД, следовательно, естественные процессы стремятся перевести систему в состояние с наибольшим беспорядком. Это тенденция, хотя возможны отдельные флуктуации, понижающие энтропию.
58.Начала статистической физики: флуктуации.
Ø Говорят, что величина флуктуирует, если ее значение колеблется около среднего. В статистической физике и термодинамике обычно имеются в виду флуктуации внутренних параметров в состоянии термодинамического равновесия.
Мерой флуктуаций является стандартное отклонение от среднего значения, которое определено равенством для дискретных величин:
При вычислении этой величины усреднение по времени можно заменить усреднением по ансамблю.
Стандартное отклонение растет медленнее, чем общее число частиц в системе, в то время как среднее растет пропорционально числу частиц в системе. Следовательно, относительное стандартное отклонение убывает сростом числа частиц в системе.
Расчет относительной величины флуктуации с помощью распределения Пуассона дает величину:
Отметим, что относительная роль флуктуаций возрастает с уменьшением области, в которой эти флуктуации рассматриваются. Если область стремится к величине объема системы, то число частиц в этой области стремится к числу частиц системы.
Так как флуктуации уменьшаются как , следовательно, с ростом числа частиц в макросистемах флуктуации становятся ничтожно малыми.
Поэтому поведение системы большого числа частиц можно описывать с помощью средних величин, характеризующих систему.
С 59 ПО 63 НЕ РАЗДЕЛИЛА ИЛИ НЕ НАШЛА!
59.Классическая статистика Максвелла-Больцмана: подсчет числа состояний.
60.Классическая статистика Максвелла-Больцмана: вывод функции распределения Больцмана (дискретное распределение).

Учи.Дома запускает бесплатный марафон в котором каждый день. В течении 5 дней утром ты будешь получать одно задание по выбранному предмету, а вечером его решение. Твоя задача, успеть выполнение задание до того как получишь ответ.
Бесплатно, онлайн, подготовка к ЕГЭ
Предварительный просмотр:
Николаевская средняя школа
Цели урока: обобщить и углубить знания об обратимых химических реакциях, химическом равновесии и условиях ею смещения. Рассмотреть принцип Ле Шателье.
1.Проверка домашнего задания: классификация химических реакций.
2.Объяснение нового материала.
3. Закрепление изученного
4. Домашнее задание.
Проверка домашнего задания.
1) Как классифицируют химические реакции? Приведите названия по разным признакам классификации:
Ответ: По числу и составу реагирующих веществ и продуктов реакции: изомеризация, соединение, разложение, замещение и обмен;
По изменению степеней окисления: ОВР и без изменения ст. ок.;
По тепловому эффекту: экзо- и эндотермические;
По фазовому (агрегатному) составу: гомо- и гетерогенные;
По участию катализатора: каталитические и некаталитические;
По направлению: необратимые и обратимые и т.д.
2) Учащиеся получают задания и проводят реакции в микролабораториях.
Проведите реакции, укажите признаки, составьте уравнения в молекулярном и ионных видах, укажите тип каждой реакции, какие из них идут до конца? В пробирки добавляйте по 2-3 капли каждого реактива.
а) карбонат натрия + соляная кислота →
б) гидроксид натрия (добавить каплю фенолфталеина) + серная кислота →
в) сульфат меди(II) + гидроксид натрия →
г) хлорид железа(III) + серная кислота →
Ответ: это реакции обмена, в первой реакции выделяется газ, во второй образуется вода (малодиссоциирующее вещество), в третьей выпадает осадок, а четвёртая – обратима, признаков реакции не наблюдается. Согласно правилу Бертолле, реакции обмена, протекающие в растворах, идут до конца только в том случае, если в результате их образуется осадок, газ или вода.
3) Дайте определение обратимых и необратимых реакций.
Ответ: обратимые реакции – реакции, идущие во взаимно противоположных направлениях, необратимые – идут только в одном направлении, с полным превращением исходных веществ.
Объяснение нового материала:
Мы выяснили, что реакция
2FeCl 3 +3Н 2 SO 4 Fe 2 (SO 4 ) 3 +6HCl
2Fe 3+ +6Cl - +6H + +3SO4 2- 2Fe 3+ +3SO4 2- +6H + +6Cl -
является обратимой, учащимся предлагается прочить уравнение прямой и обратной реакций.
На начальном этапе скорость прямой реакции значительно превышает скорость обратной реакции, но наступает такой момент, когда их скорости выравниваются.
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции называют химическим равновесием.
Химическое равновесие является динамическим (подвижным), так как при его наступлении одновременно протекают и прямая, и обратная реакции с одинаковой скоростью.
При постоянных температуре, давлении равновесии обратимой реакции может сохраняться неопределённо долгое время.
Принцип Ле Шателье.
Очень небольшое число реакций являются необратимыми. В основе большинства производственных синтезов находятся именно обратимые реакции.
На производстве, конечно, заинтересованы в преимущественном протекании прямой реакции. Возникает проблема: как сместить химическое равновесие в сторону прямой реакции. Эта проблема была решена во второй половине 19 века.
Французкий химик Анри Ле Шателье в 1885 году вывел, а немецкий физик Фердинанд Браун в 1887 году обосновал, общий закон смещения химического равновесия в зависимости от внешних факторов, который известен теперь под названием принципа Ле Шателье:
Если на систему, находящуюся в состоянии химического равновесия, оказывать какое-либо воздействие (изменить концентрацию, температуру, давление), то равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия.
А теперь подробнее рассмотрим, как можно сместить химическое равновесие с помощью концентрации, температуры, давления.
Рассмотрим реакцию обмена между хлоридом железа (III) роданидом аммония:
FeCl 3 +3NH 4 CNS Fe(СNS) 3 +3NH 4 Cl
Появляется характерное кроваво-красное окрашивание, обусловленное присутствием молекул Fe(CNS) 3 .
Полученный в стакане раствор разливаем поровну в 3 пробирки;
2-добавляем раствор NH 4 CNS – окраска усиливается, равновесие смещается вправо, в сторону образования роданида железа (III) Fe(CNS) 3 ;
3-добавляем кристаллический NH 4 Cl, перемешиваем стеклянной палочкой. Окраска раствора по мере растворения хлорида аммония ослабляется, что свидетельствует о смещении равновесия влево, в направлении образования хлорида железа (III) и роданида аммония.
* при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
* при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ.
P.S Можно рассмотреть влияние концентрации на примере реакции
3С 6 H 5 OH+FeCl 3 (C 6 H 5 O) 3 Fe+3HCl
При добавлении HCl окраска исчезает, так как равновесие химической реакции смещается влево и комплекс: фенолят железа (III) разрушается.
Процесс разложения азотной кислоты протекает при обычных условиях на свету, поэтому раствор азотной кислоты и безводная HNO 3 окрашены в бурый цвет (примесь NO 2 -бурый газ). Этот процесс равновесный.
4HNO 3 4NO 2 ↑+ O 2 ↑+2H 2 O -Q
Равновесие реакции можно сместить вправо с помощью температуры.
В ходе прямой реакции теплота поглощается, чтобы равновесие сместилось вправо (Vпр>Vобр, V- скорость химической реакции), нужно температуру повысить, тогда система будет стремиться охладить себя, и пойдёт процесс эндотермический, т.е прямая реакция.
Добавляем индикатор метилоранж и нагреваем пробирку с азотной кислотой. Цвет меняется от розового до оранжевого, что свидетельствует о нейтральной среде и разложении кислоты.
Если реакция эндотермическая, то при нагревании Vпр>Vобр.
Если реакция экзотермическая, то при нагревании Vобр> Vпр.
*Если нагревать систему, то пойдёт в большой степени такая реакция, которая будет это тепло забирать (поглощать); т.е эндотермическая реакция.
*Если охлаждать систему, то пойдёт в большой степени такая реакция, которая будет это тепло выделять; т.е экзотермическая реакция.
На примере окисления оксида серы (4) в серный ангидрид. 2SO 2 +O 2 2SO 3 +Q
SO 3 - в производственных условиях ( при высокой t и p) находится в газообразном состоянии.
Давление напрямую зависит от объёма (p~v)
Прямая реакция идёт с уменьшением давления (числа моль газообразных веществ).
Чтобы пошла прямая реакция, надо сделать наоборот, т.е. давление повысить, чтобы система затем его понижала.
Увеличение давления ведёт к смещению равновесия в сторону реакции с меньшим числом молекул.
2SO 2 +O 2 2SO 3 +Q
чтобы сместить равновесие вправо, необходимо:
1)взять избыток одного из исходных веществ;
2)температуру взять максимально низкую ( в производственных условиях ~400С);
После просмотра классу предлагается ответить на вопрос: Как влияет катализатор на химическое равновесие? В какую сторону V 2 O 5
смещает равновесие реакции?
Ответ: Катализатор не влияет на химическое равновесие, он в равной степени ускоряет как прямую, так и обратную реакции.
В некоторых случаях вещества, получающиеся в результате реакции, либо взаимодействуют между собой, либо распадаются, и тогда в системе одновременно протекают две реакции: прямая (образуются продукты реакции) и обратная (вновь синтезируются исходные вещества). В случае совпадения скоростей прямого и обратного процессов в рассматриваемой системе наступает равновесие, которое называется химическим. Это динамичное равновесие, поскольку сама реакция не прекращается, но образуется и распадается одновременно одинаковое количество вещества. При неизменных температуре и давлении такая ситуация может сохраняться довольно долго. В графическом виде она представлена ниже. Под эквивалентной скоростью подразумевается некая константа, равная одновременно скоростям прямой и обратной реакции.
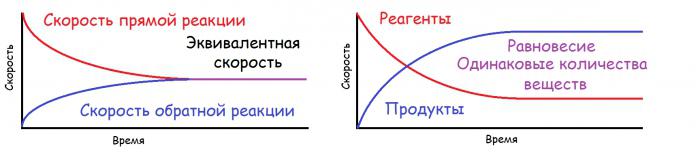
Принцип смещения химического равновесия
Принцип Ле Шателье можно использовать только для систем, находящихся в равновесии, в противном случае результаты анализа будут неверными. Существуют три основных параметра, изменение которых вызывает смещение химического равновесия: давление, температура и концентрация химических веществ.
Температура
Изменение температуры — наиболее частая причина сдвига химического равновесия, что вполне объяснимо, ведь на этот фактор повлиять намного легче, чем, например, на давление. Здесь следует упомянуть, что реакции разделяются на два типа по термическому эффекту. Среди них следующие: экзотермические (с выделением тепла) и эндотермические (с его поглощением). Как будет смещаться в данном случае химическое равновесие? Принцип Ле Шателье в этом случае сводится к следующему: с увеличением температуры равновесие смещается в сторону реакции, проходящей с поглощением тепла, а при её уменьшении, соответственно, в противоположную сторону. Так, если для реакции, изображённой ниже, повысить температуру, равновесие сдвинется в правую сторону.
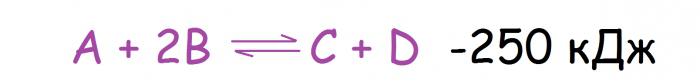
Большинство прямых реакций экзотермические, а обратных — эндотермические (это не правило, а, скорее, наблюдение, из которого можно найти множество исключений).
Давление
С изменением давления трансформируется следующий параметр системы — её объём (он увеличивается или уменьшается), поэтому воздействие с помощью этого параметра оказывает особенно сильное влияние на системы, в которых присутствуют газы. В этом случае принцип химического равновесия заключается в следующем. Если давление в системе увеличивается, то равновесие сдвигается в сторону сокращения числа молекул газа, а при уменьшении давления равновесие движется в противоположном направлении. Если число молекул газа во время реакции не изменяется, то равновесие не смещается при изменении давления, как, например, в следующей реакции.
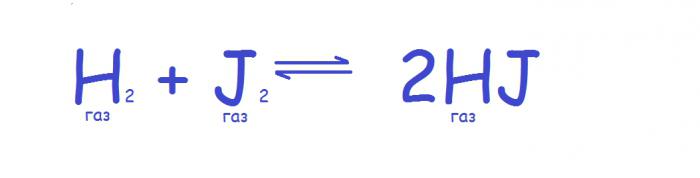
Однако на практике такой принцип верен лишь для идеальных газов, поскольку все реальные обладают разной сжимаемостью. Таким образом, даже если число молекул газа остаётся неизменным, равновесие может зависеть от давления. На практике это будет заметно при высоких давлениях. В случае жидких и твердых веществ изменение давления фактически не влияет на равновесие из-за малых объемов, занимаемых такими веществами. При рассмотрении смешанных систем учитывают только молекулы газа.
Смещение равновесия в системе в результате изменения концентрации любого вещества, участвующего в реакции
В ходе изменения концентрации какого-либо вещества принцип Ле Шателье работает следующим образом. При увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции, при уменьшении количества образующихся веществ равновесие двигается в противоположную сторону.
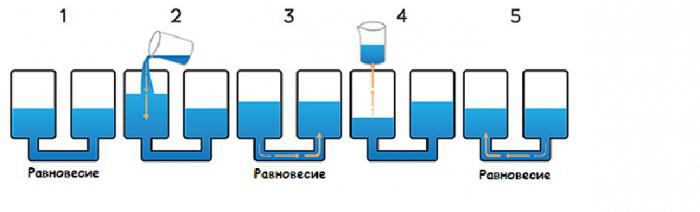
Что будет, если добавить инертный газ
Изменить объем системы можно не только сжав ее или ослабив давление, но и путем добавления инертного газа, который не будет вступать в реакцию. Что будет с системой при добавлении в нее, например, гелия? На самом деле, скорее всего, ничего не произойдет, поскольку соотношение участвующих в реакции веществ не изменится, а для хода процесса имеет значение не общее давление системы, а парциальное каждого компонента.
Влияние катализаторов
На смещение химического равновесия количество катализатора и вообще его наличие влияния не оказывают. Это происходит ввиду того, что этот элемент одинаково ускоряет и прямую, и обратную реакцию, сохраняя равновесие в системе неизменным.
Способ изучения химического равновесия
Детальное рассмотрение химических равновесий очень важно для полного понимания процесса. Одним из наиболее часто применяемых приёмов является так называемый метод замораживания равновесий. Так, происходит быстрое охлаждение системы, находящейся в сбалансированном состоянии. Равновесие просто не успевает сместиться, а при низких температурах скорость большинства процессов замедляется практически до нуля. Благодаря этому можно полностью проанализировать состав смеси при любой температуре (концентрации веществ, участвующих в реакции, при нуле градусов будет соответствовать количеству компонентов при той температуре, с которой началось понижение). Такой опыт проводят несколько раз с реакциями, протекающими в обоих направлениях.
Существует ли полная необратимость
Полностью сдвинуть химическое равновесие в одну сторону невозможно. Даже при кажущемся абсолютном смещении всегда останется небольшое число молекул, которые будут вступать в обратную реакцию.

На практике фактически все реакции обратимы, а насколько сильно будет виден этот эффект, часто зависит от температуры (нередко равновесие просто сильно смещено в одно сторону, поэтому оно становится заметным лишь при смене условий). Именно из-за этой распространенности обратимых химических реакций изучение равновесия особенно важно.
Примеры синтезов, в которых во время производства смещается химическое равновесие
На производстве химическое равновесие обычно смещают в направлении прямой реакции для получения, соответственно, продуктов реакции. Существует множество примеров таких синтезов: получение аммиака, оксида серы (VI), оксида азота (II) и т. д.
ТСО: учебник, карточки со схемами у учащихся, схемы на доске.
- научности
- доступности
- наглядности
- сознательности и активности
- систематичности и последовательности
- связи теории с практикой
- историзма
Записи на доске и в тетради
Записи в тетради
Записи в тетради
Записи на доске и в тетради
Записи в тетради
Записи на доске и в тетради
Решение упражнений на доске и в тетрадях
I. Организационный момент
II. Проверка домашнего задания
С целью повторения важнейших понятий, проведем опрос:
1. Какие реакции называют:
Реакции, при которых из двух и более веществ образуется одно сложное вещество
Реакции, которые одновременно протекают в прямом и обратном направлениях
Реакции, которые идут только в одном направлении, и сопровождаются образованием веществ, уходящих из зоны реакции
Реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях
2. Как в уравнениях реакций обозначается обратимость процесса?
3. Каковы условия необратимости процесса
4. Какие из химических реакций, уравнения которых предложены, обратимы?
Б) NaOH + HCl -> NaCl + H2O
III. Формирование новых ЗУН
Рассмотрим более подробно процессы, протекающие при обратимых реакциях, например, для условной реакции
На основании закона действующих масс скорость прямой реакции:
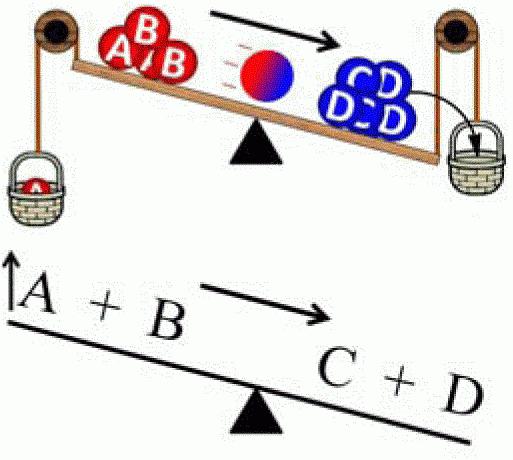
Так как со временем концентрация веществ А и В уменьшается, то и скорость прямой реакции тоже уменьшается. Появление продуктов реакции означает возможность обратной реакции, причем со временем концентрация веществ С и D увеличивается, а значит увеличивается и скорость обратной реакции
Рано или поздно будет достигнуто состояние, при котором скорость прямой и скорость обратной реакции станут равными.
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. И поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрация всех реагирующих веществ - как исходных, так и образующихся - остаются строго постоянными.
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными.
На состояние химического равновесия оказывают влияние концентрация реагирующих веществ, температура, а для газообразных веществ - и давление. При изменении одного из этих параметров, равновесие нарушается и концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия.
Смещение химического равновесия подчиняется правилу, названному в честь французского химика Анри Луи Ле Шателье.
Принцип Ле Шателье - если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, температура, давление), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Смещение химического равновесия может произойти при изменении температуры, давлении или концентрации. Рассмотрим влияние этих факторов на примере реакции синтеза аммиака:
1.Влияние изменения концентрации веществ:
2.Влияние изменения температуры:
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры - в сторону экзотермической.
Реакция синтеза аммиака - реакция экзотермическая, поэтому при повышении температуры равновесие сместится в сторону исходных веществ; при охлаждении реакционной смеси - в сторону прямой реакции.
3.Влияние изменения давления:
Изменение давления оказывает влияние только на те системы, где хотя бы одно из веществ находится в газообразном состоянии.
При увеличении давления равновесие смещается в сторону уменьшения количества газообразных веществ, то есть в сторону уменьшения давления.
При уменьшении давления, равновесие смещается в сторону увеличения количества газообразных веществ, то есть в сторону увеличения давления.
При повышении концентрации реагирующих веществ равновесие смещается в сторону образования продуктов;
При повышении концентрации продуктов реакции - в сторону образования исходных веществ;
При повышении давления - в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
При повышении температуры - в сторону эндотермической реакции;
При понижении температуры - в сторону экзотермической реакции.
упражнение 1,2 с.147
IV. Подведение итогов и закрепление пройденного материала
На этом уроке вы узнали, что:
Химическое равновесие наблюдается, когда скорость прямой реакции равна скорости обратной реакции;
Смещение химического равновесия в обратимых реакциях подчиняется принципу Ле Шателье;
Смещение химического равновесия может произойти при изменении температуры, давления или концентрации.
Читайте также:

