Кто осуществляет бактериологический контроль качества дезинфекции
Обновлено: 04.07.2024
Качество дезинфекционных мероприятий устанавливается контролем, который проводится визуальным, химическим и бактериологическим методами. В практических условиях указанные методы используют одновременно.
Визуальный контроль. Выясняют санитарное состояние объекта, своевременность проведения дезинфекционных мероприятий, обоснованность выбора объектов и методов обеззараживания, полноту обеззараживания поверхностей помещений, отдельных вещей, предметов и объектов, количество вещей, взятых для камерной дезинфекции.
Химический контроль. Этот вид контроля используют для определения содержания действующих веществ, соответствия концентрации рабочих растворов концентрациям, предусмотренным инструкциями. При отборе проб отмечают дату их взятия, когда и кем приготовлен дезинфицирующий раствор, какая концентрация указана на этикетке. При контроле заключительной дезинфекции пробы для химического анализа лучше всего отбирать в то время, когда дезинфекторы находятся в очаге. Особенно важно взятие проб из более концентрированных растворов дезинфицирующих препаратов, применяемых в очагах туберкулеза, грибковых болезней, вирусного гепатита. Само определение количества действующего вещества в растворах или сухих препаратах проводится в лабораторных условиях. Обнаружение во взятых пробах меньшего, чем требуется, количества действующего вещества служит доказательством плохого выполнения дезинфекции.
При контроле за проведением профилактической дезинфекции, а в некоторых случаях (при отсутствии бактериологической лаборатории) и при проведении очаговой дезинфекции может быть применен йодкрахмальный метод контроля за применением хлор-содержащих препаратов. Метод основан на цветной реакции йода с крахмалом. При взаимодействии с раствором йодида калия хлор вытесняет из раствора йод и занимает его место. Выделившийся йод окрашивает крахмал в сине-бурый цвет. Контроль проводят следующим образом. На конец спички наматывают небольшое количество ваты; полученный таким образом тампончик смачивают смесью 3% раствора йодида калия с 2% крахмальным клейстером. Если прикоснуться смоченным тампоном к орошенной хлорсодержащим раствором поверхности, то на поверхности контролируемого объекта появляется специфическое окрашивание. Цветное окрашивание, образовавшееся на поверхности, исчезает после протирки ваткой, смоченной в 3% растворе тиосульфата натрия.
Данный метод контроля был разработан автором этой книги в 1956 г. В последующем В. А. Конюхов (1983) упростил технику применения метода, которая заключается в том, что йод-крахмальный реактив набирается в пластмассовую авторучку с винтовым поршнем, ранее не заполнявшуюся чернилами. Результат определяется по изменению цвета риски, нанесенной пером на контролируемую незагрязненную поверхность, а на загрязненных поверхностях - по изменению цвета капли раствора.
Этим методом следует контролировать обеззараживание поверхностей тех предметов, которые представляют эпидемическую опасность: посуду для еды и выделений, игрушки, полы, стены, подоконники, мебель, полки и другие вещи, увлажняемые во время дезинфекции хлорсодержащими дезинфицирующими растворами. Для правильного вывода о тщательности работы дезинфекторов пробы следует брать с возможно большего количества мест. Результаты контроля обнаруживаются мгновенно. Контроль можно проводить внезапно на протяжении первых двух суток после дезинфекции. На горячих поверхностях (печи, батареи отопления) хлор определяется в более короткие сроки.
Бактериологический контроль. Этот контроль дезинфекции в очагах кишечных инфекций проводят путем обнаружения санитарно-показательной кишечной палочки методами смыва или соскобов. Бактериологический контроль качества заключительной дезинфекции проводят внезапно для персонала, занимающегося обработкой, или его осуществляют врач или дезинструктор (помощник эпидемиолога), организующий обработку очага. При текущей и профилактической дезинфекции качество контролируют в любое время. После окончания заключительной дезинфекции пробы берут не позже чем через 30 - 45 мин.
При контроле заключительной дезинфекции пробы берут со столовой и чайной посуды, ложек, ножей, белья, обеденного стола, игрушек, ручек дверей жилых комнат и уборных, ручек сливного бачка уборной, водопроводных кранов, выключателей, матрацев, подушек. При контроле качества текущей дезинфекции, кроме перечисленных выше предметов, смывы берут с ветоши для мытья посуды и столов, рук и халатов медицинского персонала, ванн, мочалок, щеток, ветоши для уборки. При контроле в пищеблоках больниц и детских учреждений смывы берут со столовой посуды, тазов для готовой продукции, ножей для вареного мяса, вареных овощей и хлеба, ветоши для мытья посуды и столов, разделочных столов и досок для вареной рыбы и мяса, вареных овощей, раздаточных столов и окон, мясорубок для вареного мяса, водопроводных кранов, дуршлагов, рук и халатов работников пищеблока.
Для взятия смывов готовят ватные талоны на палочках, вмонтированных в ватную пробку, и стерилизуют в бумажных пакетах. При отборе проб тампон вынимают из пакета и смачивают в 1 % растворе тиосульфата натрия или в среде обогащения. Смывы с помощью тампонов производят не менее чем с 10 предметов в квартирах и не менее чем с 30 предметов в детских дошкольных и лечебно-профилактических учреждениях. Каждый смыв производят с площади не менее 200 - 300 см на 2 - 3-х смежных участках обследуемого объекта. При заборе проб с игрушек, посуды смывы осуществляют с поверхности всего объекта.
Смывы с каждого объекта производят одним тампоном. После взятия смыва с поверхности ватную пробку из пробирки с питательной средой удаляют и заменяют пробкой с тампоном, погружая последний до дна, при этом края пробирки обжигают над пламенем горелки. На пробирке отмечают порядковый номер и под тем же номером заносят в список предмет, с которого взята проба. В этом списке также отмечают: а) адрес; б) фамилию, имя, отчество и возраст больного; в) диагноз; г) дату заболевания; д) дату госпитализации; е) дату и время дезинфекции; ж) дату и время забора проб; з) способ дезинфекции посуды, белья (обработка дезинфицирующим раствором или кипячением); и) номер наряда; к) фамилии дезинфекторов.
Отбор проб с белья, обеззараживаемого путем замачивания в дезинфицирующих растворах, проводят следующим образом. При наличии на белье фекальных загрязнений из бака или другого сосуда, в котором оно обеззараживалось, по истечении срока выдержки извлекают три штуки белья с различных уровней сосуда: верх, середина, низ (дно). С помощью платиновой петли (предварительно обожженной над пламенем горелки) забирают небольшой комочек фекалий и засевают на чашку Петри со средой Эндо. Такой же отбор кусочков фекалий производят с каждой из трех штук белья в отдельности с соответствующей отметкой на чашках Петри, откуда взято белье.
С белья без видимых загрязнений производят соскобы скальпелем с мест, чаще всего подвергающихся загрязнению: с простыни - на середине, с кальсон - на внутренней поверхности вдоль шва, с рубашки - на нижней части ее и т. д. При этом скальпель держат под углом к поверхности белья и перемещают его только в одном направлении, не допуская перевертывания лезвия. Соскоб делают с поверхности 100 см 2 .
После взятия пробы погружают в пробирку с мясо-пептонным бульоном. При контроле качества обработки белья хлорсодержащими растворами в питательный бульон добавляют 1 мл 1 % раствора стерильного тиосульфата натрия. Засеянные в очаге пробирки и чашки Петри в тот же день доставляют в лабораторию и помещают в термостат при температуре 37°С на 24 ч. По истечении указанного срока: а) посев из чашек Петри исследуют на кишечную палочку по общепринятой методике; б) из пробирок производят высев на чашки со средой Эндо и помещают в термостат при температуре 37°С на 24 ч, после чего ведут исследования на кишечную палочку по общепринятой методике.
Одноэтапная методика исследования смывов с использованием среды Хейфеца основана на возможности учета роста кишечной палочки в посевах по изменению цвета среды (без выделения чистой культуры и ее идентификации). Среда Хейфеца дает возможность получить окончательные результаты через 18 - 24 ч после посева смывов. В сомнительных случаях пользуются трехэтапным методом исследования смывов.
Среда Хейфеца состоит из 10 г пептона, 5 г маннита, 5 г хлорида натрия, 1 л водопроводной воды; после кипячения устанавливают рН раствора в пределах 7,4 - 7,6, а затем добавляют индикаторы: 1 мл 5% спиртового раствора розоловой кислоты и 2,5 мл 0,1% водного раствора метиленового синего. При указанной величине рН цвет среды красно-фиолетовый. Красный цвет без фиолетового оттенка указывает на то, что среда имеет высокую щелочность и должна быть забракована. При производстве смывов после дезинфекции хлорсодержащими препаратами к приведенной рецептуре добавляют 10 г тиосульфата натрия.
Приготовление индикаторов: а) 0,5 г порошка розоловой кислоты помещают в маленький флакончик с притертой пробкой и заливают 10 мл спирта; через 24 ч индикатор готов; срок действия раствора 1 мес; б) 0,1 г метиленового синего заливают 100 мл дистиллированной воды, нагревают до кипения; срок действия раствора не ограничен.
Готовую среду стерилизуют кипячением или нагреванием в кипящей водяной бане в течение 5 мин. Среду разливают в пробирки вместимостью 8 - 10 мл, подвергают однократному прогреванию текучим паром в течение 20 - 30 мин. Удобнее готовить и стерилизовать элективную среду в колбах вместимостью 200 - 500 мл и по мере надобности разливать ее в пробирки при соблюдении правил асептики. Засеянные пробирки ставят в термостат при 37°С на 18 ч, после чего результаты учитывают по признаку изменения цвета среды. При наличии зеленого цвета среды и обильной характерной мутности регистрируют рост кишечной палочки.
Если изменение цвета среды при росте кишечной палочки бывает недоостаточно отчетливым, то рекомендуют отлить из пробирки 1 - 2 мл среды в фарфоровую чашку и добавить 1 каплю 1 % спиртового раствора метилового красного (1 г метилового красного, 62 мл спирта и 38 мл дистиллированной воды). При наличии кишечной палочки жидкость принимает устойчивый малиновый или кирпично-красный цвет, во всех остальных случаях - желтый, оранжевый или (редко) красноватый, медленно исчезающий цвет.
Удовлетворительную оценку качества дают при отсутствии роста кишечной палочки во всех исследованных пробах, неудовлетворительную оценку - при обнаружении кишечной палочки хотя бы в одной из проб.
При инфекциях дыхательных путей, включая туберкулез, при контроле ведут поиск стафилококка. Контрольные смывы делают так же как и при кишечных инфекциях. Тампон отмывают в 20 мл стерильной водопроводной воды в широкогорлой пробирке с бусами, в течение 10 мин. Для выделения стафилоккока переносят 0,1 мл отмытой жидкости на дно стерильной чашки Петри и заливают 8 - 10 мл остуженного 2% мясопептонного или казеинового агара. Осторожным покачиванием распределяют пробу в агаре. Посевы инкубируют при 37°С, 24 ч, выдерживают в течение суток при комнатной температуре и учитывают рост колонии стафилококка на ангаре. Оценка результатов такая же, как и при кишечных инфекциях.
О качестве дезинфекции судят по отсутствию на изделиях медицинского назначения после ее проведения золотистого стафилококка, синегнойной палочки и бактерий группы кишечной палочки. Контролю подлежит 1% от одновременно обработанных изделий одного наименования (но не менее 3 единиц).
Контроль качества дезинфекции осуществляют методом смывов. Взятие смывов производят с поверхности изделий медицинского назначения до проведения дезинфекции и после нее. Взятие смывов производят стерильными марлевыми салфетками, смоченными в стерильной воде.
Смывы по 0,1 мл наносят на поверхность желточно-солевого, кровяного агара и на среду Эндо. Посевы выдерживают в термосе при температуре 37°С. Результаты учитывают через 48 часов. При наличии роста микроорганизмов на агаре идентификацию выделенным микроорганизмом проводят в соответствии с действующими методическими документами. Дезинфекцию считают эффективной при отсутствии роста микроорганизмов.
Контроль качества предстерилизационной очистки
Контроль качества предстерилизационной очистки проводится путем постановки азопирамовой или амидопириновой проб на наличие остатков крови и фенолфталеиновой на наличие остаточных количеств щелочных компонентов моющего средства.
Фенолфталеиновая проба
Для постановки пробы используют 1%спиртовой р-р фенолфталеина, который состоит из 60 г спирта, 40 г дистиллированной воды и 1г фенолфталеина. Спиртовой раствор наносится пипеткой на вату, которой протираются обработанные инструменты.
При наличии синтетических моющих средств появляется розовoe окрашивание. При этом всю партию изделий подвергается снова ополаскиванию в проточной, а за тем дистиллированной воде.
Азопирамовая проба
Для приготовления 1 л р-ра азопирама берут 100,0 азопирама и 1,0-1,5 солянокислого анилина, вещества смешиваются и заливаются 96° этиловым спиртом до объема 1 литр. Азопирам хранится при температуре +18+23° не более одного месяца. Умеренное пожелтение реактива в течение этого времени, без выпадения осадка, качество не снижается.
Непосредственно перед проверкой качества очистки изделий готовят рабочий раствор, смешивая равные объемы количества исходного раствора и 3% перекиси водорода. Наносятся на вату и протирают инструмент.
В присутствии следов крови не позднее, чем через 1 мин после контакта реактива с загрязненными инструментами появляется вначале фиолетовое окрашивание, переходящее в розово-сиреневое или буроватое (буроватое при наличии на инструментах ржавчины).
Проба с азопирамом по чувствительности превышает в 10 раз амидопириновую пробу.
Амидопириновая проба
Перед постановкой пробы в тигельке смешивают равные количества 5% спиртового р-ра амидопирина, 30% р-ра уксусной кислоты и 3% р-ра перекиси водорода. Появление сине-зеленого окрашивания при нанесении реактива на изделие свидетельствует о наличии остатков крови. Реактив проверяют на скрытую кровь также как и в предыдущем случае.
При положительной реакции на скрытую кровь всю партию изделий снова подвергают повторной обработке.
Контролю ежедневно подвергают 3% от одновременно обработанных изделий одного назначения (партии), но не менее 3-5 проб.
Контроль качества предстерилизационной очистки проводят центры Государственного санитарно-эпидемиологического надзора и дезинфекционные станции не реже 1 раза в квартал.
Самоконтроль в ЛПУ проводят: в централизованных стерилизационных (ЦС) ежедневно, в отделениях - не реже 1 раза в неделю; организует и контролирует его старшая медицинская сестра ЦС отделения.
Контроль качества стерилизации
Контроль работы предусматривает проверку параметров режимов стерилизации и оценки ее эффективности. Контроль параметров режимов стерилизации проводят физическим (с помощью контрольно-измерительных приборов) и химическим (с использованием химических индикаторов) методами. Эффективность стерилизации оценивают на основании результатов бактериологических исследований, проводимых при применении биотестов и контроле стерильности изделий, подвергнутых стерилизации.
Контроль качества стерилизации изделий медицинского назначения осуществляют проведением проверки температурного режима. Проверку температурного режима осуществляют с помощью термометров.
Для контроля температуры используют также химические индикаторы. Индикаторы представляют собой полоску бумаги с нанесенным на нее индикаторным слоем и предназначены для оперативного визуального контроля совокупности параметров (температура, время) режимов работы паровых и воздушных стерилизаторов.
Медицинский персонал, использующий средства физического и химического контроля, регистрирует результаты контроля в журнале по форме № 257/у.
Бактериологический контроль работы стерилизационной аппаратуры осуществляют с помощью биотестов на основании гибели спор термоустойчивых микроорганизмов. Биотесты представляют собой дозированное количество спор тест-культуры в упаковке, которая помещается в стерилизационную камеру.
Основанием для заключения об эффективной работе стерилизационной аппаратуры является отсутствие роста тест-культуры при бактериологических исследованиях всех биотестов в сочетании с удовлетворительными результатами физического и химического контроля.
ГЛАВА V. Методы и способы обработки инструментария и
Изделий медицинского назначения в стоматологии
Обработка стоматологического инструментария
Инструменты, входящие в терапевтический и ортопедический наборы (зеркала зубные, пинцеты, зонды, гладилки, штопферы, экскаваторы, шпатели) после проведения дезинфекции, предстерилизационной обработки по обычной методике, стерилизуют паровым (в автоклаве) и воздушным (в сухожаровом шкафу) способами.
Стекла для замешивания пломбировочного материала и цемента
После проведения дезинфекции и предстерилизационной обработки стерилизуются паровым методом (автоклавированием).
Скелетные карпульные металлические инъекторы
Инъекторы карпульные металлические дезинфицируются до и после использования путем протирания стерильным ватным тампоном, смоченным в 70° спирте. По окончании смены они подвергаются дезинфекции, предстерилизационной обработке, стерилизации.
Не до конца использованную карпулу с анестетиком применять повторно запрещено, даже если набирать раствор, другой иглой.
Наконечники к бормашинам и световоды
Светоотверждающих ламп
Наконечниками после каждого пациента снимают и тщательно протирают наружные поверхности и канал для бора стерильным тампоном двукратно через 15 мин, смоченным 3% р-ром хлорамина, или 70° спиртом.
Световоды светоотверждающих ламп тщательно протирают двукратно с интервалом 15 мин 70° спиртом.
Боры, эндодонтический инструментарий и абразивный
Материал
Мелкий инструментарий после проведения дезинфекции, предстерилизационной обработки по обычной методике, стерилизуют паровым (в автоклаве) и воздушным (в сухожаровом шкафу) способами, а так же в гласперленовых стерилизаторах.
Пульпоэкстракторы, каналонаполнители и разделительные матрицы повторно не используются, т. к. являются разовым инструментарием. Отработанные инструменты сбрасываются в плевательницу и обеззараживаются вместе с ее содержимым (см. п. 5.17.).
Новые инструменты используются только после проведения предстерилизационной обработки истерилизации.
Держатели
Держатели для щеточек, используемых для реставрации, и в работе с самотвердеющими пластмассами после каждого пациента тщательно протирают стерильным тампоном двукратно через 15 мин, смоченным 3% р-ром хлорамина, или 70° спиртом.
Щёточки одноразовые после дезинфекции утилизируются как одноразовый инструмент.
Качество дезинфекционных мероприятий определяется визуальным, химическим, бактериологическим контролем, который осуществляют дезинфекционные станции, бактериологические лабораю-РИИ лечебно-профилактических учреждений.
При визуальном контроле, который проводит сотрудник (лаборант, врач) дезстанции, выясняется санитарное состояние объекта, полнота и своевременность проведения дезинфекционных мероприятий.
Химический контроль используют для проверки содержания активного хлора в препаратах и рабочих растворах, при этом отбирают пробы сухого вещества и дезинфицирующих растворов. Отмечают дату взятия пробы, когда и кем приготовлен дезраствор, какая концентрация указана на этикетке. Делается заключение о правильности приготовления растворов. Контроль доставки проб осуществляет старшая медицинская сестра. Этот метод контроля позволяет при обнаружении погрешностей назначить повторную дезинфекцию для их устранения.
Бактериологический контроль (его осуществляет лаборант или врач дезстанции) является внезапным для персонала, осуществляющего обработку. Пробы отбирают не позже 1 часа по окончании дезинфекции. Смывы берут с медицинского инструментария (в количестве 1 % от числа шприцев, игл и т. д.), со столовой и чайной посуды, с предметов ухода, с рук и халатов медицинского персонала и т. д.
Стерилизация медицинская — полное освобождение вещества или предмета от микроорганизмов, т. е. уничтожение вегетативных и споровых патогенных и непатогенных форм путем воздействия на него физических или химических агентов.
Стерилизации подвергают все изделия медицинского назначения, соприкасающиеся с раневой поверхностью, контактирующие с кровью или инъекционными препаратами, а также отдельные виды медицинских инструментов, которые в процессе эксплуатации соприкасаются со слизистой оболочкой и могут вызвать ее повреждение.
Обработка изделий, подлежащих стерилизации, включает три этапа:
2. Предстерилизационная очистка,
Первый этап - дезинфекция медицинских инструментов - описана в предыдущем разделе.
Второй этап обработки инструментов, подлежащих стерилизации, - предстерилизационная очистка имеет целью удаление белковых, жировых, механических загрязнений и остаточных количеств лекарственных препаратов.
Предстерилизационную очистку осуществляют механизированным или ручным способами с использованием разрешенных моющих средств. Разъемные изделия подвергают предстерилизационной очистке в разобранном виде и с заполнением каналов.
Механизированную очистку проводят в моечных машинах специального назначения: для игл, шприцев, различных инструментов.
Ручным способом обработку проводят в следующей последовательности:
Промывание изделия проточной водой в течение 0,5 мин;
Замачивание при полном погружении изделия на 15 мин при 50 °С в моющем растворе 0,5 % "Биолот" или 0,5 % растворе перекиси водорода с 0,5 % одного из синтетических моющих средств (CMC): "Лотос", "Лотос-автомат", "Астра", "Айна", "Маричка", "Прогресс";
Мойка каждого изделия в том же моющем растворе с помощью ватно-марлевого тампона или ерша в течение 0,5 мин;
Ополаскивание проточной, а затем дистиллированной водой;
Сушка горячим воздухом при температуре 75-87 °С в сушильных шкафах до полного исчезновения влаги.
Известно, что перекись водорода вызывает коррозию инструментов из коррозионно-неустойчивых металлов, поэтому в моющий раствор целесообразно добавлять ингибитор коррозии в концентрации 1,4 г/л.
Раствор "Биолот" для замачивания и мойки изделий применяют однократно, а моющий раствор перекиси водорода с CMC можно использовать в течение суток.
В настоящее время созданы средства, сочетающие дезинфицирующие и моющие свойства и позволяющие проводить одновременно дезинфекцию и предстерилизационную очистку инструментов в один этап ("Лизетол АФ", "Септодор-Фор- т е", "Деконекс Денталь ББ", "Дюльбак", "Гротанат"). С этой же целью можно применять "нейтральные" анолиты, получаемые на диафрагменных электрохимических установках из растворов поваренной соли. Католиты, получаемые в катодных камерах установок, обладают только моющими свойствами, их применяют для предстерилизационной очистки инструментов из любых материалов.
Контроль качества предстерилизационной обработки проводят выборочно (1% изделий каждого наименования) путем постановки ряда проб: на наличие крови — с помощью азопирамовой, на наличие щелочных компонентов моющих средств — фенолфталеиновой пробой.
Азопирам, кроме следов крови, выявляет наличие на изделиях остаточных количеств пероксидаз растительного происхождения, хлорамина, хлорной извести, стирального порошка с отбеливателем, а также ржавчины и кислот.
Контролю на наличие жира подвергают шприцы, использованные для масляных инъекций, проводят пробу с Суданом III.
При положительной пробе на кровь, моющее средство или жир всю партию контролируемых изделий подвергают повторной обработке до получения отрицательных результатов.
Примечание: проба считается положительной, если цвет реактива изменился на сине-фиолетовый, что свидетельствует о наличии хлорсодержащих окислителей, ржавчины. Розовое окрашивание свидетельствует о наличии моющего средства со щелочной реакцией.
Фенолфталеиновая проба. Готовят 1%-ный спиртовой раствор фенолфталеина. Спиртовой раствор фенолфталеина может храниться во флаконе с притертой пробкой в холодильнике в течение 1 месяца.
Методика постановки проб. Контролируемое изделие протирают марлевой салфеткой, смоченной реактивом, или две-три капли реактива с помощью пипетки наносят на изделие, на корпус инструментария, в просвет иглы Результат оценивается в течение двух минут. При отрицательной пробе цвет реактива не изменяется.
Примечание: эта проба свидетельствует о качестве очистки инструментов от моющего средства. При положительной пробе цвет реактива изменится от розового до малинового.
Стерилизацию изделий медицинского назначения осуществляют следующими методами:
термическим (паровые, воздушные, гласперленовые стерилизаторы);
химическим (растворы химических веществ, газовая стерилизация);
радиационным (установки с радиоактивным источником излучения).
В последнее время на основе принципиально новых технологий созданы плазменные стерилизаторы, использующие энергию воздействия потока активированных молекул инертного газа, ускоренных в электрическом поле, на поверхность стерилизуемых объектов, а также озоновые стерилизаторы.
Оптимальный метод стерилизации определяют с учетом материала, из которого состоит обрабатываемое изделие, его конструктивного исполнения, необходимости длительного сохранения стерильности и др.
В практике работы ЛПО наиболее широко применяют термический метод стерилизации с использованием паровых и воздушных стерилизаторов.
Паровой метод стерилизации. В паровых стерилизаторах обрабатывают хирургическое белье, перевязочный материал, хирургические инструменты, детали приборов и аппаратов из коррозиестойких материалов, стекла (в том числе шприцы с пометкой 200 °С), резины (катетеры, зонды, трубки, перчатки), текстильных материалов.
Стерилизующим агентом является насыщенный водяной пар под избыточным давлением. Температурный режим стерилизации в современных паровых стерилизаторах варьирует от 126 до 141 °С, а время стерилизации соответственно от 3 до 10 мин.
Эффективность стерилизации в паровом стерилизаторе зависит от правильного выбора упаковки, соблюдения правил загрузки и плотности загрузки для свободного прохождения пара.
Воздушный метод стерилизации. В воздушных стерилизаторах стерилизующим агентом является сухой горячий воздух, при этом не происходит увлажнения упаковки и изделий и не наблюдается коррозия коррозионно-неустойчивых металлов, не осложняются условия сохранения стерильности. Однако по эффективности воздействия на микроорганизмы он уступает пару, и для обеспечения стерилизации требуются более высокие температуры. Режимы стерилизации воздушным методом в стерилизаторах нового поколения характеризуются температурой от 160 до 200 °С и временем стерилизации от 30 до 120 мин.
Воздушным методом стерилизуют хирургические и гинекологические инструменты, детали и узлы приборов и аппаратов, в том числе изготовленных из коррозионно-неустойчивых материалов, инъекционные иглы, шприцы с пометкой 200 °С и др.
Газовый метод стерилизации. Стерилизацию в газовых стерилизаторах осуществляют при невысоких температурах (18 - 80 °С) с применением оксида этилена, смеси ОБ (смесь оксида этилена и бромистого метила в весовом соотношении 1:2,5), а также паров раствора формалина в этиловом спирте. Изделия стерилизуют в упаковке из полиэтиленовой пленки, пергамента или бумаги оберточной марки. Газовую стерилизацию в качестве "холодного" метода используют для термолабильных изделий медицинского назначения из полимерных материалов (резины, пластмассы), колющих, режущих хирургических инструментов, имеющих зеркальные поверхности, оптического оборудования (эндоскопы), кардиостимуляторов, предметов одноразового пользования.
Срок хранения изделий, стерилизованных газовым методом в полиэтиленовой пленке, — годы, в остальных упаковках — 20 сут.
Метод стерилизации с помощью растворов химических средств. Для стерилизации рекомендованы растворы: анолит нейтральный, "Бианол", Тигасепт ФФ", глутаровый альдегид, ^Дюльбак растворимый", "Колдспор", "Лизоформин 300", 'Первомур" (4,8 %), перекись водорода (6 %), "Сайдекс"
В растворах химических веществ обрабатывают инструменты из коррозиестойких материалов, изделия из стекла, пластмасс, металла (сплавы титана), резины на основе силиконового каучука, в том числе эндоскопы. Лигатурный шовный материал может быть стерилизован первомуром в концентрации 4,8 % в отличие от первомура для обработки рук (2,4 %).
Гласперленовые стерилизаторы используют для стерилизации мелких стоматологических инструментов. В качестве стерилизующей среды — нагретые стеклянные шарики.
Радиационный метод стерилизации — ведущий метод промышленной стерилизации на предприятиях, выпускающих стерильные изделия медицинского назначения однократного применения: пластмассовые зонды, катетеры, трубки, системы для взятия и переливания крови, акушерские комплекты, перевязочный материал.
Стерилизующим агентом являются ионизирующие гамма-и бета-излучения. Энергия используемых для стерилизации излучений не вызывает наведенной радиации у стерилизуемых изделий. Срок сохранения стерильности в индивидуальной упаковке из полиэтиленовой пленки исчисляется годами, но ограничивается сроком годности изделия к использованию и указывается на упаковке.
Контроль стерилизации проводят с помощью физического и химического методов.
Физический метод контроля работы стерилизаторов осуществляют с помощью контрольно-измерительных приборов, фиксирующих температуру, давление и время.
Химический метод состоит в использовании химических тестов и термохимических индикаторов, которые размещают в стерилизационной камере в контрольных точках при каждой закладке инструментов и материалов как вне упаковок, так и в стерилизационные коробки (биксы) и внутри упаковок. При обнаружении неудовлетворительных результатов контроля загрузку считают нестерильной.
Эффективность стерилизации контролируют бактериологическим методом, используя биотесты стерилизации, представляющие собой объекты (флаконы, фольгу и др.), обсемененные тест-микроорганизмами, например спорами B.stearother-mophilus или В. Ucheniformis. На основании гибели тест-микроорганизмов делают заключение об эффективности процесса.
Контроль стерильности заключается в определении на изделиях, подвергнутых стерилизации/ тест-микроорганизмов, способных к размножению.
Качество дезинфекционных мероприятий устанавливается контролем, который проводится визуальным, химическим и бактериологическим методами. В практических условиях указанные методы используют одновременно.
| Рис.43 Контроль содержания действующих веществ |
Кроме того, обращают внимание:
- на грамотность персонала;
- на добросовестность персонала;
- на обеспечение дезинфекции (ёмкости, мензурки, мерки);
- на укомплектованности смены (санитарки, младшие медицинские сестры, медсестры).
Химический контроль. Этот вид контроля используют для определения содержания действующих веществ (рис.43), соответствия концентрации рабочих растворов концентрациям, предусмотренным инструкциями. При отборе проб отмечают дату их взятия, когда и кем приготовлен дезинфицирующий раствор, какая концентрация указана на этикетке. Обнаружение во взятых пробах меньшего, чем требуется, количества действующего вещества служит
доказательством плохого выполнения дезинфекции.
При контроле проведения профилактической дезинфекции, а в некоторых случаях (при отсутствии бактериологической лаборатории) и при проведении очаговой дезинфекции может быть применен йодкрахмальный метод контроля применения хлорсодержащих препаратов. Метод основан на цветной реакции йода с крахмалом. Если прикоснуться смоченным этим составом тампоном к орошенной хлорсодержащим раствором поверхности, то на поверхности контролируемого объекта появляется специфическое окрашивание.

Этим методом следует контролировать обеззараживание поверхностей тех предметов, которые представляют эпидемическую опасность: посуду для еды и выделений, игрушки, полы, стены, подоконники, мебель, полки и другие вещи, увлажняемые во время дезинфекции хлорсодержащими дезинфицирующими растворами. Для правильного вывода о тщательности работы дезинфекторов пробы следует брать с возможно большего количества мест. Результаты контроля обнаруживаются мгновенно. Контроль можно проводить внезапно на протяжении первых двух суток после дезинфекции. На горячих поверхностях (печи, батареи отопления) хлор определяется в более короткие сроки.
Бактериологический контроль (рис.44). Этот контроль дезинфекции в очагах кишечных инфекций проводят путем обнаружения санитарно-показательной кишечной палочки методами смыва или соскобов.
| Рис.44 Биологический контроль качества дезинфекции |
Режимы дезинфекции
Режим использования методов и средств дезинфекции зависит от вида обеззараживаемого объекта (предметы ухода, оборудование, медицинский инструментарий), материала, применяемого для изготовления инструмента (металл, резина, пластик, полимеры), способа использования инструментария (многократного и однократного применения).
Механические приёмы дезинфекции основаны на удалении патогенных микробов путем обмывания, вытряхивания, промывания с использованием мыла и синтетических моющих средств.
Физический метод дезинфекции основан на уничтожении или удалении патогенных микроорганизмов с поверхности предметов, подлежащих обеззараживанию путем воздействия ряда физических факторов.
Действия высоких температур: обжигания, прокаливания; кипячения, пастеризации; действия горячего воздуха, высушивания.
Действия лучистой энергии: ультрафиолетового излучения; радиоактивного и ионизирующего излучения; тока ультравысокой частоты.
| Рис.45 Сухожаровой шкаф |

Дезинфекцию изделий из стекла, металлов, термостойких полимерных материалов, резины чаще проводят кипячением в дезинфекционном кипятильнике в дистиллированной воде в течение 30 мин, с добавлением 2% соды - 15 мин.
Воздушный метод дезинфекции применяется для изделий из стекла и металла. Дезинфекцию проводят сухим, горячим воздухом в воздушном стерилизаторе (сухожаровом шкафу) в лотках без упаковки. При температуре 120°С - экспозиция 45 минут (рис.45).


Паровой метод дезинфекцииприменяют для изделий из стекла, металла, резины, латекса и термостойких полимеров. Производится она централизованно, водяным насыщенным паром под избыточным давлением в автоклаве в стерилизационных коробках. Давление - 0,5 атмосферы, температурный режим - 110°С, экспозиция - 20 минут


(рис.46).
| Рис.46 Стерилизаторы паровые |
Химический метод дезинфекции основан на использовании различных химических веществ. Наиболее часто применяют водные растворы. Химические методы дезинфекции применяют для изделий из стекла, коррозионностойких металлов, полимерных материалов, резины. Производят полное погружение в дезинфицирующий раствор, экспозиционная выдержка зависит от применяемого средства и вида обеззараживаемого объекта (рис.47), или 2-кратное протирание салфеткой из бязи, смоченной дезраствором, с интервалом 15 минут (рис.48).


| Рис.47 Химический метод дезинфекции способом погружения в дезраствор |

| Рис.48 Химический метод дезинфекции способом протирания |
Для проведения химического метода дезинфекции в ЛПО могут использоваться дезинфицирующие средства из различных химических групп (рис.49), имеющих государственную регистрацию и сертификат соответствия.
Существует два типа новейших дезинфицирующих средств:
1тип – бактериостатические (прекращают рост)
2 тип – бактерицидные (вызывают гибель).
В настоящее время на рынке представлены как универсальные, так и целевые дезинфицирующие средства.
Универсальные средства предназначены для обеззараживания большинства объектов больничной среды и имеют в связи с этим широкий диапазон режимов применения (концентрация, температура рабочих растворов, время воздействия – экспозиционная выдержка), что требует от персонала четкого выполнения рабочих инструкций. Использование дезинфицирующего средства в неоправданно низких (бактериостатических) концентрациях может привести к селекции высоковирулентных госпитальных штаммов.
Целевые дезинфицирующие средства создаются для обеспечения какого-то одного направления дезинфекционных мероприятий: дезинфекция поверхностей объектов больничной среды, дезинфекция инструментов медицинского назначения, асептическая обработка рук и т.д.
Дезинфицирующие средства




| Рис.49 Современные дезинфицирующие средства |

Приготовление дезинфицирующих растворов различной концентрации, с соблюдением техники безопасности
В настоящее время в лечебно-профилактических организациях России для дезинфекции широко используются несколько десятков наименований дезинфицирующих средств на основе различных биоцидных веществ, способных убивать микроорганизмы. Поэтому все используемые препараты небезопасны для человека. Использование дезинфектантов нового поколения проводится в соответствии с инструкциями фирмы-изготовителя. Для того чтобы выбрать дезинфицирующие средства с минимальным негативным воздействием, необходимо внимательно изучить инструкцию по применению препарата.

Проведение дезинфекционных мероприятий ранее чаще всего проводилось с применением хлорамина и хлорной извести. Они представляют собой белый, мелкий порошок с резким запахом хлора.
| Рис.50 Порошок хлорной извести |
Чтобы использовать хлорную известь в виде растворов, необходимо готовить 10% маточный раствор.
Приготовление маточного раствора хлорной извести:
берут 1 кг сухого препарата, к которому добавляют небольшое количество воды и тщательно перемешивают до получения кашицеобразной консистенции. После чего, продолжая перемешивать, добавляют воду до объема 10л (ведро). Свежеприготовленную 10% хлорную известь оставляют на 24 часа в прохладном темном помещении в закрытой посуде. Целесообразно в течение первых 4-х часов отстаивания не менее 3-х раз проводить перемешивание смеси, чтобы активный хлор перешел полностью в раствор. Через 24 часа осторожно, не взбалтывая, осадка, сливают осветленный раствор для хранения (до 10 дней). За среднее количество активного хлора в сухой хлорной извести применяется 25%. При уменьшении содержания активного хлора необходимо увеличивать количество сухого препарата. В этом случае производят перерасчет по формуле: 25*1000
Х- количество хлорной извести, необходимое для приготовления маточного раствора;
С – концентрация активного хлора в сухом препарате;
25 – среднее содержание активного хлора в сухом препарате.
Приготовление рабочих растворов хлорной извести:
Для приготовления рабочих растворов хлорной извести из 10% раствора пользуются таблицей:
| Концентрация осветленных растворов, % | Необходимое количество 10% маточного осветленного раствора для приготовления 10л рабочего раствора заданной концентрации, мл |
| 0,1 | 100,0 |
| 0,2 | 200,0 |
| 0,5 | 500,0 |
| 1,0 | 1000,0 |
| 3,0 | 3000,0 |
| 5,0 | 5000,0 |

Хлорамин, Б, Т., ХБ (монохлорамин) содержит 25-29% активного хлора (рис.51). Препараты хлорамина хорошо растворяются в воде. В отличие от хлорной извести хлорамин более устойчив к действиям факторов внешней среды и теряет при правильном хранении 0,1-0,2% активного хлора в год.
1. в сухом виде – так же, как хлорная известь
2.
| Рис.51 Хлорамин Б (порошок) |
Так как сухой хлорамин растворяется в воде без остатка, это дает возможность использовать его без предварительного отстаивания, осветления. Растворы хлорамина готовят в соответствии с содержанием хлора в сухом препарате и заданной концентрации раствора. Необходимое количество хлорамина размешивают в воде, лучше подогретой до 50-60°С и доводят раствор до нужного объема. Срок хранения растворов до 15 дней.
Приготовление рабочих растворов хлорамина:
| Концентрация рабочих растворов | Количество хлорамина в граммах на | |
| % | 1л раствора | 10л раствора |
| 0,2 | 2,0 | 20,0 |
| 0,5 | 5,0 | 50,0 |
| 1,0 | 10,0 | 100,0 |
| 3,0 | 30,0 | 300,0 |
| 5,0 | 50,0 | 500,0 |
Кроме традиционных, старых дезинфицирующих средств (хлорамин и хлорная известь) на сегодняшний день существует более 400 новейших дезинфицирующих средств.

Соблюдение техники безопасности при работе с дезинфицирующими средствами
1. К работе с дезинфицирующими препаратами допускаются лица, не моложе 18 лет, прошедшие соответствующий инструктаж по технике безопасности.
2. Лица с повышенной чувствительностью к работе с дезсредствами не допускаются.
3. Хранение и разведение дезинфицирующих средств, проводится в специальных хорошо проветриваемых помещениях, недоступных для посторонних, в таре (упаковке) изготовителя, снабженной этикеткой, на стеллажах, в специально предназначенных местах.
4. Необходимо иметь отдельные емкости с рабочими растворами дезинфекционных средств, используемых для обработки различных объектов:
- для дезинфекции, для предстерилизационной очистки и для стерилизации изделий медицинского назначения, а также для их предварительной очистки (при использовании средств, обладающих фиксирующими свойствами);
- для дезинфекции поверхностей в помещениях, мебели, аппаратов, приборов и оборудования;
- для обеззараживания уборочного материала, для обеззараживания отходов классов Б и В (в случае отсутствия установок для обеззараживания).
5. Емкости с рабочими растворами дезинфекционных средств должны быть снабжены плотно прилегающими крышками, иметь четкие надписи или этикетки с указанием средства, его концентрации, назначения, даты приготовления, предельного срока годности раствора.
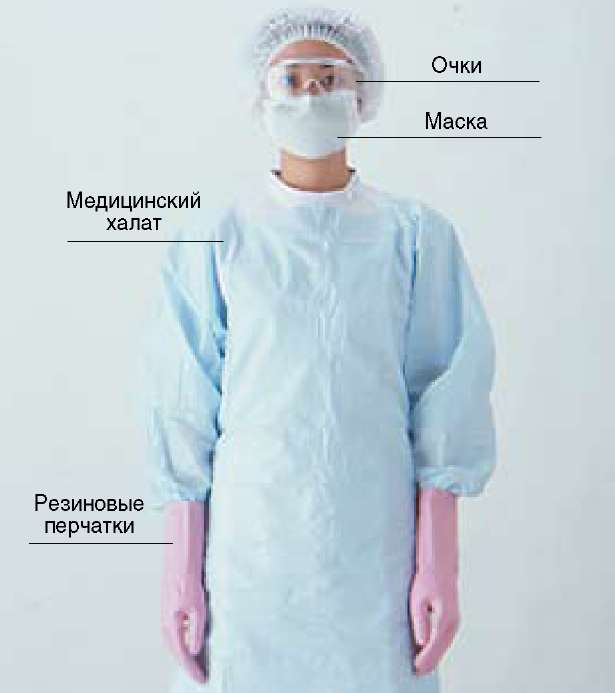
6. При работе с дезинфекционными средствами необходимо соблюдать все меры предосторожности, включая применение средств индивидуальной защиты, указанные в инструкциях по применению (рис.52).
7.
| Рис.52Индивидуальные средства защиты |
8. При работе с дезинфицирующими средствами через каждые 40-50 минут необходимо делать перерыв на 10-15 минут, во время которого обязательно выйти на свежий воздух, снять халат.

Оказание первой помощи при попадании дезинфицирующих растворов на кожу и слизистые
· Характерным для всех применяемых химических средств дезинфекции и стерилизации является раздражающее действие в отношении кожных покровов, слизистых оболочек глаз и верхних дыхательных путей.
· Первая помощь при попадании на незащищенную кожу состоит в немедленном, обильном обмывании пораженного места чистой водой. При поражении формальдегидом лучше обмывать кожу 5 % нашатырного спирта.
· При ингаляционном отравлении, немедленно удалить пострадавшего из помещения на свежий воздух или в хорошо проветриваемое помещение. Необходимо прополоскать рот и носоглотку холодной водой.
В случае отравления формальдегидом рекомендуется вдыхание водяных паров
с добавлением нескольких капель 5% раствора нашатырного спирта.
Во всех случаях показано обильное щелочное питье. По показаниям – сердечно-
сосудистые аналептики, седативные, противокашлевые, вдыхание кислорода.
В тяжелых случаях – госпитализация.
· При попадании любого препарата в глаза немедленно промыть их струей тёплой воды и закапать раствор альбуцида, при болях 1% раствор новокаина.
· При попадании в желудок хлорактивных препаратов промывают желудок 2% раствором гипосульфита и выпить воды с 5 – 15 каплями нашатырного спирта, можно молока, питьевую соду.
При отравлении формальдегидом обычно проводят промывание желудка
с добавлением в воду нашатырного спирта или аммония. После промывания внутрь –
Читайте также:

