Какой отдел нервной системы осуществляет экстракардиальную регуляцию деятельности сердца
Обновлено: 18.05.2024
Согласно аналитическим данным, причиной смерти в течение первой недели заболевания чаще является непосредственно церебральное поражение. Начиная со второй недели, снижение двигательной активности пациента может приводить к смерти от вторичных осложнений: пневмонии, легочной эмболии или сепсиса. В то же время сердечно-сосудистые осложнения отмечаются в течение всего первого месяца и занимают доминирующее положение в структуре смертности у больных с умеренным неврологическим дефицитом [4]. В целом, в первый месяц после инсульта причиной 51% летальных исходов становятся осложнения непосредственно поражения мозга, 22% – респираторные инфекции, 12% – осложнения со стороны сердечно-сосудистой системы, которые, однако, в течение года увеличиваются до 28% [5]. В конечном итоге, у пациентов с ишемическим поражением головного мозга смертность от кардиальных причин превалирует над таковой непосредственно от инсульта [6, 7].
С одной стороны, это обусловлено широким распространением заболеваний сердца в популяции больных. Так, у большинства пациентов с ишемическим инсультом (до 75%) выявляется сопутствующая кардиальная патология: ишемическая болезнь сердца (ИБС), инфекционно-воспалительные заболевания сердца, пороки сердца различной этиологии и нарушения ритма сердца [8, 9, 10]. Кроме того, более 80% больных с инсультом страдают артериальной гипертензией [2], сопровождающейся формированием гипертрофии левого желудочка (ЛЖ). На этом неблагоприятном фоне стрессовое воздействие острого сосудистого поражения мозга провоцирует развитие фатальных аритмий, которые становятся причиной смерти больного.
С другой стороны, нарушения работы сердца могут быть обусловлены непосредственно повреждением головного мозга. Так, показано появление различных электрокардиографических феноменов в острейшей фазе инсульта: изменения сегмента ST или инверсия зубца T, периодическое появление волн Q, напоминающих изменения при инфаркте миокарда 12. Продемонстрировано сочетанное поражение гипоталамуса и развитие некротических изменений миокарда у пациентов с субарахноидальным кровоизлиянием. Причем при последующей терапии фентоламином и пропранололом в одной группе больных и плацебо – в другой, некротические изменения миокарда нивелировали в первой группе [14]. Полученные данные указывают на активацию связей между сердцем и головным мозгом при поражении центральной нервной системы (ЦНС). Это позволяет обсуждать сложное и многостороннее влияние мозгового поражения на функцию органов и систем, нарушение деятельности которых, в свою очередь, способно привести к срыву витальных функций и внезапной смерти [15, 16]. Внезапная смерть может наступить вследствие ряда причин, некоторые из которых определяются при аутопсии (разрыв аневризмы, эмболия легочной артерии, инфаркт миокарда), другие – остаются неизвестными. Большинство исследователей полагают, что в последнем случае наиболее вероятно развитие фатальных сердечных аритмий [17, 18].
Одними из первых работ, доказавшими взаимосвязь между поражениями головного мозга и нарушениями ритма сердца, а также смертностью от сердечно-сосудистых заболеваний, включая внезапную сердечную смерть, стали исследования L. Reinstein, S. Lavy и J.R. Mikolich [12, 19, 21]. Обнаружено, что стимуляция отдельных зон гипоталамуса, преимущественно задней группы ядер, вызывала появление желудочковых аритмий, а стимуляция передней группы ядер у кошек на фоне приема дигиталиса оказывала протекторное действие [20].
Результаты исследований нарушений иннервации миокарда при внезапной смерти и сопоставление полученных данных с морфобиохимическими особенностями гипоталамуса, продолговатого мозга и состоянием экстракардиальных рецепторных зон подтвердили их связь с нервно-регуляторными метаболическими расстройствами. Установлено, что после значительного истощения содержания норадреналина во внутрисердечных сплетениях, то есть после нарастающей десимпатизации миокарда, возникает предрасположенность к развитию фибрилляции желудочков вследствие развивающейся повышенной чувствительности кардиомиоцитов к медиатору, усиленный выброс которого, возможно, связан с повышением функциональной активности гипоталамо-гипофизарной нейросекреторной системы [22].
При остром инсульте высокая активность симпатической нервной системы, сопровождающаяся повышением уровня катехоламинов, приводит к развитию аритмий, изменениям на электрокардиограмме и ишемическим поражениям миокарда, которые оказывают влияние на исход заболевания и ведут к увеличению риска внезапной смерти [12, 20, 21, 23-26].
Поскольку внезапная смерть представляет собой значительную медико-социальную проблему, выявление лиц с риском этого события имеет большое значение. У пациентов с наличием сердечно-сосудистого заболевания риск внезапной смерти повышается при уменьшении таких маркеров активности блуждающего нерва, как чувствительность барорефлекса [27], изменчивость частоты сердечных сокращений (ЧСС) [28], восстановление ЧСС после теста с физической нагрузкой [29]. Доказано, что реакции вегетативной нервной системы (ВНС) могут служить провоцирующим фактором развития аритмий у больных с патологическими изменениями в сердце, например при наличии дополнительных проводящих путей или при дилатации предсердий, ИБС и гипертрофии ЛЖ [17, 30]. Предполагается, что дисфункция вегетативной регуляции сердечно-сосудистой системы влияет на выживаемость после инсульта [31].
Вариабельность сердечного ритма как индикатор состояния ВНС
Изменение деятельности сердечно-сосудистой системы, в том числе сердечного ритма, является наиболее ярким индикатором отклонений, возникающих в регулирующих системах. Они предшествуют гемодинамическим, метаболическим, энергетическим нарушениям и могут быть наиболее ранними прогностическими признаками неблагополучия у пациента. Так, в эпидемиологических исследованиях установлена взаимосвязь между профилем ЧСС до и после физической нагрузки и показателями ЧСС в покое и смертностью от сердечно-сосудистых причин [29, 30]. В последнее время для оценки риска развития неблагоприятных сердечных событий широко используется анализ вариабельности сердечного ритма (ВСР), которая представляет собой временные колебания интервалов между последовательными ударами сердца (интервалов RR) и рассматривается как маркер активности ВНС [28, 33-36].
Ранее для оценки состояния автономной нервной системы использовались такие показатели, как ЧСС, величина артериального давления (АД), частота дыхания, вегетативный индекс Кердо, коэффициент Хильдебранта, а также клинические показатели, отражающие суммарную активность ВНС [37]. Однако эти методы не позволяют оценить значение симпатического и парасимпатического звеньев ВНС в зависимости от особенностей адаптационной реакции организма на стрессовое воздействие [38], тогда как анализ ВСР предоставляет возможность оценки всех составляющих нейрогуморальной регуляции сердца [39, 40].
В зависимости от научных или практических задач динамический ряд кардиоинтервалов можно анализировать на основе использования различных теоретических концепций [41]. Наиболее близкая клинической практике концепция рассматривает изменения сердечного ритма как результат активности различных звеньев ВНС, модулирующих сердечную деятельность. С этой точки зрения спектральный анализ ВСР с выделением мощности основных периодов колебаний (высокочастотного, низкочастотного, очень низкочастотного) позволяет изучать активность составляющих автономной нервной системы (парасимпатическое и симпатическое звено) и влияние определенных мозговых структур на деятельность ВНС.
Нейрогенная природа колебаний ВСР подтверждается тем, что компоненты спектра исчезают после денервации сердца. Например, они отсутствуют у пациентов с трансплантированным сердцем [42] и у собак при фармакологической блокаде вегетативных влияний [43].
По мнению многих авторов, высокочастотная составляющая спектра ВСР связана с активностью ядра блуждающего нерва и оказываемыми влияниями на синусовый узел [39, 40, 43-45]. Кроме того, рассматривают возможный центральный механизм формирования высокочастотных колебаний в результате прямого взаимодействия дыхательного и сосудистого центров, а также барорефлекторный механизм за счет колебаний АД [46]. В целом, по значениям спектральной мощности в высокочастотном диапазоне судят о состоянии парасимпатической нервной системы, что подтверждается клиническими наблюдениями у пациентов с автономными нейропатиями [20].
Природу низкочастотной составляющей ВСР ранее объясняли изменением тонуса симпатической нервной системы. В дальнейшем большинство авторов подтвердили связь низкочастотных колебаний с барорецепторной функцией регуляции АД [43, 45, 47], которая осуществляется с участием как парасимпатической (афферентное звено барорефлекса, эфферентные волокна блуждающего нерва), так и симпатической (кардиоакселераторные постганглионарные волокна) вегетативной иннервации [48]. Таким образом, этот параметр отражает суммарный эффект вегетативной регуляции на ритм сердца.
Формирование очень низкочастотных волн в спектре ВСР, по-видимому, обусловлено влиянием надсегментарных отделов ВНС, эндокринных или гуморальных факторов на синусовый узел. Показано, что в ВСР имеются очень низкочастотные ритмы, обусловленные секрецией ренина [43], а также связанные с колебаниями в крови уровня адреналина, норадреналина и 17-оксикортикостероидов [49]. Полагают, что основной (околонулевой) пик данного диапазона связан с активностью надсегментарных (гипоталамических) эрготропных центров вегетативной регуляции [39]. Причем очень низкочастотная составляющая минимальна в спектре у здоровых лиц и грубо нарушается при органических поражениях (опухоли, инсульты, паркинсонизм) правого полушария, ответственного за вегетативную регуляцию [37, 50]. Таким образом, ВСР представляет собой маркер деятельности ВНС, а высокочастотная, низкочастотная и очень низкочастотная составляющие ВСР имеют вегетативные корреляты и могут использоваться для количественной неинвазивной оценки разных уровней автономной регуляции у пациентов и здоровых лиц.
Структурно-функциональные уровни вегетативной регуляции сердечного ритма
Изменение ритма сердца – универсальная реакция целостного организма в ответ на воздействие внешней и внутренней среды, отражающая результат многочисленных регуляторных влияний на сердечно-сосудистую систему. Иерархическая структура уровней регуляции включает нервный аппарат самого сердца, спинной мозг, ствол мозга, область гипоталамуса и кору головного мозга [20, 37].
Сердце представляет собой обильно иннервированный орган. Его основная функция – обеспечение системной гемодинамики и жизнедеятельности всех органов. Первым уровнем системы регуляции работы сердца можно считать механизм внутрисердечного регулирования [51]. Именно поэтому влияние на формирование картины ВСР оказывают не только тонус автономной нервной системы, но и состояние миокарда, проводящей системы сердца, что особенно значительно именно у больных с кардиальной патологией. Модулирующее воздействие ВНС изменяет порог спонтанной деполяризации пейсмекеров синусового узла. Можно выделить два уровня вегетативной регуляции деятельности сердечно-сосудистой системы: сегментарный (периферический) и надсегментарный (центральный) [20, 37].
Истинно вегетативные аппараты составляют сегментарную ВНС, которая в 1903 г. была разделена Лэнгли на симпатическую и парасимпатическую на основании различного положения клеточных групп в спинном мозге и стволе головного мозга, функционального антагонизма этих двух частей и их различной фармакологической реакции на адреналин, пилокарпин и атропин. Вегетативная иннервация различных отделов сердца неоднородна и несимметрична. В частности, в узловой ткани преобладают эффекты парасимпатической нервной системы, реализуемые через блуждающий нерв, а в миокарде желудочков – симпатического отдела. В норме регуляция ритма сердца находится под доминирующим влиянием парасимпатического отдела ВНС, увеличение тонуса которого значительно уменьшает склонность миокарда нормальных и ишемизированных желудочков к развитию фибрилляций [52].
На спинальном уровне регуляция сердечного ритма представлена симпатической составляющей. У пациентов с тетраплегией вследствие поражения шейного отдела спинного мозга симпатические нервные волокна, направляющиеся к синусовому узлу, интактны, а симпатические нейроны лишены влияния супраспинальных структур. При этом присутствие низкочастотного компонента в спектре ВСР объясняют его формированием за счет барорефлекторного механизма и влияний блуждающего нерва, не требующих активации симпатических нейронов спинного мозга вышележащими структурами [53].
Образования ствола мозга обеспечивают поддержание вегетативного тонуса в условиях обычной жизнедеятельности. В продолговатом мозге афферентные нервные волокна от хеморецепторов и рецепторов растяжения миокарда, идущие в составе блуждающих нервов или симпатических нервных волокон спинного мозга, заканчиваются в ядре одиночного пучка, дорсальном ядре блуждающего нерва и вставочных нейронах бульбарного сосудодвигательного центра (СДЦ). Согласно традиционному представлению о СДЦ, замыкание большинства кардиорефлекторных дуг происходит на этом уровне, однако в настоящее время установлено, что афферентные проекции достигают гипоталамуса, лимбической коры и коры полушарий головного мозга. Поэтому СДЦ можно охарактеризовать как диффузную сеть функционально связанных нейронов, расположенных на различных уровнях ЦНС. В целом, в стволе мозга выделяют два функциональных блока ядер: обеспечивающий парасимпатическую эфферентную импульсацию и катехоламинсодержащие клеточные группы [20].
Лимбическая система также участвует в обеспечении вегетативных, висцеральных и гормональных функций. Она включает в себя анатомические образования головного мозга, объединенные между собой функциональными связями и участвующие в организации эмоционально-мотивационного поведения [37]. Структуры, составляющие лимбическую систему, относятся к конечному, промежуточному, среднему мозгу и мосту. Миндалина – одно из полифункциональных образований лимбической системы. Ее функции непосредственно связаны с обеспечением вегетативных эффектов и регуляцией сердечной деятельности.
Кора головного мозга является высшим регуляторным центром интегративной деятельности, активируя как моторные, так и вегетативные центры. Обеспечение функций ВНС на этом уровне находится в тесной взаимосвязи с теорией функциональной межполушарной асимметрии [54, 55]. Подчеркивается преимущественно правополушарное обеспечение вегетативной регуляции ритма сердца [37, 50], хотя до сих пор этот вопрос остается недостаточно изученным.
Таким образом, ВСР отражает результат многоступенчатого регуляторного влияния ЦНС на работу сердца и патологические изменения на любом из уровней, как сегментарном, так и надсегментарном, могут приводить к неблагоприятным последствиям, в том числе к внезапной смерти.
Клиническое значение ВСР
Клиническое значение ВСР впервые оценили в 1965 г., когда Hon и Lee отметили, что дистрессу плода предшествовала альтернация интервалов между сокращениями до того, как произошли какие-либо различимые изменения сердечного ритма [40]. Двадцать лет спустя B.M. Sayers et al. обратили внимание на присутствие физиологических ритмов в сигнале сердцебиения [56].
Рецептивное поле афф.нерв нервный центр эфф.нерв сердце
А. Рецептивные поля экстракардиальных рефлексов:
а) интерорецепторы б) экстеророрецепторы
внутрисердечные сосудистого русла внутренних органов
ИНТЕРОРЕЦЕПТОРЫ
Внутрисердечные рецепторы – это механорецепторы растяжения А и В.
А–механорецепторы возбуждаются только в условиях активного напряжения (в систолу)
В–механорецепторы возбуждаются только при пассивном растяжении (в диастолу)
При изменении состояния этих рецепторов возникают кардио-кардиальные рефлексы: если в систолу сила мышечного сокращения увеличена, то благодаря кардио-кардиальному рефлексу с А-механорецепторов сила сердечных сокращений нормализуется. При увеличении притока крови к миокарду в диастолу в результате пассивного растяжения стенки миокарда и возбуждения В-механорецепторов сила сердечных сокращений усиливается, и этот объем крови выталкивается в сосудистое русло.
Интерорецепторы сосудистого русла – это барорецепторы, которые расположены во всех стенках приходящих и отходящих сосудов сердца. Места их скопления называются рефлексогенными сосудистыми зонами: дуга аорты, каротидный синус, легочная артерия, устье полых вен. При изменении давления в этих сосудах, обусловленном работой сердца, возникает экстракардиальный рефлекс, в условиях которого так изменяется работа сердца (сила и частота сокращения), что давление нормализуется.
Интерорецепторы внутренних органов (брюшины) – рефлекс Гольца; изменение работы сердца в условиях воспаления брюшины; глазо-сердечный рефлекс Данини-Ашнера.
ЭКСТЕРОРЕЦЕПТОРЫ кожи – температурные, тактильные и болевые: при раздражении этих рецепторов возникают рефлекторные изменения работы сердца.
В. Афферентные нервы сердца – афферентное звено экстракардиальных рефлесков.
Преимущественно это веточки блуждающего нерва, они миелинизированы. Существуют и симпатические афферентные нервы сердца, они немиелинизированы, к ним относятся симпатические нервы, отходящие от субэндокардиального нервного сплетения (с ними связано проведение болевой чувствительности от сердца, при этом наблюдается сегментарная иррадиация сердечных болей).
С. Центральное звено экстракардиальных сердечных рефлексов – нервный центр регуляции сердечной деятельности.
Нейроны, обеспечивающие нервную регуляцию сердечной деятельности, залегают на различных уровнях ЦНС:
Высший центр регуляции – нейроны новой коры и лимбической системы мозга. Нейроны нервного центра сердечной деятельности новой коры близко расположены к корковым центрам двигательных реакций. Поэтому происходит оптимальное вегетативное обеспечение (через работу сердца) всех поведенческих реакций.
ІІ уровень – гипоталамус – как высший интегративный центр сердечной деятельности обеспечивает приспособление работы сердца и любого другого отдела ССС к потребностям организма, возникшим в ответ на изменение условий окружающей среды.
ІІІ уровень – продолговатый мозг–ядро Х пары ч.м.н.+Th1-5 спинного мозга Нейроны этого центра находятся в постоянном тонусе. Центральный тонус характерен нейронам ядра блуждающего нерва. Его поддержка осуществляется афферентацией от рецепторов каротидного синуса и дуги аорты. При перерезке этих афферентных нервов работа сердца учащается и усиливается как при перерезке самих блуждающих нервов, иннервирующих сердце. При перерезке симпатических афферентных нервов работа сердца не учащается, отсюда делается вывод о том, что в нормальных физиологических условиях тонус афферентных блуждающих нервов превалирует над тонусом афферентных симпатических нервов. В пользу последнего свидетельствует тот факт, что при полной денервации сердца его автоматические сокращения происходят с гораздо большей частотой, чем при сохраненной иннервации. В то же время, тонус вагуса находится в зависимости от дыхательного цикла: в конце вдоха его активность повышается, что сопровождается урежением частоты сердечных сокращений – дыхательная аритмия.
Д. Эфферентные нервы сердца (иннервация сердца)
Осуществляется симпатическими (от Th1-5) и парасимпатическими (n. vagus) нервными волокнами. Симпатическая иннервация обеспечивает равномерное распределение нервных симпатических окончаний в миокарде как предсердий, так и желудочков. Парасимпатические нервы как ветви блуждающего нерва – правая и левая – осуществляет:
n.v.d. – иннервирует синоатриальный узел и миокард предсердий;
n.v.s. – атриовентрикулярный узел.
История открытия парасимпатических и симпатических влияний на работу сердца
Парасимпатические влияния – братья Веберы, 1845 г. – торможение работы сердца до полной остановки в диастолу. Первое открытие тормозного влияния нерва.
Симпатические влияния – братья Ционы, 1867 г. – положительный хронотропный эффект.
Иннервация сердца двойная – симпатическая и парасимпатическая.
Четыре нерва сердца.
8 сердечных влияний (эффектов).
Механизм влияния парасимпатической нервной системы:
Медиатором является ацетилхолин. В результате его действия в атипических мышечных волокнах замедляется медленная диастолическая деполяризация, вплоть до ее исчезновения. В клетках миокарда отмечается гиперполяризация, что сопровождается снижением возбудимости. В атриовентрикулярном узле при раздражении сердечных парасимпатических веточек наблюдается полная атриовентрикулярная блокада – механизм: инактивация натрий-кальциевого насоса, снижение селективной проницаемости мембраны вплоть до полного исчезновения этого свойства мембраны и одновременное усиление К-проницаемости – поэтому данное раздражение сопровождается остановкой сердца в диастолу. Влияние АХ является локальным, т.к. сразу же действует холинэстераза, разрушающая этот медиатор.
Механизм влияния симпатической нервной системы:
Медиатором является норадреналин. НА долго разрушается, поэтому при стимуляции симпатических сердечных ветвей наблюдается длительный эффект последействия. Учащение сердечной деятельности по механизму возникновения является следствием активации кальциевых и натриевых каналов, ускорения медленной диастолической деполяризации.
Рефлекторные изменения работы сердца в условиях активации блуждающих эфферентных нервов называются вагальными рефлексами, при активации симпатических эфферентных нервов – симпатическими рефлексами.
Регуляция сердца предполагает четкое взаимоотношение его отделов, тонкое приспособление к запросам системы кровообращения и организма в целом.
При этом механизмы его регуляции относительно автономны, обеспечивая работу сердца как насоса в самых сложных условиях (рис. 1). Так, при нагрузке МОК увеличивается с 4-6 л/мин до 25-30 л/мин.

Рис. 1. Механизмы регуляции сердца
Сердце приспосабливается к колебаниям венозного возврата и системного сосудистого сопротивления ( давление в аорте ). При этом обеспечивается выбрасывание одинакового количества крови левым и правым желудочками сердца. Если выброс крови правым желудочком будет больше левого на 2%, то в течение нескольких минут развивается отек легких.
Таким образом, механизмы регуляции деятельности сердца решают 3 основных задачи:
- Согласованной работы разных отделов сердца.
- Соответствие работы сердца венозному возврату и давлению в аорте.
- Поддержания оптимального для состояния организма артериального давления.
Регуляторные механизмы сердца делятся на две группы (рис. 1):
- механизмы саморегуляции, включающие в себя миогенную саморегуляцию и интракардиальные рефлексы;
- экстракардиальную регуляцию, включающую экстракардиальные собственные и сопряженные рефлексы, а также эндокринную регуляцию.
Саморегуляция сердца. Является основой регуляции деятельности сердца. Внутриклеточные механизмы саморегуляции обеспечивают регуляцию синтеза сократительных белков, митохондрий и массы миокарда.
Миогенные механизмы саморегуляции сердца обеспечивают соответствие сердечного выброса венозному возврату и его постоянство при изменении давления в аорте. Выделяют механизмы гетерометрической и гомеометрической саморегуляции.
Гетерометрическая саморегуляция. Названа так потому, что работа сердца изменяется при действии внешних факторов, изменяющих длину сердечной мышцы. Обеспечивает соответствие сердечного выброса венозному возврату. Доказана Франком на сердце лягушки и Старлингом на сердечно-легочном препарате сердца собаки.
В конечном итоге был сформулирован закон Франка-Старлинга – сила сокращения сердца в систолу пропорциональна его наполнению в диастолу, или сила сокращения волокон миокарда является функцией от их конечно- диастолической длины.
Механизм гетерометрической саморегуляции состоит в том, что при растяжении мышцы увеличивается количество свободных активных центров актина и улучшаются условия электромеханического сопряжения.
Гомеометрическая саморегуляция. При этом виде саморегуляции изменения силы сокращения сердца не связаны с изменением длины сердечной мышцы. Обеспечивает постоянство сердечного выброса при изменении давления в аорте. Экспериментальное повышение давления в аорте приводит к увеличению силы сокращения сердца (эффект Анрепа).
Уменьшение давления приводит к обратному эффекту. Полагают, что увеличение давления в сосудах сердца способствует улучшению мета- болизма миокарда и, как следствие, увеличению силы сокращений.
Примером этого вида саморегуляции является феномен, открытый Боудичем – лестница Боудича. При ритмической стимуляции остановившегося сердца сила сокращений в определенных пределах нарастает. В основе механизма лестницы Боудича лежит увеличение концентрации внутриклеточного кальция, и, соответственно, улучшение электромеханического сопряжения.
Интракардиальные рефлексы. Характиризуются тем, что рецепторы и центральная часть рефлекторной дуги расположены в сердце – в интрамуральных ганглиях. Растяжение правого предсердия приводит к увеличению силы сокращений правого и левого желудочков. Аналогичная рефлекторная реакция возникает при растяжении левого предсердия.
Увеличение сопротивления выбросу из левого желудочка приводит к рефлекторному усилению сокращений правого. Эти рефлексы обеспечивают не только увеличение силы сокращений, но изменяют и возбудимость и проводимость соответствующих отделов сердца. Рефлекторный характер реакций доказывается устранением эффекта при обработке новокаином и аноксии.
Саморегуляторные миогенные механизмы и интракардиальные рефлексы обеспечивают эффективную регуляцию органа. Благодаря их существованию становится возможной пересадка сердца, так как трансплантант может эффективно функционировать, приспосабливаясь к изменениям венозного возврата и сопротивлению сердечного выброса.
Иннервация сердца. Обеспечивается симпатическими и парасимпатическими волок- нами (рис. 2). Ядра вагуса заложены в продолговатом мозге. Преганглионарные волокна прерываются в интрамуральных ганглиях сердца. Иннервируют преимущественно водители ритма и предсердия. При слабом раздражении проявляются отрицательные инотропный (снижается сила сокращений) и хронотропный (снижается частота сокращений) эффекты. Сильное раздражение вагуса может привести к временной остановке сердца.
Ядра симпатических нервов сердца заложены в 5 верхних грудных сегментах спинного мозга. Преганглионарные волокна прерываются в шейном и верхнем грудных симпатических узлах. Иннервируют преимущественно миокард желудочков. Симпатическая система влияет на работу сердца и гуморально посредством выброса адреналина и норадреналина. Эффекты симпатической стимуляции положительные: хронотропный, инотропный.
У человека и большинства млекопитающих в состоянии покоя преобладает тонус ядер вагуса. Денервация сердца у животных приводит к увеличению частоты сокращений. Парасимпатическая регуляция является основой регуляции сердца в состоянии покоя, симпатическая – при нагрузках.

Рис. 2. Иннервация сердца
Экстракардиальная рефлекторная регуляция сердца. Экстракардиальные рефлексы являются вспомогательными в регуляции сердца. Они обеспечивают регуляцию сердца в соответствии с запросами сердечно-сосудистой системы и организма в целом.
Делятся на собственные и сопряженные.
- Рефлексы при раздражении отделов сердца.
- Рефлекторные реакции при раздражении барорецепторов дуги аорты и каротидного синуса.
- Рефлекторные реакции при раздражении хеморецепторов аортальной и каротидной зон.
Мышечная работа приводит к увеличению частоты сокращений сердца. В этих реакциях участвуют пропреорецепторы, хеморецепторы. Важным фактором увеличения работы сердца является иррадиация возбуждения от моторных зон коры головного мозга на высшие вегетативные центры.
Гуморальная регуляция работы сердца.
Гуморальная регуляция дополняет рефлекторную. Она является менее значимой, чем миогенная саморегуляция и рефлекторные механизмы. Гипоксемия, гиперкапния и ацидоз угнетают работу сердца (подразумевается непосредственная реакция кардиомиоцитов, протекающая независимо от рефлекторных механизмов).
Небольшое увеличение концентрации калия вызывает деполяризацию и увеличение возбудимости. Значительный избыток катионов калия (может поступать в кровеносное русло при массивном разрушении тканей) вызывает стойкую деполяризацию кардиомиоцитов, последующее увеличение проницаемости клеточной мембраны для калия и усиление его реполяризующего тока. В результате возбудимость и проводимость падают.
Сердце может остановиться в фазе диастолы. Дефицит калия во внеклеточной жидкости приводит к вымыванию его из внутриклеточной среды, снижению силы и частоты сокращения сердца, вплоть до его остановки. Избыток кальция во внеклеточной жидкости вызывает увеличение силы сокращения. Передозировка приводит к остановке сердца в фазе систолы.
Гормоны. Изменяют работу сердца посредством изменения транспорта ионов ( адреналин, норадреналин ) или изменения метаболизма миокарда. Катехоламины увеличивают силу и частоту сокращений сердца. Для адреналина типичен и центральный эффект – увеличение тонуса ядер вагуса с последующим снижением частоты сокращений сердца.
Глюкокортикоиды – усиливают работу сердца за счет активации ферментных систем кардиомиоцитов и усиления эффекта адреналина и норадреналина.
Тироксин – увеличивает чувствительность адренорецепторов и частоту сокращений сердца.
Глюкагон, ангиотензин и серотонин – увеличивают силу сокращений.
Вегетативная дисфункция сердца является частью симптомокомплекса, называемого соматоформной дисфункцией вегетативной нервной системы. Так как ВНС обеспечивает стабильность работы практически всех внутренних органов, то и симптомы расстройства ее чрезвычайно разнообразны.
Симптомы вегетативной дисфункции сердца
Симптоматику вегетативной дисфункции выявить достаточно просто, однако для окончательного установления диагноза врачу нужно точно ответить на следующие вопросы: являются ли данные симптомы признаком самостоятельной болезни или же проявлением другого, соматического, неврологического, психического заболевания? Могут ли они означать наличие патологии ССС (сердечно-сосудистой системы): гипертония, ИБС, клапанные пороки, воспаление миокарда?
При установке диагноза вегетативной дисфункции учитывают:
- множественность и разнообразие жалоб, преимущественно касающихся ССС;
- продолжительное течение с эпизодами обострений и затуханием симптоматики;
- не приводит к осложнениям (сердечная недостаточность);
- несовпадение между жалобами и объективными данными, результатами обследования.
Выделяют основные и дополнительные диагностические признаки вегетативной дисфункции. Достоверным можно считать диагноз при наличии двух и больше основных и 2-х дополнительных признаков.
Основные признаки:
- боли в прекардиальной области различного характера (давящие, колющие, пекущие, режущие, сверлящие, ноющие);
- дыхательные расстройства — одышка, чувство нехватки воздуха, неудовлетворенность вдохом, не связанные с физическими нагрузками;
- нестабильность АД и пульса, неадекватное изменение их в ответ на физнагрузку, приступы учащенного сердцебиения;
- неспецифические видоизменения сегмента ST, зубца T на электрокардиограмме, синдром ранней реполяризации желудочков;
- восстановление отрицательного зубца Т на электрокардиограмме после физической нагрузки, положительные ортостатическая и гипервентиляционные пробы с бетаадреноблокаторами.
Дополнительные признаки:
- тахи- или брадикардия, перебои в работе сердца;
- лабильность температуры тела, субфебрилитет, приливы жара, ознобы, боли в мышцах, парестезии;
- головокружения, пресинкопальные и синкопальные состояния (обмороки);
- эмоциональная неустойчивость, чувство тревоги, страха, повышенная раздражительность, плаксивость;
- общая слабость, утомляемость, понижение работоспособности; отсутствие признаков органической патологии со стороны сердечно-сосудистой системы, нервной системы, психических расстройств.
Также есть признаки, наличие которых со стопроцентной вероятностью исключает диагноз вегетативной дисфункции. Выявляются они при осмотре и дополнительном обследовании. Это отеки ног, влажные хрипы в легких, аускультативные шумы в диастолу, увеличение сердца (гипертрофия, дилатация), изменения на ЭКГ (блокада левой ножки п.Гиса, АВ-блокада II-III степени, очаговые изменения, смещение сегмента ST, нарушения ритма кроме единичной экстрасистолии), изменения в анализах крови.
Причины ВСД
В основе заболевания — нарушение нейрогуморальной регуляции вегетативной нервной системы, отвечающей за стабильность и слаженность деятельности всех внутренних органов и организма в целом. Это отдел нервной системы, не подчиняющийся сознанию и управлению волей человека.
Причин заболевания много. Среди первых выступают гормональные нарушения, в том числе преходящие — в период полового созревания, менопаузы, беременности. Существенную роль играют инфекционные болезни (в том числе и физическая детренированность после инфекции), очаги хронической инфекции (кариес, синусит, тонзиллит), аллергия. Предрасполагают к расстройству психоэмоциональное перенапряжение ,черепно-мозговые травмы, малоподвижный образ жизни, вредные привычки - курение, алкоголь, неправильное питание. Важное значение имеет наследственная предрасположенность.
Диагностика и лечение вегетативной дисфункции сердца
Вегетативная дисфункция является диагнозом исключения. После того как будет исключен ряд сердечно-сосудистых заболеваний благодаря лабораторным, инструментальным методам (ЭКГ, ЭхоКГ, Холтер-ЭКГ и др.) следует проводить дифдиагностику с нервно-психическими заболеваниями и только в последнюю очередь думать о вегетатике.
Лечение же непосредственно расстройства вегетативной нервной системы следует начинать с оздоровления образа жизни: регулярные физические нагрузки, спорт (приоритетно плавание), исключение вредных привычек, полноценный ночной сон, оптимальное питание, нормализация массы тела, закаливание.
Из медикаментов используются адаптогены, дневные транквилизаторы, ноотропы, сосудистые препараты, антиоксиданты, витамины.
К кому обратиться?
В случае преобладания кардиальной симптоматики для правильной диагностики и при необходимости лечения нужна консультация врача-кардиолога. Лечение вегетативных расстройств является компетенцией неврологов и психиатров.
Рефлекторные влияния на сердце. Выделены три категории кардиальных рефлексов: собственные, вызываемые раздражением рецепторов сердечно-сосудистой системы; сопряженные, обусловленные активностью любых других рефлексогенных зон; неспецифические, которые воспроизводятся в ответ на неспецифические влияния (в условиях физиологического эксперимента, а также в патологии).
Наибольшее физиологическое значение имеют собственные рефлексы сердечно-сосудистой системы, которые возникают чаще всего при раздражении барорецепторов магистральных артерий в результате изменения системного давления. Так, при повышении давления в аорте и каротидном синусе происходит рефлекторное урежение частоты сердцебиения.
Особую группу собственных кардиальных рефлексов представляют те из них, которые возникают в ответ на раздражение артериальных хемо-рецепторов изменением напряжения кислорода в крови. В условиях гипоксемии развивается рефлекторная тахикардия, а при дыхании чистым кислородом — брадикардия. Эти реакции отличаются исключительно высокой чувствительностью: у человека увеличение частоты сердцебиений наблюдается уже при снижении напряжения кислорода всего на 3 %, когда никаких признаков гипоксии в организме обнаружить еще невозможно.
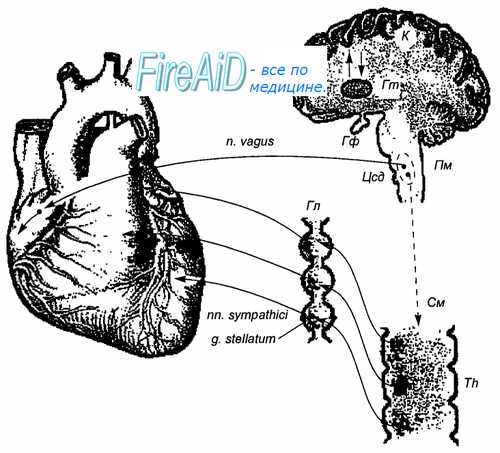
Рис. 9.18. Эфферентная иннервация сердца. Гф — гипофиз; Гт — гипоталамус; Пм — продолговатый мозг; Цсд — бульбарный центр сердечно-сосудистой системы; К — кора больших полушарий; Гл — симпатические ганглии; См — спинной мозг; Th — грудные сегменты.
Собственные рефлексы сердца проявляются и в ответ на механическое раздражение сердечных камер, в стенках которых находится большое количество барорецепторов. К их числу относят рефлекс Бейнбриджа, проявляющийся в виде тахикардии в ответ на быстрое внутривенное введение определенного объема крови. Считается, что эта реакция сердца является рефлекторным ответом на раздражение барорецепторов полых вен и предсердия, поскольку она устраняется при денервации сердца. Отрицательные хронотропные и инотропные реакции сердца рефлекторной природы возникают в ответ на раздражение механорецепторов как правых, так и левых отделов сердца. Значение интракардиальных рефлексов состоит в том, что увеличение исходной длины волокон миокарда приводит к усилению сокращений не только растягиваемого отдела сердца (в соответствии с законом Франка—Старлинга), но и к усилению сокращений других отделов сердца, не подвергающихся растяжению.
Рефлексы с сердца изменяют функцию других висцеральных систем. К их числу относят, например, кардиоренальный рефлекс Генри—Гауэра, который представляет собой увеличение диуреза в ответ на растяжение стенки левого предсердия.
Собственные кардиальные рефлексы составляют основу нейрогенной регуляции деятельности сердца, хотя реализация его насосной функции возможна без участия нервной системы.
Сопряженные кардиальные рефлексы представляют собой эффекты раздражения рефлексогенных зон, не принимающих прямого участия в регуляции кровообращения. К числу таких рефлексов относят рефлекс Гольца, который проявляется в форме брадикардии (до полной остановки сердца) в ответ на раздражение механорецепторов брюшины или органов брюшной полости. Возможность проявления такой реакции учитывается при проведении оперативных вмешательств на брюшной полости, при нокауте у боксеров и т. д. При раздражении некоторых экстерорецепторов (резкое охлаждение кожи области живота) может иметь место рефлекторная остановка сердца. Именно такую природу имеют несчастные случаи при нырянии в холодную воду. Сопряженным соматовисцеральным кардиальным рефлексом является рефлекс Данини—Ашнера, который проявляется в виде брадикардии при надавливании на глазные яблоки. Таким образом, сопряженные рефлексы сердца, не являясь составной частью общей схемы нейрогенной регуляции, могут оказывать влияние на его деятельность.
Замыкание большинства кардиорефлекторных дуг происходит на уровне продолговатого мозга, где находятся: 1) ядро солитарного тракта, к которому подходят афферентные пути рефлексогенных зон сердечно-сосудистой системы; 2) ядра блуждающего нерва и 3) вставочные нейроны бульбарно-го кардиоваскулярного центра. В то же время реализация рефлекторных влияний на сердце в естественных условиях всегда происходит при участии вышележащих отделов центральной нервной системы (рис. 9.18). Существуют различные по знаку инотропные и хронотропные влияния на сердце со стороны мезэнцефальных адренергических ядер (голубое пятно, черная субстанция), гипоталамуса (паравентрикулярное и супраоптические ядра, мамиллярные тела) и лимбической системы. Имеют место и кортикальные влияния на сердечную деятельность, среди которых особое значение придают условным рефлексам — таким, например, как положительный хроно-тропный эффект при предстартовом состоянии. Достоверных данных о возможности произвольного управления человеком сердечной деятельностью не получено.
Читайте также:

