Какие признаки положены в основу классификации кислот
Обновлено: 04.07.2024
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:

Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать её в классах и школах с углублённым изучением естественно-научных предметов.
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
| t | ||
| 2HCl | → | Cl2 + H2. |
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.

Знания по классификации и свойствам кислот имеют большое значение при подготовке к ОГЭ и ЕГЭ. Табличный материал позволяет быстро и эффективно запомнить все необходимые характеристики для этого класса веществ неорганической химии.
г. Миасса Челябинской области

Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток.
Кислоты – это электролиты, состоящие из катионов водорода и анионов кислотного остатка.
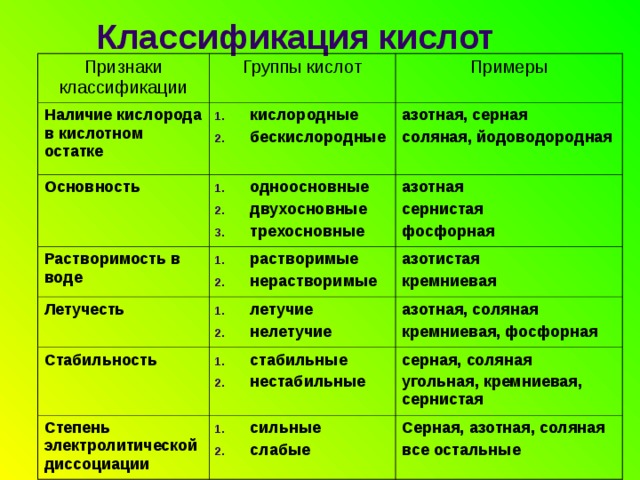
Наличие кислорода в кислотном остатке
Растворимость в воде
азотная, серная
соляная, йодоводородная
Стабильность
азотная, соляная
кремниевая, фосфорная
Степень электролитической диссоциации
серная, соляная
угольная, кремниевая, сернистая
Серная, азотная, соляная
все остальные

Классификация кислот по составу.
Кислородсодержащие кислоты
Бескислородные кислоты
H 2 SO 4 серная кислота
H 2 SO 3 сернистая кислота
HNO 3 азотная кислота
H 3 PO 4 фосфорная кислота
H 2 CO 3 угольная кислота
H 2 SiO 3 кремниевая кислота
HF фтороводородная кислота
HCl хлороводородная кислота (соляная кислота)
HBr бромоводородная кислота
HI йодоводородная кислота
H 2 S сероводородная кислота

Классификация кислот по основности
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на
одноосновные - (с одним атомом водорода),
двухосновные - (с 2 атомами водорода)
и трехосновные - (с 3 атомами водорода).

К И С Л О Т Ы
HNO 3 азотная
H 2 SO 4 серная
H 2 SO 3 сернистая
H 2 S сероводородная
H 2 CO 3 угольная
H 2 SiO 3 кремниевая
H 3 PO 4 фосфорная

** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
"двухосновная и трехосновная"
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания":
Задание: Дайте характеристику кислоте, используя различные признаки классификации кислот
Типичные химические реакции кислот
1. Действие растворов кислот на индикаторы
Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов . По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.

2. Взаимодействие кислот с основаниями
Эта реакция называется реакцией нейтрализации . Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода.
Читайте также:
- Современная образовательная среда как фактор обеспечения качества образовательного процесса
- В каких странах платят за рождение детей
- Позитивистская теория права когда появилась
- Является ли рапорт доказательством по уголовному делу
- Эффект группового фаворитизма формируется как противовес эффекту прокурора

