Как сделать паспорт водорода
Обновлено: 04.07.2024
По данным Центра по контролю и профилактике заболеваний перекись водорода убивает грибки, бактерии, вирусы и споры плесени. Оно является стабильным и эффективным антисептическим средством против вирусов при применении на твердых, непористых поверхностях. Перекись водорода (H2O2) — это мощное дезинфицирующее средство, которое убивает бактерии, такие как стафилококки
, и
вирусы
, включая
H1N1
,
SARS
и
коронавирусы
.
Это связано с тем, что перекись водорода в полностью концентрированной форме является слишком сильным средством для домашнего применения и фактически используется в качестве ракетного топлива и отбеливающего и коррозионного агента на производстве.
Перекись водорода (H2O2) является высоко реактивным веществом и действует на микробы путем окисления. Этот процесс происходит, когда реактивные атомы кислорода взаимодействуют с электронами других клеток, что приводит к разрушению стенок клеток, образующих бактерии.
Состав, свойства, описание
Пероксид водорода – неустойчивый кристаллогидрат H2O2+2H2O, бесцветная жидкость. В неограниченном количестве растворяется в воде, эфире, спирте. В концентрированном виде взрывоопасен, образует ожоги. Будучи сильным окислителем, может вызывать коррозию металлов.
Широкая сфера применения (медицина, дезинфекция, техника, промышленность) объясняется тем, что это соединение является окислителем, восстановителем, катализатором. Примеры: в реакции с нитритами выступает как окислитель (превращает в нитраты), для очистки серебра используются восстановительные свойства (восстанавливает Ag2O до чистого Ag с выделением кислорода и воды).
Используется как катализатор различных химических процессов, гидрирующий агент.
Как антимикробное средство H2O2 уничтожает возбудителей туберкулеза, холеры, чумы, сибирской язвы, других грамположительных и грамотрицательных бактерий, вирусов.
Применение перекиси водорода для дезинфекции
Когда дело касается универсальных нетоксичных чистящих средств, мало что может сравниться с 3% раствором перекиси водорода. Ее можно использовать для дезинфекции различных поверхностей.
Кухонная раковина
Намочите поверхность раковины. Затем очистите раковину пищевой содой с помощью губки. После того, как вы протерли всю поверхность, нанесите на нее 3% раствор перекиси водорода и оставьте на 5 минут, а потом промойте поверхность.
Столешница и разделочные доски
По мнению специалистов протирание столешницы или разделочных досок 3% раствором перекиси водорода помогает убить кишечную палочку и сальмонеллу на твердой поверхности, если оставить ее на 10 минут при комнатной температуре.
Мусорное ведро
Промыв мусорное ведро мылом с водой, распылите в контейнере раствор из перекиси водорода и воды в соотношении 1:1. Оставьте ведро высыхать на Солнце в течение нескольких часов. Перекись водорода помогает не только очистить поверхность, но и убивает микробы в мусорном ведре.
Холодильник и посудомоечная машинка
Благодаря тому, что перекись водорода является нетоксичным средством, ее можно использовать для очистки мест, где хранятся продукты и посуда. Распылите ее с внешней и внутренней стороны холодильника и посудомоечной машины, оставьте раствор на несколько минут и затем протрите чистой тряпочкой.
Губки для мытья посуды
Замочите губки для мытья посуды на 10 минут в смеси из раствора перекиси водорода и воды в соотношении 1:1 в пустой миске. Затем тщательно промойте губки.
Туалет
Перекись водорода эффективна в борьбе с микроорганизмами, включая бактерии, грибки, вирусы и плесень, благодаря чему она может стать прекрасным средством для очищения туалета. Для очищения туалета добавьте 1/2 чашки 3% раствора перекиси водорода в чашу унитаза, чтобы убить микробы и придать блеск поверхности унитаза. Оставьте раствор на 20 минут для большей эффективности.
Зеркала и стеклянные поверхности
Распылите раствор из перекиси водорода и воды в соотношении 1:1 на стеклянную поверхность, а затем протрите ее бумажными полотенцами, тряпочкой без ворса или газетой, чтобы избежать разводов.
Душевая кабинка
Плесень легко образуется во влажной среде душевой кабинки. Чтобы ее убить, не вдыхая токсичные пары отбеливателя, распылите неразбавленный 3% раствор перекиси водорода и оставьте на 30 минут. Ополосните поверхность.
Ручки дверей
Протрите или распылите 3% раствор перекиси водорода на ручки дверей и оставьте на 5 минут. Затем вытрите поверхность.
Для очищения и дезинфекции полов, вам нужно сделать следующее: Смешайте в равных частях воду и перекись водорода в ведре. Протрите полы как обычно и дайте им высохнуть. Стоит помнить об отбеливающих свойствах перекиси водорода, поэтому лучше предварительно проверить ее действие на цветных и деревянных полах, прежде чем применять.
ВОДОРОДА ПЕРОКСИДА ВОДНЫЙ РАСТВОР № ООН 2014 (UN2014)
Главная > О предприятии > Техническая информация > Справочник химических веществ
ВОДОРОДА ПЕРОКСИДА ВОДНЫЙ РАСТВОР № ООН 2014 (UN2014) — класс опасности, перевозки автоцистернами
Идентификация химической продукции
Идентификация опасности (опасностей)
Информация при перевозках (транспортировании)
Правила хранения химической продукции и обращения с ней при погрузочно-разгрузочных работах
Рекомендации по удалению отходов (остатков)
Возврат к списку
Меры предосторожности
Перекись водорода обладает множеством полезных чистящих и дезинфицирующих свойств сама по себе. Однако нужно быть осторожным при смешивании ее с другими веществами. Так, например, нельзя смешивать в одной емкости перекись водорода с отбеливателем, а также перекись водорода с белым уксусом из-за того, что такие смеси могут вызвать нежелательные последствия. Однако вы можете сначала протереть поверхность перекисью водорода, а затем уксусом (не смешивая!), в качестве мощного средства для борьбы с бактериями и вирусами на твердых поверхностях.

Учи.Дома запускает бесплатный марафон в котором каждый день. В течении 5 дней утром ты будешь получать одно задание по выбранному предмету, а вечером его решение. Твоя задача, успеть выполнение задание до того как получишь ответ.
Бесплатно, онлайн, подготовка к ЕГЭ
Предварительный просмотр:
Методическая разработка урока по химии в 8 классе, с использованием элементов личностно ориентированного обучения.
Номинация - естественнонаучные дисциплины.
Направление - реализация принципов личностно ориентированного обучения на уроках биологии, химии, информатики.
Соловьева Зоя Юрьевна.
Идея: Создать условия для включения учащихся в процесс познания темы.
1. Расширить знания учащихся о химических элементах на примере водорода.
2. Продолжить формирование общеобразовательных и специальных учебных умений и навыков учащихся, а также устойчивого познавательного интереса школьников к изучаемому предмету.
3. Воспитывать коллективизм, адекватную самооценку у учащихся на уроке.
2. Учить находить взаимосвязи между нахождением химического элемента в
периодической системе и его характеристиками.
3. Совершенствовать умения учащихся в распознавании физических свойств
4. Отработать методику составления уравнений химических реакций.
5. Развивать умения анализировать, наблюдать, формулировать задачи и выводы,
работать с опорными конспектами, устанавливая причинно-следственные связи.
Тип урока - введение нового материала.
Форма проведения урока - урок – сказание с элементами СДП и использованием
Принципы, реализуемые на уроке:
- принцип целостного представления мира;
- принцип воспитывающего обучения;
- принцип психологической комфортности;
- принцип деятельности;
- принцип минимакса.
- метод экспрессии (реализуется через побуждающий и подводящий диалог, эвристический опрос, объяснение с элементами беседы);
- демонстрационный и лабораторный эксперимент;
- методы стимулирования и мотивации учения;
- метод рефлексивного анализа;
- тестирование.
Виды деятельности учащихся:
1. Организационный момент.
Цель - обеспечить мобилизационное начало урока, познакомиться с детьми, настроить учащихся на работу.
2. Введение (вводное слово учителя). Определение темы урока.
Цель - создать атмосферу заинтересованности каждого ученика, помочь учащимся самим сформулировать тему урока.
3. Мотивация к целеполаганию. Знакомство с планом урока.
Цель - стимулировать учащихся к высказываниям, без боязни ошибиться; познакомить с целью и планом урока.
4. Изучение нового материала по плану:
- Водород – химический элемент.
- Положение водорода в периодической системе.
- Характеристики водорода.
- Нахождение водорода в природе.
2. Водород – простое вещество:
- Физические свойства водорода.
- Способы получения водорода.
Цель - создать условия для познавательной активности учеников посредством различных форм, средств и методов, обеспечить усвоение материала темы.
5. Закрепление нового материала:
- работа по вопросам;
Цель - выявить пробелы в знаниях, сделать выводы насколько хорошо учащиеся ориентируются в полученной информации; провести рефлексивный анализ совместной деятельности на уроке.
6. Заключительная часть. Домашнее задание. Оценивание.
Цель - подвести итоги занятия, оценить деятельность учащихся и пояснить домашнее задание.
1. Организационный момент.
Меня зовут Зоя Юрьевна! Сегодня у нас не совсем обычный урок. Необычный он и для вас и для меня. Необычен он тем, что мы видим друг друга впервые.
Но я очень рада видеть вас, видеть ваши глаза, находить в них поддержку и понимание и наша совместная работа доставит нам удовольствие.
?? А как вы думаете, случайно ли я не написала тему нашего урока на доске?
Нет, конечно же, не случайно. Да, я предлагаю вам попытаться самим определить тему нашего урока, а я вам помогу. Дело в том, что
И если мы сможем расшифровать эту надпись, то узнаем тему урока.
Учащиеся разгадывают ребус и называют тему урока.
3. Мотивация к целеполаганию.
Сегодня мы с вами попытаемся раскрыть многие секреты, связанные с темой урока и перелистаем страницы книги старинного сказания об одном веществе.
Но в начале давайте прочтем оглавление данной книги и, таким образом, определим порядок изучения новой темы на уроке. А исходя из плана урока, я думаю, вы легко назовете и задачи нашего урока. ( Учащиеся зачитывают оглавление книги и формулируют задачи урока ). (Смотри Приложение 2).
Таким образом, основные задачи урока : познакомиться с новым химическим элементом – водородом, узнать какое простое вещество он образует, как его можно получить и какими свойствами он обладает. А для этого вы должны быть внимательными, активными и наблюдательными.
4. Изучение нового материала.
Ребята! Дело в том, что дальше запись отсутствует. Помогите мне восстановить записи в старой книге. Давайте же определим положение химического элемента водорода в периодической системе.
?? Ребята, а кто может показать водород в таблице над доской?
Учащиеся отвечают на вопросы. Один ученик показывает местонахождение водорода в ПТ., остальные находят водород в таблице на форзаце учебника.
?? Как вы думаете, какой? Учащиеся фронтально работают с учителем, отвечают на вопросы.
?? А какую информацию обычно можно найти в паспорте?
- дата и место рождения; т.е. индивидуальные сведения о человеке
?? Как вы думаете, какая информация была в паспорте у водорода? ( выслушиваем предположения учащихся)
Следующий этап нашей работы, определить, где водород встречается в природе.
Для этого я предлагаю ребятам, которые сидят на 2 и 3-ем рядах внимательно изучить нижнюю часть ОК (опорного конспекта, смотри Приложение 4) и составить рассказ по схеме, а ребятам на 1-ом ряду прочесть в учебнике п.6.1. и затем выступить в роли консультантов-цензоров.
( После заслушивания рассказов, учащиеся с 1-го ряда анализируют рассказы и делают обобщение о нахождении водорода в природе ).
Ребята, давайте заглянем в паспорт водорода и познакомимся с физическими свойствами водорода.
?? Как вы думаете, что обозначают загадочные буквы в паспорте у водорода?
- Верно, водород – это Г - газ, без Ц - цвета, без В - вкуса, без З - запаха.
Учащиеся изучают информацию в паспорте, задают вопросы, переводят информацию из знаковой системы в текстовую.
?? Ребята, а как можно доказать, что водород действительно легче воздуха, если известно, что Мч (воздуха) = 29?
- Давайте найдем Мч (Н 2 ), Мч(Н 2 )=2Ач(Н)=2*1=2; 2 меньше 29, следовательно, водород действительно, легче воздуха.
Один учащийся у доски решает задачу, остальные работают в тетради.
Но перед путешествием давайте отдохнем.
Психологическая пауза. Проводится под музыку, имитирующую звуки в лаборатории - кипение, бурление и т. д.
Учащиеся слушают музыку и рассказ учителя, фантазируют, анализируют полученную информацию.
Ребята, горючим воздухом в то время называли водород, а способ получения, который описывал Г. Кавендиш, является актуальным и в наше время.
Действительно, водород и поныне получают в лаборатории взаимодействием цинка с соляной кислотой. Обычно для этого используют специальный аппарат-аппарат Киппа. В среднюю его часть помещают гранулы цинка, а сверху наливают раствор соляной кислоты, и в результате реакции через газоотводную трубку выделяется газ – водород.
В школьной лаборатории для получения водорода используют другой прибор.
В пробирку помещают несколько гранул цинка и добавляют 1-2 мл. соляной кислоты. Пробирку плотно вращательными движениями закрывают пробкой с газоотводной трубкой. Конец газоотводной трубки опускают в пробирку – приемник.
?? Как необходимо расположить пробирку, в которой будем собирать водород? Почему?
?? Какие способы собирания газов вам известны?
Будем считать, что нам удалось собрать водород. Закрываем пробирку с водородом пробкой.
Учащиеся наблюдают за ходом эксперимента, отвечают на вопросы учителя.
?? А как же доказать, что газ в пробирке – водород? Ребята, найдите ответ на этот вопрос в учебнике п. 6.4.
Дети работают с учебником. Отвечают на вопрос. Один учащийся проводит опыт по доказательству водорода.
Итак, давайте же теперь подведем итоги и рассмотрим особенности химического процесса, наблюдаемого только что.
?? Какие два вещества мы использовали для получения водорода?
Запишите в паспорт реакцию получения водорода и расставьте коэффициенты, внизу под веществами подпишите их названия (хлорид цинка и водород).
На данном этапе вводится понятие реакции замещения и объясняется ее принцип, через организацию работы с учебником и разрезным материалом.
?? Ребята, с каким типом химических реакций мы сегодня познакомились? (реакция замещения)
?? Какие виды реакций вы уже знаете? Дополните схему, используя разрезной материал, и сделайте вывод.
Учащиеся работают с учебником, с разрезной схемой. Делают вывод.
Тема: Изучение физических свойств водорода.
Ребята, помните, мы с вами теоретически доказывали, что водород легче воздуха? Ну а теперь, коль мы с вами находимся в химической лаборатории, давайте практически в этом убедимся. Для этого мы в начале получим водород, а затем попытаемся наполнить им мыльные пузыри.
В детстве мы наполняли пузыри выдыхаемым воздухом, то есть углекислым газом СО 2 , и пузыри стремились вниз, т. к. углекислый газ почти в 2 раза тяжелее воздуха.
?? Как вы думаете, что будет происходить с мыльными пузырями, наполненными газом, который легче воздуха?
Учащиеся предполагают. Отвечают, объясняют.
Давайте проверим. У вас в пробирках раствор соляной кислоты, всыпьте в нее железные опилки и закройте пробкой с газоотводной трубкой. Конец трубки вставьте в отверстие палочки для коктейля, заранее обмакнув ее в мыльную воду. Что наблюдаете? Напишите уравнение реакции, объясняя друг другу происходящие явления.
Учащиеся выполняют лабораторную работу. Обсуждают результаты в паре.
Вместе с учителем подводят итог.
Мы доказали самое важное свойство водорода. Это свойство находит применение при наполнении водородом летательных шаров метеорологических аппаратов, на которых устанавливают специальные датчики для определения температуры, давления, скорости ветра и других данных на определенной высоте – 300, 500м. и т. д. (рисунок 6.2.,с.105).
5. Закрепление нового материала. Рефлексия.
Но наш урок на этом не заканчивается, и я предлагаю вам ответить на некоторые вопросы, а заодно и подготовиться к выполнению тестового задания.
1. Как Вы чувствовали себя на уроке?
2. Какие трудности Вы испытывали?
2. Чему научились на уроке?
3. Сделали ли вы для себя выводы, где эти знания пригодятся в жизни, в дальнейшей учебе?
Выводы по уроку:
1. Водород существует в трех формах:
- входит в состав сложных веществ.
2. Водород в природе – космос, вода, вулканический дым и т. д.
3. Физические свойства – газ без цвета, без запаха, без вкуса, легче воздуха.
4. В лаборатории водород получают реакцией замещения.
Ребята, давайте теперь посмотрим, как же полученные знания помогут нам на практике. А в частности, я предлагаю вам тестовые задания, в которых вы карандашом отметите верный ответ. Но вначале подумайте, на какую оценку вы знаете эту тему, т.е. спрогнозируйте свою оценку и в уголочке отметьте оценку.
Ребята оцените себя по 5-ти бальной шкале. Посмотрите, совпали ли ваши оценки с прогнозируемыми? Подумайте, возможно вы себя недооценили, а может быть, наоборот. Как вы думаете, почему?
6. Заключительная часть.
?? Ребята, а как вы думаете, каким будет домашнее задание?
1. Выучить информацию в паспортах.
3*. Интерпретируйте информацию, полученную сегодня на уроке, в виде рассказа для детей 1 класса, новостей для телевидения, краткого научного доклада. Можно использовать доп. литературу.
3* - задание не обязательно для всех учащихся
Принципы, методы, виды деятельности учащихся, указанные в разработке легко реализуются на уроке посредством выбранных средств и форм обучения.
В ходе урока у учащихся формируются следующие УУД:
- проводить наблюдение и эксперимент под руководством учителя
- устанавливать причинно-следственные связи;
- строить логическое рассуждение, включающее установление причинно-следственных связей;
- объяснять явления, процессы, связи и отношения, выявляемые в ходе исследования;
- учатся основам ознакомительного, изучающего, усваивающего и поискового чтения;
- делать умозаключения (индуктивное и по аналогии) и выводы на основе аргументации .
- учатся целеполаганию, включая постановку новых целей, преобразование практической задачи в познавательную;
- самостоятельно анализировать условия достижения цели
- формулировать собственное мнение и позицию, аргументировать и координировать её с позициями партнёров в сотрудничестве при выработке общего решения в совместной деятельности;
- аргументировать свою точку зрения, спорить и отстаивать свою позицию не враждебным для оппонентов образом;
- задавать вопросы, необходимые для организации собственной деятельности и сотрудничества с партнёром;
- осуществлять взаимный контроль и оказывать в сотрудничестве необходимую взаимопомощь;
- адекватно использовать речевые средства для решения различных коммуникативных задач; владеть устной и письменной речью;
- строить монологическое контекстное высказывание;
- работать в группе — устанавливать рабочие отношения,
- отображать в речи (описание, объяснение) содержание совершаемых действий как в форме громкой социализированной речи, так и в форме внутренней речи.
По теме: методические разработки, презентации и конспекты
электронный урок по теме "Водород"
Урок разработан на основе умк Н.С. Новошинской по технологии развития критического мышления.Поэволяет развивать коммуникативную и социальную компетенции обучающихся.Построен на основе межпредметных св.
Разработка урока по теме "Водород" 8 класс
Историческая справка о водороде и его свойства. .
Урок по теме "Водород"
Урок для учащихся 9 класса по теме "Водород" к учебнику О.С, Габриеляна.
Урок на тему "Водород"
Урок получения новых знаний представлен в кейс-технологии для учащихся 9 класса.
Урок по теме "ВОДОРОД"
Урок изучения нового материала с использованием лабораторного опыта, элементов беседы. Урок разработан по линии учебников Г. Е. Рудзитис и Ф. Е. Фельдман.
урок по теме "Водород"
Урок нового материала по теме "Водород" в 8 классе. Материал подобран таким образом, что учащиеся узнали не только строение и свойства самого лёгкого газа, но и много дополнительной .
урок по теме "Водород"
Данный материал используется при изучении темы "Водород" с использованием компьютерной презентации.
Роман Урсу. В этом видео хотел показать, как можно из 10 лезвий для бритья сделать небольшой генератор, который будет извлекать из воды водород. Для начала понадобится блок питания от 5 до 12 вольт, силы тока от 0,5 до 2 ампер. Медные провода, стеклянная баночка с герметичной винтовой крышкой. Пластиковая бутылка, кусок пластмассовой линейки. Две капельницы. 10 лезвий. Пищевая соль.
Инструменты: паяльник, клеевый пистолет, канцелярский нож.

Приступим к работе. Залудим края лезвий. Далее всё устанавливаем на линейку. Обратите внимание, расстояние между лезвиями минимально, они не должны соприкасаться. Слишком большое пространство между ними оставлять не надо, иначе потребуется мощный блок питания.
Берем проводки и припаиваем через одно лезвие. Схема подключения идентична с аккумуляторными пластинами.
Действительно ли установка может вырабатывать водород?
Генератор водорода готов. Теперь заправим его и протестируем. В качестве топлива используется соляной раствор. Несколько ложек соли и вода из-под крана. Иногда используют разбавители, растворители, пищевую соду. От раствора зависит от температуры пламени. В пластиковую бутылку наливаем воду без примесей. Обратите внимание, чтобы крышечки и соединения не пропускали газа. Настал ответственный момент. Подключить провода к блоку питания и проверить, как добывается водород.

Металлическую крышку заменил на другую, предыдущая была не герметична. Мастер советует использовать банки с крышками поплотнее. Вместо клеевого пистолета использовать холодную сварку, так как силикон со временем смягчается. В целом всё отлично работает.
Как сделать генератор водорода? Конвертер воды в топливо? С помощью электрического воздействия с использованием простой воды можно получить газ и собирать в специальный контейнер и использовать этот газ (водород) для питания двигателей или других приборов. Мы сделаем генератор водорода! Я предлагаю сделать дома! Наблюдая за видеоуроком нам просто нужно найти способ использовать газ, который мы получили от водорода!
Радж Айер
Год назад
1. Вы генерируете смесь H2 + 02 в соотношении 2: 1. 2. Для чистого газообразного водорода вы должны использовать бутылку с раствором каустической соды, в которую добавляются алюминиевые кусочки. Такая компоновка будет работать, обеспечивая хорошие объемы газа при низком давлении. Однако будьте осторожны, чтобы избежать пламени. Однажды у меня был взрыв, когда я экспериментировал в детстве. Вспышка бутылки и коррозионная щелочь были разбросаны по всему дому. Алюминий превращается в высоковязкую желатиновую соль, называемую натриево-мета-алюминатом. 3. Я хочу, чтобы вы придумали конструкцию, которая разделяет катод и анод, используя некоторую мембрану, которая может выдерживать температуры 100 градусов +, потому что при более высоких токах вода нагревается. 4. Вы не должны наносить много соли в воду. Щепотка соли в 1 литре более чем достаточна для проведения. Если вы используете больше соли, вы фактически генерируете водород вместе с хлором на аноде. Вода будет щелкать, так как ионы натрия будут реагировать с водой с образованием NaOH. Хлор будет генерировать на аноде и разъедать электрод. Поэтому вам нужно использовать углеродные электроды.
Дуайт Уилбанкс
Год назад
Несколько мыслей. Мысль 1, если лезвия были вертикальными, пузыри будут течь на вершину быстрее. Отделившись от ваших тарелок, ваши тарелки снова контактируют с вашим электролитом и могут начать делать следующий пузырь. Вторая мысль касается эффективности напряжения. Идеальное напряжение составляет от 2 до 2,5 вольт, так как вы опускаетесь ниже этого напряжения, производство падает. Когда вы поднимаете выше идеала, вы все равно получаете больше пузырьков, но, кроме того, выделяется больше тепла. Чем дальше от идеала, тем меньше эффективность. Если у вас 5-вольтовый источник, вы должны использовать нейтральную пластинку (много объяснений Google). Итак, пластина 1 положительна, пластина 2 не прикреплена ни к чему, пластина 3 отрицательна, затем повторите. Общая разница в 5 вольт разделяется на два отдельных сегмента в 2,5 вольта. Очевидно, что ваша цель состоит не в том, чтобы сделать самый эффективный инструмент промышленного класса, но с очень небольшими изменениями в вашем дизайне вы можете повысить эффективность. Поскольку соединений меньше, его фактически немного меньше работает как побочный эффект.
piranha031091
2 года назад
Вам НИКОГДА не следует делать это с помощью стеклянного контейнера: в этом контейнере вы получите взрывоопасную смесь водорода и кислорода, поэтому у вас есть очень важная вероятность возникновения обратного огня, который заставит контейнер взорваться. Если он сделан из стекла, взрыв вызовет стеклянную осколку, которая может быть смертельной. (мой коллега несколько месяцев назад взял стеклянную осколку в горло и чуть не умер от того, что в противном случае было очень незначительным взрывом). Пластик для этого гораздо безопаснее.
Shadi2
2 года назад
он добавил соль, поэтому вместо водорода + кислород образует водород + газообразный хлор + гидроксид натрия. Вторая стадия превращает газообразный хлор в соляную кислоту, а гидроксид натрия нагревает воду. Поэтому во введении вода выглядит такой же желтой. За исключением питьевой воды, заливки ее на глаза или выпивки минутного количества хлорного газа, который ускользает, обращение с бритвенными лезвиями является самой опасной частью.
Как превратить воду в водород: простейший опыт
Соблюдайте безопасность в опытах с воспламеняющимися веществами!


Я покажу вам, как сделать простое устройство, которое превращает / расщепляет воду на водород и кислород. Это удивительно просто и прекрасно работает. (не забудьте посмотреть видео, так как оно показывает много дополнительных деталей — в том числе пузырьки, просто вылетающие из карандашей). Видео показывает, что генератор водорода питается от солнечной батареи, батареи 9 В и трансформатора переменного / постоянного тока.
Шаг 1: Посмотрите наглядное видео …
Шаг 2: Механизм генератора водорода
Шаг 3: Необходимые предметы …
Шаг 4: Во-первых, точить карандаши …

Заточите карандаши на обоих концах. Затем сделайте 2 маленьких отверстия в куске картона (на расстоянии около 1 дюйма) и протолкните карандаши в отверстия (см. фото выше).
Шаг 5: добавь воды в стакан …

Шаг 6: Теперь подключите провода …
Теперь просто подключите провода от конца карандашей к источнику питания. Пузыри начнут формироваться немедленно. Одна интересная вещь об этом проекте — многие люди уже будут иметь все необходимое, чтобы сделать это дома. Не нужно ничего покупать (за исключением солнечной панели … но батарея 9v работает хорошо). Сделать водород и кислород дома бесплатно возможно, и все с обычными предметами домашнего обихода.
Получайте удовольствие от создания и использования! Снова посмотрите видео, чтобы увидеть, как пузыри просто стекают с карандашей. Строго соблюдайте технику безопасности!
Источник

История открытия
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом. Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему. Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы
Водород это газ, молекула его состоит из двух атомов.
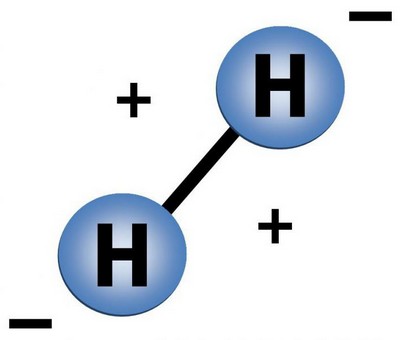
Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Практическое применение
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Развитие водородной энергетики связано с универсальностью применения этого элемента в качестве энергоносителя, неограниченностью его запасов, экологичностью технологий и увеличением показателей качества работы энергетических систем. Главной задачей сейчас является повышение экономичности добыча водорода: пока оно дороже, чем применение природного газа в энергетике.
Способы получения водорода
Водород – газообразный элемент без цвета и запаха с плотностью 1/14 по отношению к воздуху. В свободном состоянии он встречается редко. Обычно водород соединен с другими химическими элементами: кислородом, углеродом.
Получение водорода для промышленных нужд и энергетики проводится несколькими методами. Самыми популярными считаются:
- электролиз воды;
- метод концентрирования;
- низкотемпературная конденсация;
- адсорбция.


Выделить водород можно не только из газовых или водных соединений. Добыча водорода производится при воздействии на дерево и уголь высокими температурами, а также при переработке биоотходов.
Атомный водород для энергетики получают, используя методику термической диссоциации молекулярного вещества на проволоке из платины, вольфрама либо палладия. Ее нагревают в водородной среде под давлением менее 1,33 Па. А также для получения водорода используются радиоактивные элементы.
Электролизный метод
Наиболее простым и популярным методом выделения водорода считается электролиз воды. Он допускает получение практически чистого водорода. Другими преимуществами этого способа считаются:

- доступность сырья;
- получение элемента под давлением;
- возможность автоматизации процесса из-за отсутствия движущихся частей.
Процедура расщепления жидкости электролизом обратен горению водорода. Его суть в том, что под воздействием постоянного тока на электродах, опущенных в водный раствор электролита, выделяются кислород и водород.
Дополнительным преимуществом считается получение побочных продуктов, обладающих промышленной ценностью. Так, кислород в большом объеме необходим для катализации технологических процессов в энергетике, очистки почвы и водоемов, утилизации бытовых отходов. Тяжелая вода, получаемая при электролизе, в энергетике используется в атомных реакторах.
Получение водорода концентрированием
Этот способ основан на выделении элемента из содержащих его газовых смесей. Так, наибольшая часть производимого в промышленных объемах вещества, извлекается с помощью паровой конверсии метана. Добытый в этом процессе, водород используют в энергетике, в нефтеочистительной, ракетостроительной индустрии, а также для производства азотных удобрений. Процесс получения H2 осуществляют разными способами:
- короткоцикловым;
- криогенным;
- мембранным.
Последний способ считается наиболее эффективным и менее затратным.
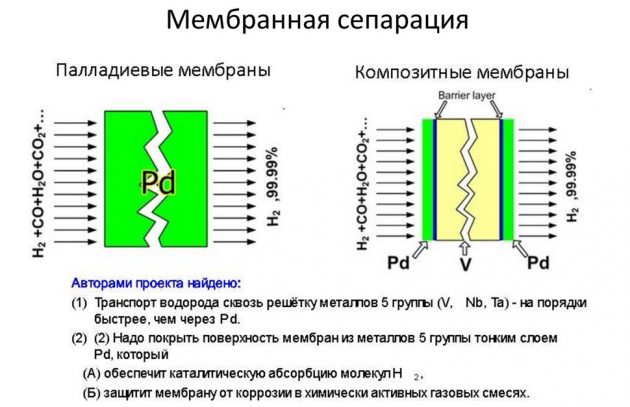
Конденсация под действием низких температур
Эта методика получения H2 заключается в сильном охлаждении газовых соединений под давлением. В результате они трансформируются в двухфазную систему, которая впоследствии разделяется сепаратором на жидкое составляющее и газ. Для охлаждения применяют жидкие среды:
- воду;
- сжиженный этан или пропан;
- жидкий аммиак.

Эта процедура не так проста, как кажется. Чисто разделить углеводородные газы за один раз не получится. Часть компонентов уйдет с газом, забираемым из сепарационного отсека, что не экономично. Решить проблему можно глубоким охлаждением сырья перед сепарацией. Но это требует больших энергозатрат.
В современных системах низкотемпературных конденсаторов дополнительно предусмотрены колонны деметанизации либо деэтанизации. Газовую фазу выводят с последней сепарационной ступени, а жидкость направляется в ректификационную колонну с потоком сырого газа после теплообмена.
Способ адсорбции
Во время адсорбции для выделения водорода используют адсорбенты – твердые вещества, поглощающие необходимые компоненты газовой смеси. В качестве адсорбентов применяют активированный уголь, силикатный гель, цеолиты. Для осуществления этого процесса применяют специальные аппараты – циклические адсорберы или молекулярные сита. При реализации под давлением этот метод позволяет извлекать 85-процентный водород.
Если сравнивать адсорбцию с низкотемпературной конденсацией, можно отметить меньшую материальную и эксплуатационную затратность процесса – в среднем, на 30 процентов. Методом адсорбции производят водород для энергетики и с применением растворителей. Такой способ допускает извлечение 90 процентов H2 из газовой смеси и получение конечного продукта с концентрацией водорода до 99,9%.

Добыча водорода в условиях домашнего хозяйства
Высокотемпературные методы производства водорода в домашних условиях неприменимы. Здесь чаще всего используют электролиз воды.
Выбор электролизера
Для получения элемента дома необходим специальный аппарат – электролизер. Вариантов такого оборудования на рынке много, аппараты предлагают как известные технологические корпорации, так и мелкие производители. Брендовые агрегаты дороже, но качество их сборки выше.
Домашний прибор отличается малыми габаритами и легкостью в эксплуатации. Основными деталями его являются:

- риформер;
- система очистки;
- топливные элементы;
- компрессорное оборудование;
- емкость для хранения водорода.
В качестве сырья берется простая вода из-под крана, а электричество идет из обычной розетки. Сэкономить на электроэнергии позволяют агрегаты на солнечных батареях.
Изготовление аппарата своими руками
Еще дешевле сделать прибор самому в домашних условиях. Сухой электролизер выглядит как герметичный контейнер, который представляет собой две электродные пластины в емкости с электролитическим раствором. Во Всемирной сети предлагаются разнообразные схемы сборки аппаратов разных моделей:
- с двумя фильтрами;
- с верхним либо нижним расположением контейнера;
- с двумя или тремя клапанами;
- с оцинкованной платой;
- на электродах.

Простой прибор для получения водорода создать несложно. Для него потребуются:
- листовая нержавеющая сталь;
- прозрачная трубка;
- штуцеры;
- пластиковая емкость (1,5 л);
- водяной фильтр и обратный клапан.

Помимо этого, нужны будут различные метизы: гайки, шайбы, болты. Первым делом нужно распилить лист на 16 квадратных отсеков, у каждого из них спилить угол. В противоположном от него углу требуется высверлить отверстие для болтового крепления пластин. Для обеспечения постоянного тока пластины нужно подключать по схеме: плюс–минус–плюс–минус. Изолируют эти детали друг от друга с помощью трубки, а на соединении болтом и шайбами (по три штуки между пластинками). На плюс и минус насаживают по 8 пластин.
При правильной сборке ребра пластинок не будут задевать электроды. Собранные детали опускают в емкость из пластика. В месте касания стенок болтами делают два установочных отверстия. Устанавливают защитный клапан для удаления избытка газа. В крышку контейнера монтируют штуцеры и герметизируют швы силиконом.
Тестирование аппарата
Чтобы протестировать аппарат, выполняют несколько действий:

- Наполняют жидкостью.
- Прикрыв крышкой, соединяют один конец трубки со штуцером.
- Второй опускают в воду.
- Подключают к источнику питания.
После включения прибора в розетку через несколько секунд будет заметен процесс электролиза и выпадение осадка.
Правила техники безопасности
Получение водорода в домашних условиях возможно лишь при ответственном подходе к работе. Этот газ способен легко загореться или взорваться, особенно при использовании аппаратов, собранных своими руками.
Чтобы избежать утечек, перед процедурой электролиза следует проверить герметичность всех частей электролизера:

Небезопасными могут быть и покупные аппараты, особенно неизвестных производителей. Брак может случиться и у самых известных брендов, но риск этого намного меньше – там продукцию тщательно проверяют.
В промышленности добыча водорода необходима для энергетики, например, на нем работают такие энергоисточники, как высокотемпературные реакторы с гелиевым теплоносителем. Применяют элемент и в производстве пластиков, синтетических волокон, извести и цемента, листового стекла. В домашних условиях его используют для отопления помещений и снижения расходов автомобильного топлива.
Видео по теме: Водород — открытие, получение, применение
Читайте также:

