Эхографические признаки диагональной трабекулы полости левого желудочка берут ли в армию
Обновлено: 02.07.2024
В статье анализируются ведение беременности и тактика родоразрешения пациентки с единственным желудочком сердца (ЕЖС) после проведения паллиативной операции Фонтена (ОФ). Несмотря на паллиативный характер вмешательства, у пациенток существенно улучшается качество и увеличивается продолжительность жизни, появляется возможность вынашивания беременности. На основании литературных данных отмечено, что для таких пациенток остаются характерными развитие тромбозов, в т. ч. плацентарных сосудов, аритмия, сердечная и фетоплацентарная недостаточность (ФПН), энтеропатии. Проведение паллиативной операции позволяет существенно улучшить также материнский и перинатальный исходы. В представленном клиническом наблюдении у беременной с ЕЖС после проведения ОФ была выявлена наследственная тромбофилия, обусловливающая предыдущие случаи невынашивания беременности. Данное сочетание является крайне редким и неблагоприятным. Назначение и оптимизация дозировок гепарина способствовали вынашиванию беременности, а также предотвращению характерных для этих пациенток тромбозов и эмболий. Наиболее важным в практическом отношении являются неудовлетворительные перинатальные исходы беременности у женщин с ЕЖС. Своевременная хирургическая коррекция истмико-цервикальной недостаточности и ее медикаментозное лечение позволяют выносить беременность до максимально возможного срока.
Большое значение придается анестезиологическому обеспечению оперативного родоразрешения. Подходы к выбору анестезии часто определяются неотложностью оперативного вмешательства. Авторами проанализирован собственный опыт и литературные данные, позволившие оптимизировать анестезиологическую помощь путем проведения интраоперационно прегидратации коллоидным раствором, коррекции возникшего ацидоза и гипокалиемии. Исследование плаценты позволило выявить структурные изменения в виде ее гипоплазии, преждевременного созревания ворсин, утолщения стволовых артерий, а также многочисленные синцитиальные узлы, что свидетельствовало о хронической маточно-плацентарной ишемии.
Ключевые слова: беременность, единственный желудочек сердца, операция Фонтена.
Для цитирования: Мравян С.Р., Петрухин В.А., Мельников А.П. и др. Единственный желудочек сердца и беременность: вчера, сегодня, завтра. РМЖ. Мать и дитя. 2017;25(2):140-144.
Single ventricle and pregnancy: yesterday, today and tomorrow
S.R. Mravyan 1, V.A. Petruhin 1, A.P. Melnikov 1, I.V. Barinova 1, V.P. Pronina 2, A.A. Golovin 1, D.A. Andreev2
1 Moscow Regional Research Institute of Obstetrics and Gynecology
2 Moscow regional research clinical institute named after M.F. Vladimirskiy
Summary
The paper analyzes management of pregnancy and delivery tactics in patients with single ventricle after Fontan procedure. Despite palliative nature of procedure patients have significantly better quality and duration of life and possibility of pregnancy. Published data points that these patients are characterized by thrombosis development (including placental vessels), arrhythmia, cardiac and placental insufficiency, enteropathy. Palliative surgery significantly improves maternal and perinatal outcomes. The clinical case presents a pregnant woman with single ventricle after Fontan procedure with detected hereditary thrombophilia, determined previous cases of miscarriage. This combination is very rare and unfavourable. Prescription and optimization of heparin dosages contributed to child bearing and thrombosis and embolism prevention. The most important in clinical practice are poor perinatal outcomes of pregnancy in women with single ventricle. Timely surgical correction and medical treatment of cervical incompetence allow making pregnancy as long as possible.
Anesthesia is of great importance during delivery. Choice of anesthesia is often determined by the urgency of surgery. Authors have analyzed own experience and literature data on anesthesia. It can be optimized by intraoperative fluid therapy with colloidal solution, correction of acidosis and hypokalemia. Placenta's examination revealed structural changes as hypoplasia, premature ripening of the chorionic villi., thickening of stem arteries, as well as numerous syncytial knots, indicating chronic uteroplacental ischemia.
Keywords: pregnancy; single ventricle; Fontan procedure.
For citation: Mravyan S.R., Petruhin V.A., Melnikov A.P. et al. Single ventricle and pregnancy: yesterday, today and tomorrow // RMJ. 2017. № 2. P. 140–144.
Статья посвящена проблеме единственнойжелудочке сердца и беременности
С 3 по 11 февраля 2016 г. находилась в стационаре по месту жительства.
Госпитализирована в МОНИИАГ 11.02.2016 г. на сроке беременности 34–35 нед. При поступлении жалобы на одышку при физической нагрузке (подъем по лестнице выше 2-го этажа). Состояние относительно удовлетворительное. Кожные покровы обычной окраски и влажности. В легких дыхание везикулярное, хрипов нет. Частота дыхательных движений – 16 в 1 мин. Тоны сердца громкие, ритмичные. Выслушивается неинтенсивный систолический шум на всех точках. ЧСС – 100 в 1 мин. АД – 115/70 мм рт. ст. Печень перкуторно не увеличена. Отеков нет.
При ЭхоКГ: градиент сброса левый желудочек – правый желудочек 5 мм рт. ст. ЕЖС. L-транспозиция магистральных сосудов. ДМПП. Гипоплазия и стеноз легочной артерии после ОФ (экстракардиальный кондуит). Недостаточность трикуспидального клапана 2–3 степени. Фракция выброса – 69%.
Диагноз: беременность 35 нед. ФПН. Синдром задержки роста плода (СЗРП) II степени. Невынашивание в анамнезе. Истмико-цервикальная недостаточность (акушерский пессарий). ВПС. ЕЖС. L-транспозиция магистральных сосудов. ДМПП. Стеноз легочной артерии. ОФ в 2010 г. СН II ФК. Сочетанная тромбофилия.
С целью уточнения состояния плода, лечения ФПН было назначено клинико-лабораторное обследование. Объем инфузионной терапии ограничен до 0,5 л/сут. Получала препараты: поливитамины, йодид калия, валериана, калия и магния аспарагинат, инозин, дипиридамол, прогестерон, гепарин, пирацетам, гемодериват, метамизол натрия, пластырь с лидокаином, противомикробные вагинальные свечи. Составлен план родоразрешения, предусматривавший в случае появления выраженных признаков страдания плода экстренное кесарево сечение под общей анестезией. В связи с недостаточностью кровообращения лактация противопоказана.
17.02.2016 г. при УЗИ плода выявлены нарушения маточно-плацентарного, плодово-плацентарного и плодового кровотоков с эпизодами критического кровотока, в связи с чем было принято решение об экстренном родоразрешении операцией кесарева сечения под эндотрахеальным наркозом.
В предоперационном периоде проведено в/в введение коллоидного препарата гемофузин 6% 1000 мл. При исходном исследовании кислотно-щелочного состояния капиллярной крови (КЩС) рH составил 7,43 (норма – 7,32–7,42), РО2 – 88,2 мм рт. ст. (норма – 92–96 мм рт. ст.). Изменений электролитного состава крови, содержания буферных оснований не было. На 15-й мин от начала операции рH венозной крови составил 7,281, РО2 – 67,4 мм рт. ст. (норма – 37–42 мм рт. ст.). В связи с диагностированным метаболическим ацидозом в/в введен гидрокарбонат натрия 5% 100 мл, что позволило купировать состояние ацидоза. Интраоперационно объем инфузии составил 1500 мл физиологического раствора при кровопотере 1000 мл.
Извлечена живая недоношенная девочка массой 1990 г, длиной 44 см, с гипотрофией I степени, СЗРП I степени. Оценка состояния по Апгар – 6–7 балов. Плацента – 15х11х1 см, вес – 250 г, на плаценте – обширные участки старых инфарктов. Отмечалась повышенная кровоточивость тканей матки.
В послеоперационном периоде в течение первых суток проводилась ингаляция кислорода через маску при сатурации кислорода (SpO2) 98%, инфузия КCl 4% 50,0 под контролем уровня электролитов крови, объем введенной и выпитой жидкости соответствовал диурезу. Выписана на 14-е сут в удовлетворительном состоянии без признаков СН. Лактация прекращена использованием каберголина (2 табл.).
Плацента низкой массы (219 г, 4-й перцентиль, гипоплазия), с плотным желтым очагом в краевых отделах (3 см); плацентарно-плодовый коэффициент низкий – 0,11 (при гестационной норме 0,19–0,20) (рис. 2). При гистологическом исследовании: преждевременное созревание ворсинчатого дерева с преобладанием мелких терминальных ворсин, малой протяженностью синцитиокапиллярных мембран, многочисленными синцитиальными узлами, стенки стволовых артерий утолщенные, склерозированные, имеются распространенные интра-, пери- и интервиллезные отложения фибрина с агглютинацией ворсин, очаг давнего межворсинчатого тромбоза (3 см) в крае диска, очаговая плодовая тромботическая васкулопатия – геморрагический эндоваскулит, облитерация отдельных сосудов, стромальный кариорексис, бессосудистые ворсины со склерозированной стромой (рис. 3).
Известно, что беременные, перенесшие ОФ, характеризуются высокой вероятностью развития преждевременной родовой деятельности, суправентрикулярных аритмий, тромбоэмболий (в т. ч. парадоксальных через ДМПП), энтеропатии и СН [11, 12]. Амбулаторное наблюдение и последующее родоразрешение в 2008 г. пациентки, перенесшей ОФ, не позволили избежать целого ряда перечисленных осложнений.
В последнее время в связи с большим накопленным опытом ведения и родоразрешения пациенток, перенесших ОФ, выработаны детальные рекомендации при этой патологии. Более того, в 2015 г. опубликованы данные многоцентрового ретроспективного исследования, включавшего 37 беременных (57 беременностей) и наблюдавшихся в 13 специализированных центрах Франции. Выкидыши отмечены в 27% случаев, живыми родились 36 детей при одной двойне. У 10% женщин отмечены осложнения со стороны сердечно-сосудистой системы (материнской смертности не было). Наиболее часто выявлялись аритмии (у 3-х пациенток). Тромбоэмболические или геморрагические осложнения были у 9 женщин, причем у 2-х из 3-х тромбоэмболии отмечены на фоне отсутствия антикоагулянтной терапии, а ее назначение было достоверно связано с неудовлетворительным неонатальным прогнозом (OR=10,0, 95% CI [1,5–91,4], p Литература
Первый Московский государственный медицинский университет им. И.М. Сеченова, Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии
Некомпактная кардиомиопатия левого желудочка — клиническая и генетическая характеристика
Журнал: Кардиологический вестник. 2018;13(2): 26-31





Некомпактная кардиомиопатия левого желудочка (НКМЛЖ) — редкое гетерогенное заболевание, в основе которого лежит двуслойное строение миокарда. Один слой образован компактным миокардом, другой слой представляет собой губчатую структуру с множественными трабекулами и межтрабекулярными пространствами, сообщающимися с полостью левого желудочка. Данная форма кардиомиопатии остается малоизвестной широкому кругу клиницистов, несмотря на наличие работ в мировой литературе, посвященных диагностике, лечению и особенностям клинического проявления НКМЛЖ. Основными причинами инвалидизации больных остаются тромбоэмболические осложнения, прогрессирующая сердечная недостаточность и угрожающие жизни нарушения ритма сердца. С внедрением в практику генетических методов исследования, а также с современных методов визуализации сердца появилась возможность ранней диагностики заболевания и своевременного начала терапии. Целью данного обзора является представление актуальной информации о патогенезе, этиологии и клинической картине НКМЛЖ.
Первый Московский государственный медицинский университет им. И.М. Сеченова, Клиника пропедевтики внутренних болезней, гастроэнтерологии и гепатологии
Этиология и патогенез некомпактной кардиомиопатии левого желудочка
В настоящее время НКМЛЖ относится к неклассифицируемым кардиопатиям Всемирной организацией здравоохранения [7] и Европейским обществом кардиологии (ESC) [8] и к генетическим кардиомиопатиям (КМП) Американской ассоциацией сердца (AHA) [9]. В 2013 г. была предложена новая классификация КМП (MOGE (S)) [10], в которой были отражены: M (morphofunctional) —морфологическая характеристика, O (organ involvement) — вовлечение в процесс различных органов и систем, G (genetic or familial inheritance) — тип наследования, E (etiological annotation) — этиология кардиопатии, S (Heart Failure Stage) — стадия сердечной недостаточности. Так, некомпактная КМП может быть как самостоятельной КМП (МLVNC), так и сочетаться с гипертрофической КМП (МLVNC+D). Более детальное и подробное описание нозологии позволило конкретизировать ряд особенностей заболевания, что в свою очередь помогло находить более индивидуальный подход к больным с КМП.
Несмотря на неоспоримую теорию нарушения процессов эмбриогенеза, лежащих в основе развития некомпактного миокарда, существует ряд исследований, подтверждающий гипотезу, что механизмы, ведущие к возникновению некомпактного слоя или увеличению трабекулярности, могут происходить в течение жизни. У молодых спортсменов повышенная трабекулярность может стать следствием ремоделирования миокарда [12]. В этом случае может стать заметным некомпактный слой, но компактный слой остается более выраженным. Высказано предположение, что подробное обследование (электрокардиография, ЭхоКГ, суточное мониторирование электрокардиограммы и магнитно-резонансная томография) способствует распознаванию доброкачественной повышенной трабекулярности, которая может быть физиологической адаптацией к физической нагрузке и может рассматриваться как норма у спортсменов. Увеличение трабекулярности ЛЖ наблюдается у женщин во время беременности, свидетельствуя, что трабекулярность — это ответ на повышение нагрузки ЛЖ или на другие адаптационные механизмы, связанные с беременностью [13]. Кроме того, увеличение трабекулярности наблюдается у отдельных лиц с серповидно-клеточной анемией и может представлять собой излишний ответ миокарда на увеличение преднагрузки [14]. Таким образом, эти доказательства подтверждают гипотезу о возможности возникновения некомпактного миокарда вследствие различных причин, включая беременность, серповидно-клеточную анемию, и профессиональную физическую подготовку.
Истинную распространенность некомпактной кардиомиопатии сложно определить, потому что диагностические критерии не стандартизованы. Большинство исследований, посвященных этой проблеме, проводятся у пациентов с наличием симптомов, а также у родственников больных [15, 16]. Поэтому основным ограничением является то, что доступные данные о распространенности заболевания получены из ретроспективных анализов с узкой выборкой. В исследовании, проведенном в Швейцарии с января 1984 г. по декабрь 1998 г., только у 0,014% пациентов был выявлен некомпактный миокард ЛЖ [15]. Однако за последнее десятилетие интерес к проблеме некомпактного миокарда ЛЖ растет. Этому способствовало появление современных методов визуализации сердца, что позволило диагностировать патологию чаще. Таким образом, в швейцарском исследовании сильно занижена истинная распространенность заболевания. При этом некомпактный миокард ЛЖ встречается намного чаще у пациентов с сердечной недостаточностью [16, 17].
Для НКМЛЖ характерны различные варианты возникновения. Встречаются как спорадические, так и семейные случаи заболевания. Семейная форма НКМЛЖ наблюдается в 18—36% случаев у взрослого населения [3, 18]. Среди детей семейная форма НКМЛЖ встречается в 50% случаев.
Генетика НКМЛЖ
НКМЛЖ — это генетически гетерогенное заболевание со спорадическими и семейными случаями. Оно может быть связано с мутациями в митохондриях, цитоскелете, Z-линии и саркомерными белками. Аутосомно-доминантное наследование [19] встречается чаще, чем с X-сцепленное [20]. Кроме того, встречается аутосомно-рецессивный тип наследования. Вопрос пенетрантности остается нерешенным. У некоторого числа детей с хромосомными аберрациями описана некомпактность миокарда ЛЖ [21]. Генетические причины некомпактной КМП неоднородны и, вероятно, лежат в области двух метаболических путей (в зависимости от клинического фенотипа). Наиболее частый путь, связывающий фенотип с первичной мутацией, — нарушение белок-белкового взаимодействия в следующих системах: система, задействованная в структурных белках сердечной мышцы (например, белки саркомеров), и система протеинов, задействованных в эмбриональном развитии сердечно-сосудистой системы (например, NOTCH сигнальный путь) [21].
Известно более 60 генов, мутации в которых приводят к развитию НКМЛЖ. Согласно данным литературы, мутации в генах, кодирующих белки саркомеров (MYH7, ACTC1, TNNT2, MYBPC3, TPM1 и TNNI3), вероятно, обусловливают почти 1/5 семейных случаев некомпактного миокарда. J. Towbin и соавт. [21] у пациентов без врожденных пороков сердца выявили мутации в Z-линии, кодирующей белок LDB3. Y. Hoedemaekers и соавт. [18] показали, что некомпактная КМП может быть связана с генетическими вариантами генов — TAZ и LMNA, которые кодируют белки, связывающие кальций. A. Postma и соавт. [22] отметили, что при распространенности в 29% мутаций в генах, кодирующих белки саркомеров, доля мутаций в генах MYH7 и MYBPC3 была наибольшей (13 и 8% соответственно) [18, 21—24].
J. Towbin и соавт. [20] показали, что мутации в гене SCN5A, кодирующем натриевые каналы, связаны с нарушениями ритма у пациентов с некомпактной КМП. Мутации в гене, кодирующем белок цитоскелета дистрофин, являются причиной мышечных дистрофий Дюшенна и Беккера у мальчиков, и также описаны у пациентов с некомпактной КМП. Кроме того, гомозиготная делеция 2 п.о. (5208_5209delAG) в области альтернативного сплайсинга гена DSP, способная вызывать аритмогенную и дилатационную КМП, также была описана у пациентов с некомпактной КМП [24].
Следующие хромосомные аномалии были выявлены у пациентов с некомпактной КМП и синдромальными заболеваниями: делеция 1p36, делеция 7p14—3p14.1, субтеломерная делеция 18p, делеция 22q11.2, трисомия 18 и 13, делеция 8p23.1, тетрасомия 5q35.2—5q35, мутации RPS6KA3 (синдром Coffi n-Lowry), NSD1 мутация (синдром Сотоса) и удвоение PMP22 (тип Шарко—Мари—Тута 1А) [4, 9, 28—33].
В то же время при генетическом тестировании семейных форм некомпактной КМП патогенные варианты в уже известных генах, связанных с заболеванием, выявляются не более чем в половине случаев [15]. Это свидетельствует о наличии других еще неизученных генов; при этом, перечень генных локусов продолжает пополняться. Так, ранее мы выявили новый вариант гена DES c.330_338del, который отвечает за развитие как миофибриллярной миопатии, так и НКМЛЖ [34].
Диагностика и клиническое течение заболевания
Иногда для уточнения диагноза требуется магнитно-резонансная томография (МРТ) сердца. Данный вид исследования позволяет выявлять структуру миокарда с высоким пространственным разрешением. МРТ сердца позволяет проводить дифференциальную диагностику НКМЛЖ с аномальными хордами, дилатационной КМП с декомпенсированным гипертоническим сердцем, тромбозом верхушки ЛЖ, с апикальной формой гипертрофической КМП. Существует ряд диагностических критериев, позволяющих установить диагноз НМЛЖ.
Метод S. Petersen и соавт. [38]: измерения проводятся по длинной оси на уровне между митральным клапаном и верхушкой ЛЖ в конце диастолы, сравнивается толщина некомпактного и компактного слоев. Соотношение этих величин более 2,3 позволяет установить диагноз НМЛЖ [38]. Наиболее частая локализация некомпактного миокарда — средние, верхушечные сегменты и верхушка Л.Ж. Крайне редко некомпактный миокард выявляется в базальных сегментах.
В 2007 г. R. Stacey и соавт. [39] предложили оценивать соотношение компактного и некомпактного слоев в конце систолы; полученное соотношение больше 2 также свидетельствует о наличии НКМЛЖ.
Наибольшую чувствительность и специфичность (91,6 и 86,5% соответственно) имеет метод, разработанный A. Jacquier и соавт. [40]. Они предложили проводить вычисление общей массы миокарда и массы непосредственно некомпактного слоя, а затем оценивать их соотношение; соотношение 20% и более является критерием некомпактного.
Для НКМЛЖ характерна триада симптомов: нарушения ритма и проводимости сердца, сердечная недостаточность и тромбоэмболические осложнения.
У пациентов с НМЛЖ в 88—94% случаев выявляются изменения на ЭКГ [5, 15]. При этом дисфункция синусового узла может быть начальным клиническим проявлением заболевания [41]. У 5—29% пациентов диагностируется фибрилляция предсердий [42]. Желудочковые нарушения ритма являются ведущими в структуре заболевания и выявляются с частотой 19—47% [43].
Сердечная недостаточность у пациентов с НМЛЖ может быть как систолическая, так и диастолическая. Причина развития систолической дисфункции до конца не ясна. Одна из возможных причин — гипоперфузия субэндокардиальных слоев при наличии сохранных коронарных артерий [3, 42].
Тромбоэмболические осложнения возникают у пациентов с НМЛЖ с частотой 13—24% [44]. Тромбоэмболические осложнения могут проявляться как инсульт, транзиторная ишемическая атака, инфаркт миокарда, мезентериальный тромбоз, инфаркт почек или периферическая эмболия [42, 45, 46]. Причиной этих осложнений могут служить тромбы, которые образовались в полости ЛЖ, в следствии систолической дисфункции и наличия повышенной трабекулярности и глубоких межтрабекулярных пространств [44].
НКМЛЖ можно рассматривать как самостоятельное заболевание (изолированный НКМЛЖ) или как сочетанную патологию с некардиальными и кардиальными заболеваниями. Например, НКМЛЖ встречается у пациентов с тафазинопатиями (вызванными мутациями в гене TAZ [Tafazzin или G4.5]) с дилатационным и гипокинетическим фенотипом [20, 23, 47—49]. В качестве структурного признака с потенциальным и функциональным влиянием НМЛЖ может способствовать дисфункции ЛЖ при сочетанных кардиологических заболеваниях, таких как ишемическая болезнь сердца или врожденный порок сердца. На основании современных представлений НКМЛЖ можно сгруппировать следующим образом:
— изолированная НКМЛЖ. Наличие некомпактного миокарда в ЛЖ, нормальная систолическая и диастолическая функция ЛЖ, толщина стенок. Генетические особенности для такого течения заболевания пока не известны. Но наличие морфологических изменений в виде зон некомпактного миокарда должны рассматриваться как предрасполагающие факторы для будущего возможного прогрессирования КМП [50];
— сочетание НКМЛЖ с врожденными пороками сердца. Наиболее часто НКМЛЖ сочетается с такими пороками сердца, как открытый артериальный проток, дефекты межжелудочковой и межпредсердной перегородок, но также с более тяжелыми, как аномалия Эбштейна или гипоплазия левых отделов сердца [28, 51];
— аритмическая форма НКМЛЖ, для которой характерны нормальные размеры сердца, сохраненная систолическая функция ЛЖ и наличие желудочковых нарушений ритма сердца. Они являются независимым фактором риска неблагоприятного исхода у пациентов с НКМЛЖ в отличие от пациентов с такими же нарушениями ритма сердца в отсутствие некомпактного миокарда [52—54];
— дилатационный тип НКМЛЖ, характеризуется дилатацией ЛЖ и снижением его систолической функцией. При данном типе НКМЛЖ наблюдается волнообразное течение с периодами улучшения систолической функции и уменьшения камер сердца [4, 16];
— гипертрофический тип. Характеризуется обычно асимметрично утолщенной перегородкой с нарушенной диастолической и повышенной систолической функцией. При дальнейшем прогрессировании заболевания наблюдаются дилатация полостей и снижение систолической функции [55];
— смешанный фенотип (гипертрофический + дилатационный), для которого характерны утолщение стенок, дилатация и снижение систолической функции Л.Ж. Этот фенотип ассоциирован с повышенным риском смерти и встречается у детей с метаболическими или митохондриальными заболеваниями [55]. Прогноз у пациентов с этим фенотипом хуже, чем у пациентов с дилатационным типом;
— поражение ПЖ, или бивентрикулярный тип НКМЛЖ. Хактеризуется повышенной трабекулярностью как ПЖ, так и Л.Ж. Известные диагностические критерии не применимы для оценки некомпактного слоя ПЖ [56]. Для данного типа характерно наличие выраженной трабекулярности и губчатого миокарда в ПЖ чаще всего на латеральной стенке ПЖ, с поражением трикуспидального клапана в тяжелых случаях [4];
— рестриктивный тип НКМЛЖ. Встречается крайне редко. Для него характерны расширение левого или обоих предсердий и диастолическая дисфункция. Этот фенотип имитирует клиническое течение рестриктивных КМП. Пациенты, как правило, имеют плохой прогноз из-за внезапных кардиальных осложнений, связанных с аритмией, или реже сердечной недостаточности с сохраненной фракцией выброса [55].
Приобретенная и потенциально обратимая НКМЛЖ, как сообщалось ранее, встречается у спортсменов, беременных, пациентов с анемией, хронической почечной недостаточностью [13, 14, 57]. Эти наблюдения расширяют диапазон этиопатогенетических гипотез от нарушения процессов эмбриогенеза до приобретенных патогенетических звеньев, включая гемодинамический, а также фенотип управляемую экспрессию генов.
Заключение
Таким образом, НКМЛЖ представляет собой редкое, генетически гетерогенное заболевание с крайне неблагоприятным прогнозом для пациентов. Ранняя диагностика и своевременное начало лечения являются единственной возможностью для пациента снизить риск развития тромбоэмболических осложнений и проявлений сердечной недостаточности. С появлением современных методов визуализации сердца и внедрением в клиническую практику генетических методов исследования ранняя диагностика данного заболевания стала возможной.
Работа поддержана средствами гранта РФФИ 17−04−00521 А.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Аневризма левого желудочка сердца — это тяжелое осложнение перенесенного инфаркта миокарда, представляющее собою участок истонченной сердечной мышцы. Поврежденный участок мышечной ткани, принявший на себя давление крови во время приступа, продолжает испытывать давление, не в силах принять первоначальное положения.
В результате ткань истончается и растягивается, образуя выпячивание- аневризму. Чаще всего поражается левый желудочек в передней верхней части.
Аневризма левого желудочка сердца классифицируется по нескольким признакам:
1. По времени появления:
- Острая форма — выявляется в срок до 2 недель после сердечного приступа.
- Подострая форма — обнаруживается в период со 2 по 6 неделю после инфаркта, чаще всего характеризуется неправильным формированием рубцовой ткани.
- Хроническая форма — технически сложная для диагностирования, симптоматически схожа с острой сердечной недостаточностью.
2. По форме проявления:
В практике более часто встречаются диффузные формы, реже диагностируют расслаивающуюся и грибовидную аневризмы.
3. По структуре:
- Истинное — выпяченное из рубцовой или омертвевшей ткани образование на стенке желудочка.
- Ложное — изъян, сформировавшийся вследствие нарушения целостности мышечной ткани сердца, с высоким риском разрыва аневризмы.
- Функциональное — деформированный участок жизнеспособной мышечной оболочки.
Симптомы и причины появления
Основная причина появления аневризма — инфаркт миокарда. Так же появление истонченных, выпирающих участков ткани на сердце может быть спровоцировано такими причинами, как:
- повышенная физическая нагрузка в течение длительного периода времени;
- стойкое повышенное артериального давления;
- инфекционные заболевания, такие как: сифилис, бактериальный эндокардит и даже регулярное воспаление миндалин;
- травматизм (ранение в сердце, тупые травмы грудной клетки). Сюда можно отнести пулевые ранения, колото-резаные раны, падение с высоты, автомобильные аварии.
Симптоматически наличие аневризмы левого желудочка сердца определить невозможно, но поскольку она вызывает нарушения работы сердца то и, соответственно, вызывает общие признаки расстройства сердечной деятельности. Среди них:
- болезненные ощущения в области сердца;
- сердечные боли после физических и эмоциональных нагрузок;
- дискомфорт области груди;
- одышка и учащенное сердцебиение;
- частые головокружения обморочные состояния;
- отечность конечностей;
- признаки удушья, нехватки воздуха и другие симптомы.
Диагностировать аневризму желудочка сердца может врач-кардиолог. После осмотра пациента и получения результатов всех необходимых исследований, в том числе ЭКГ, УЗИ и МРТ. Своевременная диагностика поможет избежать тяжелейших осложнений, часто смертельных. Для определения плана лечения необходимо точно знать локализацию, структуру и размеры аневризмы.
Методы диагностики

Главные способы диагностирования аневризмы основаны на последовательном выявлении клинических и инструментальных признаков. Начинается обследование с опроса больного, сбора анамнеза, некоторых лабораторных исследований крови и мочи — эти данные позволяют обнаружить сопутствующие заболевания, наличие которые может повлиять на развитие аневризмы. Пациент также получает направление на ЭКГ, МРТ или УЗИ и другие исследования.
Традиционные методы диагностики и информация, которую они предоставляют:
- ЭКГ — позволяет выявить признаки обширного инфаркта, даже перенесенного ранее.
- МРТ — предоставляет данные о локализации аневризмы и ее размеры.
- УЗИ — позволяет визуально осмотреть зоны выпячивания ткани сердца, определить форму аневризмы.
- ЭхоКг — определяет структуру выпячивания (истинное, ложное, функциональное), обнаруживает тромбы в полости сердца, при их наличии.
- Левая вентрикулография — помогает определить не только локализацию и размер аневризмы, но и, что более важно, наличие или отсутствие сокращений в аневризме, и их характер.
Комплексное всестороннее обследование пациента позволяет получить полную картину деформации тканей желудочка, а значит, назначить точное и наиболее эффективное лечение. Помимо медикаментозной терапии, больным с выявленной аневризмой левого желудочка сердца может быть назначено хирургическое вмешательство. Обычно такое решение принимается лечащим врачом в случае, если размеры поврежденной ткани превышают 20% площади стенки.
Отказ от обследования и лечения - это большой риск для пациента. Наличие не диагностированной аневризмы может спровоцировать развитие сопутствующих заболеваний от аритмии и тромбоза до внезапной смерти по причине разрыва истонченной стенки.
Методы лечения
В связи с относительно благоприятным прогнозом при бессимптомных аневризмах левого желудочка (ЛЖ), показания к хирургическому лечению у таких пациентов относительны. Тем не менее, у пациентов, которым показана хирургическая реваскуляризация миокарда (АКШ), в некоторых случаях необходимо выполнять хирургическое восстановление правильной формы левого желудочка.
Хирургическое лечение абсолютно показано пациентам, у которых в результате инфаркта миокарда появилась дисфункция ЛЖ с участками акинезии и дискинезии его стенок и закономерным увеличением объема ЛЖ: > 80 мл / м 2 при сокращении и > 120 мл / м 2 в момент расслабления, а также при угрозе разрыва аневризмы и в случае тромбоэмболического синдрома при тромбированных аневризмах.
При правильном профессиональном подходе, внимательном изучении функции ЛЖ по данным ЭхоКГ, оценке формы и локализации аневризмы, фракции выброса сокращающейся (уцелевшей) части ЛЖ – операция по устранению левожелудочковой аневризмы является вполне оправданной, так как впоследствии снижается напряжение в стенке ЛЖ, мышечные волокна вновь направляются в правильную сторону, возрастает систолическая и улучшается диастолическая функция ЛЖ.
При хирургическом лечении аневризмы ЛЖ выполняется стандартный доступ путем срединной стернотомии. Аппарат искусственного кровообращения подключается как для АКШ, для удобства устанавливается дренаж ЛЖ через правые легочные вены. После кардиоплегии участок аневризмы выглядит как белесая, фиброзная площадка, впалая в полость левого желудочка. Выполняется разрез аневризмы вдоль передней нисходящей артерии, отступая от нее не менее 1,5 см. Имеющийся в полости тромб удаляется, исключая оставление даже очень мелких фрагментов. Часто такие операции сопровождаются вмешательством на митральном клапане, а также шунтированием передней нисходящей артерии и других артерий при наличии показаний. Оценив объем резецированного участка приступают к ремоделированию и восстановлению геометрии ЛЖ. Методик для этого предложено много, ниже мы приведем основные из них. После завершения хирургических манипуляций на сердце, выполняется важный процесс изгнания воздуха из полостей сердца, следом к сердцу пускают кровоток, снимая зажим с аорты, и через пару минут происходит восстановление сердечной деятельности. Окончание сеанса искусственного кровообращения для оперированного ЛЖ может стать настоящим испытанием и потребовать применение до трех инотропных и вазопрессорных препаратов, а также внутриаортальной баллонной контрапульсации.
Техники ремоделирования ЛЖ
- Линейная пластика по Кули (Cooley). Стенка аневризмы иссекается с оставлением краев шириной 3 см для обеспечения надежной линейной герметизации полости ЛЖ, при помощи толстой артавматичной нити из полипропилена и укрепляющих фетровых прокладок вдоль обоих краев шва. Наибольшая надежность данной пластики достигается путем двухрядного шва. Первый ряд – матрасный шов, второй-обвивной.
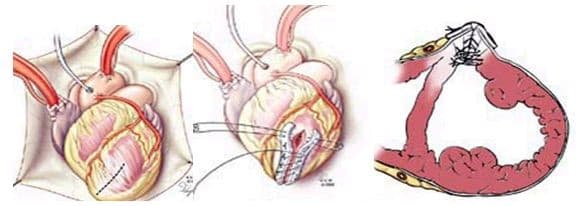
- Кисетная пластика по Жатене (Jatene). После вскрытия аневризмы ЛЖ на границе рубцовой ткани и жизнеспособного миокарда накладывается кисетный шов и затягивается. ЛЖ герметизируется аналогично предыдущему случаю.
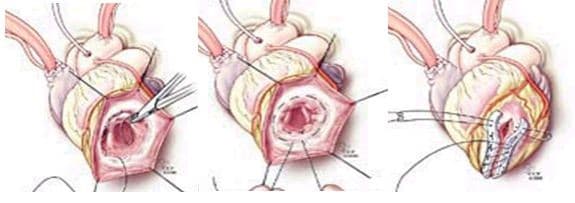
- Эндовентрикулопластика заплатой по Дору (Dor). Вскрывается полость аневризмы ЛЖ, выполняется тромбэктомия, на границе рубцовой ткани и жизнеспособного миокарда накладывается и затягивается кисетный шов. В оставшийся дефект стенки вшивается заплата из ксеноперикарда, закрывая дефект стенки и исключая из гемодиамики тромбогенную поверхность. Далее куполом над заплатой сшиваются стенки аневризматического мешка двухрядным линейным швом.
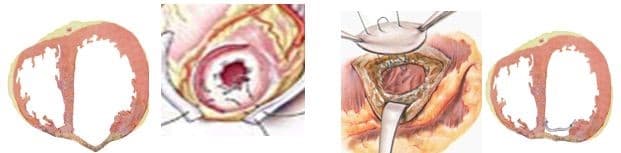
Прогресс не стоит на месте, и методики постоянно совершенствуются, но основные хирургические принципы для лечения данной патологии представлены вашему вниманию и заключаются в стремлении к уменьшению полости ЛЖ за счет резекции нефункционального аневризматического мешка и восстановлению близкой к нормальной геометрической формы ЛЖ применяя разной формы заплаты и кисетные пластики.
Результаты хирургического лечения аневризмы левого желудочка сердца
Частым осложнением после операции по поводу аневризмы ЛЖ является синдром малого выброса, который развивается вследствие чрезмерного уменьшения размеров полости ЛЖ, а так же желудочковые нарушения ритма и легочная недостаточность.
30-ти дневная летальность в последние годы снизилась и составляет 3-7%. Факторы повышенного риска операции это: пожилой возраст, женский пол, операция в экстренном порядке, а так же операция дополненная протезированием митрального клапана, исходно низкая сократительная способность миокарда (ФВ менее 30%), умеренная и высокая легочная гипертензия, почечная недостаточность.
При правильном выполнении операции в отдаленном послеоперационном периоде наблюдаются, как правило, положительные эффекты. Улучшается: функция ЛЖ, фракция выброса, толерантность к физической нагрузке. Снижается класс стенокардии, класс сердечной недостаточности. 5-летняя выживаемость пациентов достигает 80%, 10-летняя - около 60%.
В нашей клинике успешно выполняются все виды операций на сердце включая хирургическое ремоделирование и пластику при аневризмах ЛЖ.
Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.

Введение. Малые аномалии сердца (МАС) как морфологическая основа функциональных изменений сердечной деятельности способны усугублять течение органических поражений сердца. К наиболее изученным МАС относятся ложные хорды левого желудочка (ЛХЛЖ) и пролапс митрального клапана. Распространенность, связь с внешними признаками дизэмбриогенеза, а также прогностическое значение отдельных МАС изучены недостаточно.
Материалы и методы. Обследовано 611 практически здоровых людей в возрасте от 18 до 23 лет (средний возраст 20,3 ± 1,6 года), из них 257 юношей и 354 девушки. Всем обследованным выполнено фенотипическое, антропометрическое и эхокардиографическое обследования. Для выявления связей МАС с нарушениями сердечного ритма 205 обследованным выполнено холтеровское мониторирование ЭКГ.
Результаты. МАС выявлены у 90 % обследованных лиц: аневризма межпредсердной перегородки (24 %), пролапс трикуспидального клапана (23,4 %), асимметрия аортального клапана (20,6 %), добавочные папиллярные мышцы (39,4 %) и ЛХЛЖ (75,1 %). Корреляционный анализ показал наличие связей между этими МАС и костными признаками дизэмбриогенеза (деформациями грудной клетки, арахнодактилией, долихостеномелией и арковидным нёбом), а также нарушениями сердечного ритма (суправентрикулярными и желудочковыми экстрасистолами, миграцией водителя ритма и эпизодами АВ-блокады 1-й степени). У пациентов с марфаноидной внешностью выше среднее число МАС (2,1 ± 1,4 vs 0,9 ± 0,7, p

Рис. 1. Корреляционные связи малых аномалий сердца с костными признаками дизэмбриогенеза и особенностями сердечного ритма. Прямая линия — прямая корреляционная связь, пунктирная линия — обратная корреляционная связь
Fig. 1. Correlations of small heart anomalies with bone signs of dysembryogenesis and heart rhythm features. Direct line – direct correlation, dotted line — reverse correlation
Существование тесной связи между МАС и костными признаками дизэмбриогенеза подтверждается высокой частотой выявления отдельных МАС у лиц молодого возраста с марфаноидной внешностью (рис. 2).

Рис. 2. Распространенность малых аномалий сердца у лиц молодого возраста с марфаноидной внешностью
Fig. 2. Prevalence of small heart anomalies in young people with marfanoid habitus
Молодым людям с марфаноидной внешностью свойственно более частое выявление значимых ЛХЛЖ, пролапса трикуспидального клапана, асимметрии аортального клапана и аневризмы межпредсердной перегородки (р ×
Об авторах
Евгений Владимирович Тимофеев
канд. мед. наук, доцент, кафедра пропедевтики внутренних болезней
Эдуард Геннадьевич Малев
д-р мед. наук, профессор, кафедра пропедевтики внутренних болезней
Эдуард Вениаминович Земцовский
д-р мед. наук, профессор, кафедра пропедевтики внутренних болезней
Список литературы
Дополнительные файлы
1. Рис. 1. Корреляционные связи малых аномалий сердца с костными признаками дизэмбриогенеза и особенностями сердечного ритма. Прямая линия — прямая корреляционная связь, пунктирная линия — обратная корреляционная связь

2. Рис. 2. Распространенность малых аномалий сердца у лиц молодого возраста с марфаноидной внешностью

© Тимофеев Е.В., Малев Э.Г., Земцовский Э.В., 2020
Эта статья доступна по лицензии Creative Commons Attribution 4.0 International License.
Читайте также:

