Что положено в основу современной классификации ферментов
Обновлено: 02.07.2024
Лекция 4
Ферменты:
классификация,
свойства,
использование
в
биотехнологических процессах
1 Общие свойства ферментов
Биохимические процессы, протекающие при хранении сырья и при производстве пищевых продуктов, связаны с действием собственных ферментов пищевого сырья, а также ферментов, вносимых в ходе технологического процесса в виде ферментных препаратов. Последние могут быть животного, растительного или микробного происхождения.
Наиболее древние ферментативные процессы, освоенные человеком – спиртовое и молочнокислое брожение, применение сычуга при приготовлении сыров, использование солода и плесневых грибов для осахаривания крахмалистого сырья, применение заквасок при изготовлении хлеба.
В настоящее время многие отрасли пищевой промышленности, в медицине и сельском хозяйстве основаны на использовании различных ферментативных процессов.
Ферменты – это высокоспецифичные белки, выполняющие функции биологических катализаторов.
Катализатор - это вещество, которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется.
Особенности ферментов как биологических катализаторов
Ферменты обладают всеми общими свойствами обычных катализаторов. Но, по сравнению с обычными катализаторами, все ферменты являются белками. Поэтому они обладают особенностями, отличающими их от обычных катализаторов. Эти особенности ферментов, как биологических катализаторов, иногда называют общими свойствами ферментов. К ним относятся:
1. высокая эффективность действия. Ферменты могут ускорять реакцию в 10 8
-10 12
раз;
2. высокая избирательность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия);
3. высокая чувствительность ферментов к неспецифическим физико- химическим факторам среды - температуре, рН, ионной силе раствора и т.д.;
4. высокая чувствительность к химическим реагентам;
5. высокая и избирательная чувствительность к физико-химическим воздействиям тех или иных химических веществ, которые благодаря этому могут взаимодействовать с ферментом, улучшая или затрудняя его работу.
Ферменты ускоряют химические реакции благодаря тому, что при взаимодействии с субстратом они образуют фермент-субстратный комплекс, и для этого требуется значительно более низкая энергия активации (по сравнению с протеканием реакции без фермента); на второй стадии этот комплекс распадается на продукты реакции и свободный фермент, который может взаимодействовать с новой молекулой субстрата.
Многие ферменты являются двухкомпонентными, то есть состоят из белковой части – апофермента и связанного с ним небелкового компонента – кофермента, участвующего в действии фермента в качестве обязательного кофактора. В качестве коферментов могут выступать витамины и их производные, нуклеотиды и нуклеозиды.
Единицы активности ферментов. Для характеристики активности ферментов используются различные единицы:
- стандартная единица активности фермента – это такое количество
фермента, которое катализирует превращение одного микромоля данного
субстрата за одну минуту при заданных условиях. Стандартная единица фермента обозначается буквой Е (единица) или буквой U (unit);
- катал – каталитическая активность, способная осуществлять реакцию
со скоростью равной 1 молю в секунду в заданной системе измерения
активности. Каталитическая активность в 1 катал (кат) при практическом
каждом классе есть многочисленные подклассы и подподклассы. Каждый класс имеет порядковый номер, строго за ним закрепленный.
1.
Оксидоредуктазы.
Катализируют различные окислительно- восстановительные реакции. Сюда входят подклассы дегидрогеназ
(отщепляющих атомы водорода), редуктаз (присоединяющих атомы водорода), оксигеназ (внедряющих кислород в субстрат) и др.
2. Трансферазы. Катализируют перенос функциональных групп от одного субстрата на другой. Сюда относят аминотрансферазы (переносят аминогруппу), метилтрансферазы (метильную группу), киназы (переносят остаток фосфорной кислоты от АТФ).
3. Гидролазы. Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва).
Сюда относят эстеразы, гликозидазы, пептидазы.
4. Лиазы. Отщепляют от субстратов негидролитическим путем определенную группу, например, декарбоксилазы, альдолазы.
5.
Изомеразы. Катализируют различные внутримолекулярные превращения (изомеразы, мутазы – в том случае, когда изомеризация состоит во внутримолекулярном переносе какой-либо группы).
6. Лигазы (синтетазы). Катализируют реакции присоединения друг к другу двух молекул с образованием ковалентной связи, этот процесс сопряжен с затратой энергии АТФ (РНК-полимераза).
3 Ферменты, используемые в биотехнологических процессах
Внимание технологов, перерабатывающих биологическое сырье, привлекают прежде всего оксидоредуктазы и гидролазы.
3.1 Оксидоредуктазы
Полифенолоксидаза может катализировать окисление моно-, ди-, и полифенолов. С действием этого фермента связано образование
темноокрашенных соединений – меланинов при окислении кислородом воздуха аминокислоты тирозина (потемнение срезов картофеля, яблок, грибов и других растительных тканей). В пищевой промышленности основной интерес к этому ферменту сосредоточен на предотвращении указанного ферментативного потемнения, что может быть достигнута путем тепловой инактивации фермента (бланшировка) или добавлением ингибиторов (NaHSO
3
, SO
2
, NaCl).
Каталаза катализирует разложение пероксида водорода по реакции самоокисления-самовосстановления. В живом организме каталаза защищает клетки от губительного действия перекиси водорода. Хорошим источником для получения промышленных препаратов каталазы являются культуры микроорганизмов и печень крупного рогатого скота.
Липоксигеназа
катализирует окисление полиненасыщенных высокомолекулярных жирных кислот (линолевой и линоленовой) кислородом воздуха с образованием гидроперекисей.
Липоксигеназе принадлежит важная роль в процессах созревания пшеничной муки, связанных с улучшением ее хлебопекарных достоинств.
При этом происходит осветление муки, укрепление клейковины, снижение активности протеолитических ферментов и другие положительные изменения.
Глюкозооксидаза окисляет глюкозу с образованием глюконовой кислоты. Высокоочищенные препараты глюкозооксидазы получают из плесневых грибов рода Aspergillus и Penicillium.
Препараты глюкозооксидазы нашли применение в пищевой промышленности как для удаления следов глюкозы, что необходимо при обработке пищевых продуктов, качество и аромат которых ухудшаются из-за того, что в них содержатся восстанавливающие сахара; например, при получении из яиц сухого яичного порошка.
3.2 Гидролазы
Для отрасли пищевой промышленности наибольший интерес представляют три подкласса ферментов класса гидролаз. Это ферменты, действующие на сложноэфирные связи – эстеразы; действующие на гликозидные соединения – гликозидазы и действующие на пептидные связи –
протеазы.
Основные ферменты подкласса эстераз:
- липаза или триацилглицероллипаза широко распространена в природе.
Обычно липазы катализируют реакцию расщепления триглицеридов. Причем предпочтительнее гидролизуются связи в положении
3 и 1 и лишь затем в положении 2. Установлено, что липазы быстрее отщепляют остатки высокомолекулярных жирных кислот, чем низшие карбоновые кислоты;
-
пектинэстераза
синтезируется высшими растениями, микроскопическими грибами, дрожжами и бактериями. Пектинэстераза катализирует гидролиз сложноэфирных связей в молекуле растворимого пектина, в результате чего образуется метиловый спирт и полигалактуроновая кислота. При этом жилирующая способность кислоты ниже, чем у самого пектина. Благодаря этим свойствам фермент пектинэстераза применяется для осветления плодовых соков и вина.
Основные ферменты подкласса гликозидаз:
Основной формой запасных углеводов в семенах и клубнях растений является крахмал. Ферментативные превращения крахмала лежат в основе многих пищевых технологий.
а-Амилаза. Эти ферменты обнаружены у животных (в слюне и поджелудочной железе), в растениях (проросшее зерно пшеницы, ржи, ячменя), они вырабатываются плесневыми грибами и бактериями. Все эти ферменты гидролизуют крахмал, гликоген и родственные α -1,4-гликозиды с
образованием, главным образом, декстринов и небольшого количества дисахарида – мальтозы.
β-Амилаза. Это группа ферментов в основном растительного происхождения. Её источниками являются зерно пшеницы, а также пшеничный и ячменный солод, соевые бобы, клубни картофеля.
β-Амилаза отщепляет мальтозу от конца гликозидной цепи, разрывая гликозидные связи α-1,4 через одну до тех пор, пока не встретится точка ветвления со связью α-1,6.
γ-амилаза продуцируется различными видами плесневых грибов рода
Aspergillus. Эти ферменты расщепляют как амилозу, так и амилопектин до глюкозы. Они способны гидролизовать α -1,4 и α -1,6 гликозидные связи.
Поэтому данный фермент используется в промышленности для ферментативного получения глюкозы.
Инулаза осуществляет гидродиз инулина и других полифруктозанов. В результате образуется фруктоза (95%) и глюкоза (5%).
Инулаза содержится в тех же растениях (топинамбур, цикорий), в которых присутствует инулин. Существуют инулазы микробного происхождения.
Целлюлолитические
ферменты.
Ферментативное разрушение целлюлозы и родственных ей полисахаридов (гемицеллюлозы, лигнина) – сложный процесс, требующий участия комплекса ферментов.
Применение целлюлолитических ферментов представляет большой интерес, т. к. может обеспечить получение различных биотехнологических продуктов (глюкозы, этанола, ацетона, микробной биомассы).
Протеолитические ферменты. Основной реакцией, катализируемой протеолитическими ферментами, является гидролиз пептидной связи в молекулах белков и пептидов.
По современной классификации различают эндо- и экзопептидазы.
Ферменты первой группы (эндопептидазы) могут гидролизовать глубинные пептидные связи и расщеплять молекулу белка на более мелкие фрагменты;
ферменты второй группы (экзопептидазы) не могут гидролизовать пептидные связи, находящиеся в середине цепи, и действуют либо с карбоксильного, либо с аминного конца цепи, отщепляя последовательно одну за другой концевые аминокислоты.
По типу происхождения протеазы подразделют на растительные, животные и микробные.
Протеазы животного происхождения уже давно и широко используются в пищевой промышленности.
Трипсин секретируется поджелудочной железой в виде неактивного предшественника трипсиногена. Высокоочищенный трипсин применяется для медицинских целей, а также в пищевой промышленности для производства гидролизатов.
Пепсин вырабатывается слизистой желудка в виде пепсиногена.
Пепсиноген превращается в активный пепсин под действием НС1.
Реннин – этот фермент имеет много сходства с пепсином и содержится в соке четвертого отдела желудка телят. Реннин образуется из предшественника – прореннина. Пепсин и ренин являются основными компонентами промышленных препаратов, используемых для свертывания молока
Микробные протеазы – чрезвычайно разнообразны и широко применяются (на их долю приходится около 40% от всех используемых верментов). Наибольшее применение нашли щелочная сериновая протеаза, которая используется в моющих средствах; грибная протеаза из Мусоr, которая заменила телячьи сычуги в производстве сыра, а грибная протеаза из
A. oryzae (в комплексе с амилазой), используемая в хлебопечении.
4 Иммобилизованные ферменты
В различных пищевых технологиях долгое время применялись лишь препараты свободных ферментов, срок использования которых – один производственный цикл. Благодаря достижениям молекулярной биологии,
биохимии и энзимологии в настоящее время организовано производство ферментов длительного
(пролонгированного) действия или иммобилизованных ферментов, т. е. связанных ферментных препаратов.
Сущность иммобилизации ферментов заключается в присоединении их в активной форме тем или иным способом к изолированной фазе (инертной матрице), которая обычно нерастворима в воде и часто представляет собой высокомолекулярный гидрофильный полимер, например, целлюлозу, полиакриламид и т. п.
Иммобилизация часто приводит к изменениям основных параметров ферментативной реакции. Как правило, её скорость снижается.
Иммобилизованные ферменты как катализаторы многоразового действия можно использовать, в основном, для трех практических целей: аналитических, лечебных и препаративных (промышленных).
В случае препаративного применения основную роль играет стоимость, а также возможность автоматизации процесса. Несмотря на большие потенциальные возможности использования иммобилизованных ферментов в производстве, в настоящее время реализованы лишь немногие, например: разделение D- и L-аминокислот; получение сиропов с высоким содержанием фруктозы; возможно использование иммобилизованных ферментов при производстве сыров, стабилизации молока и удалении лактозы из молочных продуктов.
Ферменты, или энзимы – это белковой природы, образующиеся и функционирующие во всех живых организмах. Слово фермент происходит от лат. fermentum – закваска, другое название ферментов – энзимы от греч. en zyme – в дрожжах.
Впервые ферментативные процессы были открыты в бродильном производстве. Современная ферментология или энзимология– это наука о ферментах, их структурной организации. Она решает задачи изучения механизмов действия ферментов, путей регуляции ферментной активности. Такой интерес к биокатализаторам не случаен. Ферменты – это важнейшие компоненты клетки, без них невозможны синтез, распад и взаимопревращения в живых организмах. Через ферментный аппарат и регуляцию его активности происходит и регуляция скорости метаболических реакций. Изучение важно для биологии, медицины, фармации, многих областей народного хозяйства. Установлено, что многие заболевания человека связаны с нарушением деятельности ферментов, целый ряд ферментов является лекарственными препаратами.
Общие и специфические свойства ферментов.
Являясь катализаторами, то есть веществами, ускоряющими реакции, ферменты имеют ряд общих свойств с химическими небиологическими катализаторами.
1. Ферменты и входят в состав конечных Р и выходят из реакции в неизменном виде, они не расходуются в процессе катализа.
2. Ферменты не могут возбудить реакций, противоречащим законам термодинамики, они ускоряют только те реакции, которые могут протекать и без них.
3. Ферменты, как правило, не смещают положения равновесия реакции, а лишь ускоряют его достижение.
Вместе с тем ферменты обладают и специфическими свойствами:
1. По химическому строению ферменты являются белками (>99,9).
2. Эффективность ферментов на несколько порядков выше, чем небиологических катализаторов.
а) если реакция протекает без катализатора, то Еа = 75,7 кдж/моль, пузырьки О2 почти не видны;
б) если прибавить катализатор небиологический то Еа = 54,1 кдж/моль, пузырьки отчетливо видны;
3. Высокая специфичность – каждый фермент катализирует одну единственную реакцию или одну группу реакций, тогда как неорганические катализаторы действуют при различных типах реакций.
Химическая природа и строение ферментов.
Важным доказательством белковой природы ферментов явились работы Пастера (инактивация ферментов брожения при кипячении), Павлова (доказал белковую природу пепсина – фермента желудочного сока) и т.д.
1) важный признак белковой природы ферментов – их большая Mr. Например, у ДГ Mr = 4 ´10 6 ; 4,8 ´10 5 и т.д.
2) растворы ферментов имеют коллоидный характер – они не проходят через полунепроницаемую мембрану, осаждаются из растворов теми же реактивами, что и белки;
3) ферменты денатурируют и теряют свою активность под влиянием высокой температуры, УЗ, сильных щелочей и других факторов;
4) ферменты, как и белки, обладают амфотерными свойствами, электрофоретической подвижностью и рI.
5) как и белки, ферменты обладают высокой специфичностью;
6) наконец, прямым доказательством белковой природы ферментов явился искусственный синтез ферментов (рибонуклеаза, лизоцим), которые не отличаются по свойствам и биологической активности от природных аналогов.
| Ферменты | |
 | |
| простые белки | сложные белки |
| состоят только из ППЦ | состоят из ППЦ + небелковый компонент |
| (гидролитические ферменты – пепсин, трипсин, уреаза и др.) или ферменты–протеины | (ацетил КоА, лактат ДГ и т.д.) или ферменты–протеиды |
В ферментах-протеидах белковая часть называется апоферментом, а небелковая – простетической группой. Общее название сложных ферментов – холофермент.
Если простетическая группа слабо связана с белковой частью и легко диссоциирует, она называется коферментом. Кофермент может соединяться с разными белками, и именно белковая часть определяет специфичность действия сложных ферментов. Вместе с тем, без кофермента сложный фермент не может функционировать, так как кофермент, как правило, непосредственно контактирует с субстратом (S) и служит в качестве переносчика ē, атомов или группы атомов.
Кофакторы, или коферменты это:
1) ионы Me – Mg 2+ , Ca 2+ , Cu 2+ , Mn 2+ b lh/$
2) витамины и их фосфорные эфиры – витамин Н (биотин)(в составе коферментов карбоксилирования), липоевая, фолиевая кислоты, В1 и др.;
3) мононуклеотиды ФМН, АТФ, ГТФ и т.д.;
4) большая часть коферментов – это динуклеотиды НАД, НАДФ, HS-KoA и др.
При гиповитаминозах и авитаминозах недостаток витаминов ослабляет биосинтез многих ферментов и вызывает гипокоферментоз. Коферменты выполняют также важную роль в стабилизации и охране апоферментов. Последние без коферментов скорее разрушаются протеолитическими ферментами.
Таким образом, сами по себе ни коферменты, ни апоферменты каталитической активностью не обладают, а только в комплексе друг с другом.
Молекулы S-в чаще всего имеют небольшие размеры по сравнению с молекулами ферментов, поэтому при образовании Е-S-го комплекса в контакт с S вступает ограниченная часть аминокислот ППЦ, которая называется активным центром (АЦФ). У Е-протеидов в состав АЦФ входят также и простетические группы.
Таким образом, активный центр фермента – это уникальная комбинация аминокислотных остатков, обеспечивающих непосредственное взаимодействие Е и S и прямое участие в акте катализа.
Аллостерические центры ферментов.
Кроме АЦФ, у ферментов имеются и аллостерические ( греч. allos – другой) или инопространственные центры. Это место воздействия на ферменты разных регуляторных факторов. Взаимосвязь между АЦФ и АЛЦФ называется аллостерическими взаимодействиями. Важная особенность АЛЦФ – их более высокая по сравнению с АЦФ чувствительность к различным воздействиям.
Например, при повышении температуры и применении рН раньше затормаживается функция АЛЦФ. В частности, при повышении температуры аллостерический центр гексокиназы теряет чувствительность к регуляторному воздействию инсулина и глюкокортикоидов, а функциональная активность ферментов сохраняется и продолжает фосфорилировать глюкозу за счет АТФ.

Регуляторное воздействие на аллостерический центр оказывают: различные метаболиты ферментативных реакций, гормоны и продукты их обмена, медиаторы НС и т.д. Они называются эффекторами или модификаторами. Их молекулы не сходны с молекулами S-в.
Связываясь с аллостерическим центром, эффекторы изменяют ТС и ЧС ферментов, тем самым изменяют конфигурацию АЦФ, что приводит к повышению (активированию) или понижению (ингибированию) ферментативной активности.
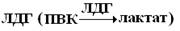
Изоферменты – это молекулярные формы ферментов, возникающие вследствие генетических различий в ПС ферментного белка. Это группа ферментов, которые присутствуют внутри одного вида (ЛДГ) или внутри одной клетки (аминотрансферазы), имеют одинаковый механизм действия, но отличаются по некоторым физико-химическим свойствам: электрофоретической подвижности, иммунобиологическим реакциям. Например, существует в виде пяти изоферментов. Хотя они катализируют одну и ту же реакцию, отличаются по своей Кт. У них одинаковая Mr (134.000) и по 4 ППЦ с Mr 33.500. Пять изоферментов соответствую пяти различным комбинациям двух разных типов ППЦ, названных M – (muscle) и H– (heart) цепями. Изофермент М4 – находится в мышечной ткани, содержит идентичные 4М-цепи; Н4 – находится в сердце, содержит идентичные 4Н-цепи. Остальные три изофермента – это различные сочетания М3Н; М2Н2; МН3. Два типа цепей – М и Н, кодируются двумя различными генами, сочетание ППЦ находится под генетическим контролем. Наличие изоферментов и изменение их соотношения в организме – один из способов регуляции ферментов.
Современная классификация ферментов и их номенклатура
Согласно классификации, разработанной Международной комиссией по ферментам (1961г.) все ферменты делят на шесть классов. Классы делятся на подклассы, а последние – на подподклассы, внутри которых ферменту присваивается свой порядковый номер. Например, ЛДГ имеет шифр. 1.1.1.27. 1- название класса – оксидоредуктазы – указывает тип ферментной реакции; 2-я цифра показывает номер подкласса; подкласс уточняет действие фермента, так как указывает в общих чертах на природу химической группы S. Подподкласс – уточняет природу атакуемой химической связи S или природу акцептора. № 27 – порядковый № ЛДГ в подподклассе.
1) Оксидоредуктазы – катализируют реакции окисления-восстановления – содержат 17 подклассов и ~ 480 Е. Например: ЛДГ.
2) Трансферазы – катализируют реакции переноса различных групп от одного S (донор) к другому (акцептор). 8 подклассов в зависимости от вида переносимых групп и ~ 500 Е. Например: фермент холинацетилтрансфераза – катализирует перенос остатка уксусной кислоты на холин ® ацетилхолин.
3) Гидролазы – катализируют разрыв связей в S с присоединением воды. Содержат 11 подклассов и ~ 460 Е. К гидролазам относятся пищеварительные ферменты, а также ферменты, входящие в состав лизосом и других органоидов клетки, где они способствуют распаду крупных молекул на более мелкие.
4) Лиазы – катализируют реакции разрыва связей в S без присоединения воды или окисления. Содержат 4 подкласса и ~ 230 Е – участвуют в промежуточных реакциях синтеза (синтазы) или распада (дегидратазы).
5) Изомеразы – катализируют превращение изомеров друг в друга. От типа реакции изомеризации – различают мутазы (рацемазы). Содержат 5 подклассов и ~ 80 Е.
6) Лигазы (синтетазы) – катализируют реакции соединения двух молекул S с использованием Е фосфатных связей. Источником ферментов является АТФ и др. Содержат 5 подклассов, ~ 80 Е (например, гексокиназа, фосфофруктокиназа).
Номенклатура ферментов.
Существует два типа названий ферментов:
1) рабочее, или тривиальное;
Рабочее название – название S + тип реакции + окончание аза. Лактат + реакция дегидрогенизации + аза ®ЛДГ.
Для некоторых ферментов оставлены их рабочие названия: пепсин, трипсин и т.д.
Систематическое название – название обоих S + тип реакции + аза.
a-Лактат (S1): НАД + (S2) – оксидоредуктаза.
Систематическое название дается только тем ферментам, структура которых полностью изучена. В одной клетке находится ~ 10 4 молекул ферментов, катализируется ~ 2000 разных реакций. В настоящее время известно около 1800 ферментов, в кристаллическом виде получено ~ 150 ферментов.
Опасности нашей повседневной жизни: Опасность — возможность возникновения обстоятельств, при которых.
Роль химии в жизни человека: Химия как компонент культуры наполняет содержанием ряд фундаментальных представлений о.

Стремительное открытие огромного числа энзимов (на сегодняшний день известно более 3 тысяч) вызвало необходимость их систематизировать, однако долгое время единый подход к этому вопросу отсутствовал. Современная номенклатура и классификация ферментов была разработана комиссией по ферментам международного биохимического союза и одобрена на пятом Всемирном биохимическом конгрессе в 1961 году.
Общая характеристика ферментов
Ферменты (иначе энзимы) — это уникальные биологические катализаторы, обеспечивающие осуществление огромного количества биохимических реакций, протекающих в клетке. Притом последние протекают в миллионы раз быстрее, чем могло происходить без участия энзимов. Каждый фермент имеет активный центр, предназначенный для связывания с субстратом.
Номенклатура и классификация ферментов в биохимии тесно связаны, поскольку название каждого энзима строится на основании его группы, вида субстрата и типа катализируемой химической реакции. Исключение составляет тривиальная номенклатура, которая базируется на исторических названиях и охватывает сравнительно небольшую часть ферментов.
Классификация энзимов
Современная классификация ферментов базируется на характеристике катализируемых химических реакций. На этом основании выделено 6 основных групп (классов) энзимов:
- Оксидоредуктазы осуществляют реакции окислительно-восстановительного характера, ответственны за перенос протонов и электронов. Реакции проходят по схеме А восстановлен + В окислен = А окислен + В восстановлен, где исходные вещества А и В являются субстратами фермента.
- Трасферазы катализируют межмолекулярный перенос химических групп (кроме атома водорода) с одного субстрата на другой (A-X + B = A + BX).
- Гидролазы ответственны за расщепление (гидролиз) внутримолекулярных химических связей, образованных с участием воды.
- Лиазы отщепляют от субстрата химические группы по негидролитическому механизму (без участия воды) с формированием двойных связей.
- Изомеразы осуществляют межизомерные превращения.
- Лигазы катализируют соединение двух молекул, которое сопряжено с разрушением макроэргических связей (например, АТФ).
В свою очередь, каждая из этих групп дополнительно делится на подклассы (от 4 до 13) и подподклассы, более конкретно описывающие разные типы химических превращений, осуществляемых ферментами. Здесь учитываются множество параметров, включая:
- донор и акцептор преобразуемых химических групп;
- химическую природу субстрата;
- участие в каталитической реакции дополнительных молекул.
Каждому классу соответствует закрепленный за ним порядковый номер, который используется в цифровом шифре ферментов.
Оксидоредуктазы
Деление оксидоредуктаз на подклассы происходит по донору окислительно-восстановительной реакции, а на подподклассы — по акцептору. К основным группам данного класса относят:
- Дегидрогеназы (иначе редуктазы или анаэробные дегидрогеназы) — наиболее распространенный вид оскидоредуктаз. Эти энзимы ускоряют реакции дегидрирования (отщепления атома водорода). В роли акцептора могут выступать различные соединения (NAD+, FMN и т.д.).
- оксидазы (аэробные дегидрогеназы) — в качестве акцептора выступает кислород;
- оксигеназы (гидроксилазы) — присоединяют один из атомов молекулы кислорода к субстрату.
Коферментом более половины оксидоредуктаз является соединение НАД+.
Трансферазы
Данный класс насчитывает около пятисот ферментов, которые подразделяют в зависимости от вида переносимых групп. На этом основании выделены такие подклассы, как фосфотрансферазы (перенос остатков фосфорной кислоты), ацилтрансферазы (перенос ацилов), аминотрансферазы (реакции переаминирования), гликозилтрансферазы (перенос гликозильных остатков), метилтрансферазы (транспортирование одноуглеродных остатков) и др.
Гидролазы
Гидролазы делятся на подклассы по характеру субстрата. Наиболее важными из них являются:
- эстеразы - ответственны за расщепление сложных эфиров;
- гликозидазы - гидролизируют гликозиды (включая углеводы);
- пептид-гидролазы - разрушают пептидные связи;
- ферменты, расщепляющие непептидные C-N-связи
В групппу гидролаз входит около 500 ферментов.
Лиазы
Негидролитическому отщеплению под действием лиаз могут подвергаться многие группы, включая CO2, NH2, H2O, SH2 и др. При этом происходит распад молекул по связям С-О, С-С, C-N и т.д. Одним из важнейших подклассов данной группы являются улерод-углерод-лиазы.
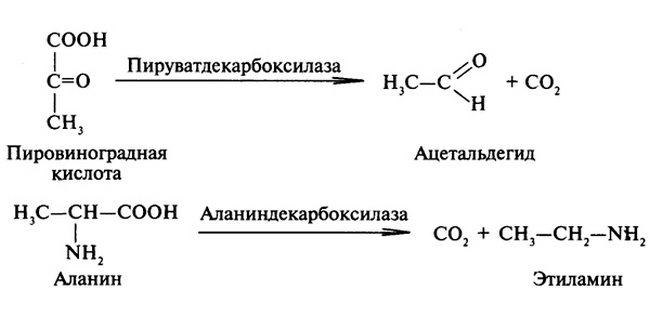
Некоторые реакции отщепления являются обратимыми. В таких случаях при определенных условиях лиазы могут катализировать не только распад, но и синтез.
Лигазы
Все лигазы подразделяются на две группы в зависимости от того, какое соединение дает энергию для образования ковалентной связи. Ферменты, использующие нуклеозидтрифосфаты (АТФ, ГТФ и т.д.), называют синтетазами. Лигазы, действие которых сопряжено с другими макроэргическими соединениями, именуют синтазами.
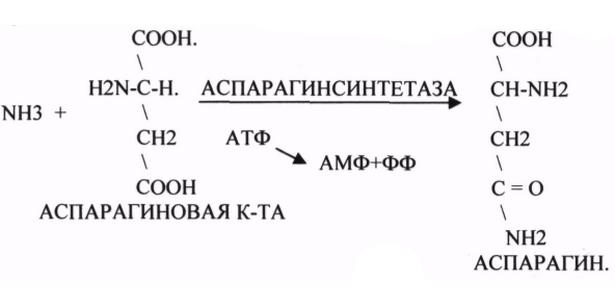
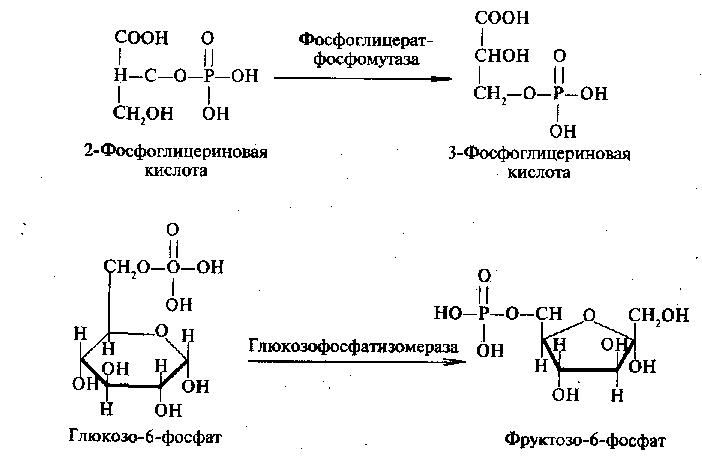
Изомеразы
Данный класс сравнительно немногочислен и включает около 90 ферментов, которые вызывают геометрические или структурные перестроения в молекуле субстрата. К важнейшим ферментам данной группы относят триозофосфатизомеразу, фосфоглицерат-фосфомутазу, альдозомутаротазу и изопентенил-пирофосфатизомеразу.
Классификационный номер фермента
Введение в биохимию ферментов номенклатуры кодового характера было осуществлено в 1972 году. Согласно этому нововведению каждый энзим получил классификационный шифр.
Индивидуальный номер фермента состоит из 4 цифр, первая из которых обозначает класс, вторая и третья — подкласс и подподкласс. Конечная цифра соответствует порядковому номеру конкретного энзима в подподклассе согласно алфавитному порядку. Числа шифра отделены друг от друга цифрами. В международном списке ферментов классификационный номер указывается в первой колонке таблицы.
Принципы номенклатуры ферментов
В настоящее время существует три подхода к формированию названий ферментов. В соответствии с ними выделяют следующие типы номенклатуры:
- тривиальная (самая старая система);
- рабочая — удобна в употреблении, очень часто используется в учебной литературе;
- систематическая (или научная) — наиболее подробно и точно характеризует механизм действия фермента, но слишком сложна для повседневного употребления.
Систематическая и рабочая номенклатуры ферментов имеют общую черту, которая заключается в присоединении к концу любого названия суффикса "аза". Последний является своего рода "визитной карточкой" энзимов, выделяющей их из ряда других групп биологических соединений.
Существует еще одна система составления наименований, основанная на строении фермента. Номенклатура в таком случае делает акцент не на тип химической реакции, а на пространственную структуру молекулы.

Кроме собственно названия частью номенклатуры энзимов является их индексация, согласно которой каждому энзиму соответствует свой классификационный номер. В базах данных ферментов обычно указываются их шифр, рабочее и научное названия, а также схема химической реакции.
Современные принципы построения номенклатуры ферментов основаны на трех характеристиках:
- особенности осуществляемой энзимом химической реакции;
- класс фермента;
- субстрат, к которому применяется каталитическая активность.
Особенности раскрытия этих пунктов зависят от типа номенклатуры (рабочая или систематическая) и подкласса фермента, к которому они применяются.
Тривиальная номенклатура
Тривиальная номенклатура ферментов появилась в самом начале развития энзимологии. В то время названия энзимам давали первооткрыватели. Поэтому данная номенклатура иначе называется исторической.
В основе тривиальных названий лежат произвольные признаки, связанные с особенностью действия фермента, но в них не содержится сведений о субстрате и типе химических реакций. Такие названия значительно короче рабочих и систематических.
Тривиальные наименования обычно отражают какую-то особенность действия фермента. Например, название энзима "лизоцим" отражает способность данного белка лизировать бактериальные клетки.
Классическими примерами тривиальной номенклатуры являются пепсин, трипсин, ренин, хемотрипсин, тромбин и другие.
Рациональная номенклатура
Рациональная номенклатура ферментов стала первым шагом к разработке единого принципа формирования названий энзимов. Она была разработана в 1898 году Е. Дюкло и базировалась на комбинировании названия субстрата с суффиксом "аза".
Так, фермент, катализирующий гидролиз мочевины, именовался уреазой, расщепляющий жиры — липазой и т. д.
Названия холоферментов (молекулярных комплексов белковой части сложных энзимов с кофактором) строились на основании природы кофермента.
Рабочая номенклатура
Получила такое название за удобство в повседневном использовании, так как содержит основную информацию о механизме действия энзима при сохранении относительной краткости наименований.
Рабочая номенклатура ферментов основана на сочетании химической природы субстрата с типом катализируемой реакции (ДНК-лигаза, лактатдегидрогеназа, фосфоглюкомутаза, аденилатциклаза, РНК-полимераза).
Иногда в качестве рабочих названий используют рациональные наименования (уреаза, нуклеаза) или сокращенные систематические. Например, сложное составное название "пептидил-пролил-цис-транс-изомераза" заменяется на упрощенное "пептидилпролилизомераза" с более коротким и слитным написанием.
Систематическая номенклатура ферментов
Так же как и рабочая, основана на характеристике субстрата и химической реакции, однако данные параметры раскрываются гораздо точнее и подробнее, с указанием таких вещей, как:
- вещество, выступающее в качестве субстрата;
- природа донора и акцептора;
- название подкласса фермента;
- описание сути химической реакции.
Последний пункт подразумевает уточняющую информацию (природа переносимой группы, тип изомеризации и т. д.).
Не для всех энзимов указывается полный набор вышеперечисленных характеристик. Каждому классу ферментов соответствует своя формула составления систематических названий.
- При превращении из цис-формы в транс-форму — "субстрат-цис-транс-изомераза".
- При преращении альдегидной формы в кетонную — "субстрат-альдегид-кетон-изомераза".
Если в ходе реакции осуществляется внутримолекулярный перенос химической группы, фермент называют мутазой. Другими возможными окончаниями наименований могут быть "эстераза" и "эпимераза" (в зависимости от подкласса фермента)
- Трансретиналь--11 цис-транс-изомераза;
- D-глицеральдегид-3-фосфокетон-изомераза
Иногда в систематическом названии фермента содержится уточняющая информация, которую заключают в скобки. Например, энзиму, катализирующему окислительно-восстановительную реакцию L-малат + НАД + = пируват + СО2 + НАДН, соответствует наименование L-малат: НАД + -оксидоредуктаза (декарбоксилирующая).
Шифр КФ (Классификация ферментов) или код фермента — это классификационный номер фермента по международной иерархической классификации. Принятая система классифицирует ферменты по группам и индексирует индивидуальные ферменты, что важно для стандартизации исследований.
Содержание
Принцип классификации
Классификация ферментов учитывает реакционную и субстратную специфичности ферментов, а не их белковую структуру. Шифр КФ определяет химическую реакцию, катализируемую ферментом. По этой причине аналогичные ферменты (иногда десятки) из различных организмов имеют один КФ, несмотря на структурные различия.
Иногда различные ферменты одного организма имеют один КФ. Например, панкреатическая липаза и печёночная липаза принадлежат обе к КФ 3.1.1.3 благодаря катализированию одной химической реакции (гидролиз эфирной связи в триглицериде), хотя первый фермент является ферментом пищеварения и работает в кишечнике, а второй относится к ферментам обмена липопротеинов в крови.
Существует база данных UniProt [1] , которая идентифицирует каждый белок по его первичной последовательности. Обе базы данных дополняют друг друга.
Формат шифра
Каждый классификационный номер содержит сокращение КФ и последовательность из четырёх чисел, разделённых точкой, и составляется по определенному принципу. Каждое последующее число представляет собой всё более и более уточняющую классификацию фермента. Так как база данных постоянно обновляется коды могут меняться и некоторые коды могут оставаться незаполненными.
Класс
- Код первого уровня (первое число, может быть от 1 до 6) указывает номер одного из шести главных классов ферментов (см. таблицу Коды первого уровня).
Подкласс
- Код второго уровня (второе число) означает подкласс, характеризующий основные виды субстратов, участвующих в данном типе химических реакций. Например, у трансфераз вторая цифра указывает на природу той группы, которая подвергается переносу, у гидролаз — на тип гидролизуемой связи и т. д.
Под-подкласс
- Код третьего уровня (третье число) определяет более частные подгруппы (под-подклассы), отличающиеся природой химических соединений доноров или акцепторов, участвующих в данной подгруппе реакций. У гидролаз, например, эта цифра уточняет тип гидролизуемой связи, а у лиаз — тип отщепляемой группы и т. д. Первые 3 числа шифра точно определяют тип фермента.
Код четвертого уровня
Наконец, все ферменты, относящиеся к данному под-подклассу, получают свой порядковый номер (четвёртое число в шифре).
Коды первого уровня
| Класс | Катализируемая реакция | Тип реакции | Важнейшие подклассы |
|---|---|---|---|
| КФ 1 Оксидоредуктазы | Окислительно-восстановительные реакции. Перенос атомов H и O или электронов от одного субстрата на другой | AH + B → A + BH (восстановленный) A + O → AO (окисленный) | дегидрогеназа, оксидаза, пероксидаза, редуктаза, монооксидаза, диоксигеназа |
| КФ 2 Трансферазы | Перенос функциональной группы от одного субстрата на другой. Это может быть метильная, ацильная, фосфатная группа или аминогруппа. | AB + C → A + BC | аминотрансфераза, фосфотрансфераза, C1-трансфераза, гликозилтрансфераза |
| КФ 3 Гидролазы | Образование двух продуктов из одного субстрата в результате гидролиза. | AB + H2O → AOH + BH | эстераза, гликозил-гидролаза, пептидаза, амидаза |
| КФ 4 Лиазы (синтазы) | Негидролитическое добавление или удаление группы к или от субстрата. Образование C-C, C-N, C-O или C-S связи. | RCOCOOH → RCOH + CO2 | C-O-лиаза, C-S-лиаза, C-N-лиаза, C-C-лиаза |
| КФ 5 Изомеразы | Внутримолекулярная перестановка, то есть изомеризация молекулы субстрата. | AB → BA | эпимераза, цис-транс-изомераза, внутримолекулярная оксидоредуктаза и др. |
| КФ 6 Лигазы (синтетазы) | Соединение двух молекул в результате синтеза новой C-O, C-S, C-N или C-C связи, сопряжённое с одновременным гидролизом АТФ. | X + Y+ ATP → XY + ADP + Pi | C-O-лигаза, C-S-лигаза, C-N-лигаза, C-C-лигаза |
История
Схема номенклатуры ферментов была впервые разработана в 1955 году, когда Международный конгресс биохимии в Брюсселе учредил Комиссию по ферментам (Enzyme Commission). Первая версия номенклатуры появилась в 1961 году и включала около 900 ферментов, в версии 1978 года было более 2000 ферментов. Версия 1995 года содержит более 3500 ферментов.
Ссылки
См.также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Классификация ферментов" в других словарях:
классификация ферментов — КФ Международная четырехзначная номенклатура ферментов: 1 й знак класс ферментов (1 оксиредуктазы; 2 трансферазы; 3 гидролазы; 4 лиазы; 5 изомеразы; 6 лигазы); 2 й и 3 й знаки подклассы и подподклассы ферментов; 4 й знак порядковый номер в… … Справочник технического переводчика
классификация ферментов — Enzyme Classification (EC) классификация ферментов (КФ). Международная четырехзначная номенклатура ферментов: 1 й знак класс ферментов (1 оксиредуктазы; 2 трансферазы; 3 гидролазы; 4 лиазы; 5 изомеразы; 6 лигазы); 2 й и 3 й знаки подклассы и… … Молекулярная биология и генетика. Толковый словарь.
Международная классификация ферментов — Шифр КФ (Классификация ферментов) или код фермента это классификационный номер фермента по международной иерархической классификации. Принятая система классифицирует ферменты по группам и индексирует индивидуальные ферменты, что важно для… … Википедия
Классификация аэробных спорообразующих бактерий — По современным представлениям, аэробные спорообразующие бактерии, или бациллы, объединяются в отдельный род Bacillus семейства Bacillaceae. Этот род, включающий много разнообразных видов, имеет ряд характерных особенностей и отличается от … Биологическая энциклопедия
Классификация сахарного диабета — Это статья о сахарном диабете. См. также несахарный диабет. Сахарный диабет. Символ, утвержденный ООН для обозначения диабета. МКБ 10 E1 … Википедия
НЕДОСТАТОЧНОСТЬ ФЕРМЕНТОВ — мед. Синдромы врождённых нарушений обмена веществ встречаются редко, но оказывают значительное влияние на физическое, интеллектуальное, психическое развитие и качество жизни (например, фенилкетонурия, гомоцистинурия, гликогенозы, синдромы ломкой… … Справочник по болезням
Ферменты — Модель фермента нуклеозидфосфорилазы Ферменты, или энзимы (от лат. f … Википедия
Биокатализаторы — Модель фермента нуклеозид фосфорилазы Ферменты или энзимы (от лат. fermentum, греч. ζύμη, ἔνζυμον дрожжи, закваска) обычно белковые молекулы или молекулы РНК или их комплексы, ускоряющие (катализирую … Википедия
Фермент — Модель фермента нуклеозид фосфорилазы Ферменты или энзимы (от лат. fermentum, греч. ζύμη, ἔνζυμον дрожжи, закваска) обычно белковые молекулы или молекулы РНК или их комплексы, ускоряющие (катализирую … Википедия
Ферментативный — Модель фермента нуклеозид фосфорилазы Ферменты или энзимы (от лат. fermentum, греч. ζύμη, ἔνζυμον дрожжи, закваска) обычно белковые молекулы или молекулы РНК или их комплексы, ускоряющие (катализирую … Википедия
Читайте также:
- Как влияет увеличение температуры компенсации на критический размер скопления
- Отдел организации дознания чем занимается
- Как соцзащита проверяет алименты
- Какое наказание по законам хаммурапи полагалось рабу за оскорбление свободного человека
- Каким образом получают азот растения и животные раскройте роль бобовых растений в обеспечении

