Болезнь кушинга передается ли по наследству
Обновлено: 02.07.2024
Для цитирования: Древаль А.В. Синдром Иценко – Кушинга (лекция). РМЖ. Медицинское обозрение. 2016;24(1):2-5.
Лекция посвящена внегипофизарным болезням, вызывающим гиперсекрецию глюкокортикоидов надпочечниками
Для цитирования. Древаль А.В. Синдром Иценко – Кушинга (лекция) // РМЖ. 2016. No 1. С. 2–5.
Клинический синдром, который развивается вследствие повышенного содержания глюкокортикоидов в крови, называют синдромом Иценко – Кушинга.
Эндогенный синдром Иценко – Кушинга развивается при аденоме или карциноме коры надпочечников, а также на фоне гиперпродукции адренокортикотропного гормона (АКТГ) опухолью гипофиза или АКТГ-секретирующей опухолью, локализованной вне гипофиза (эктопический АКТГ-синдром), и очень редко при эктопической секреции опухолью кортикотропин-рилизинг-гормона (КРГ).
Ятрогенный (экзогенный) синдром Иценко – Кушинга — частое осложнение терапии глюкокортикоидами, когда их используют как противовоспалительные или иммуносупрессивные средства.
Перечень патологических состояний, при которых продукция глюкокортикоидов повышена, представлен в таблице 1. Следует заметить, что кроме указанных в таблице болезней описан и ряд очень редких генетически детерминированных заболеваний, при которых развивается синдром Иценко – Кушинга.
В данной лекции рассмотрим внегипофизарные болезни, вызывающие гиперсекрецию глюкокортикоидов надпочечниками.
Доброкачественная адренокортикальная аденома
Доброкачественная адренокортикальная аденома обычно инкапсулирована, ее размер – менее 4 см в диаметре. Чаще всего она секретирует только глюкокортикоиды.
Лечение хирургическое — односторонняя адренал-эктомия, которую обычно выполняют лапароскопически. В послеоперационном периоде может развиваться надпочечниковая недостаточность. Это следствие атрофии неудаленного надпочечника из-за подавленной секреции АКТГ на фоне гиперпродукции кортизола аденомой. Длительность заместительной терапии глюкокортикоидами может составлять 2 года.
Прогноз после операции благоприятный, вероятность рецидива низкая.
Адренокортикальная карцинома
Адренокортикальная карцинома обычно более 6 см в диаметре, хотя бывают опухоли и меньшего размера. Нередко на момент выявления обнаруживают локальную инвазию опухоли, возможны метастазы. Чаще всего злокачественная опухоль продуцирует несколько гормонов. Наиболее типичная комбинация — кортизол и андрогены (предшественники), реже – минералокортикоиды или эстрогены.
Лечение карциномы надпочечников необходимо проводить в специализированных центрах, где есть хирурги, онкологи и эндокринологи, имеющие достаточный опыт лечения такого рода больных.
Главным методом лечения служит хирургическое удаление опухоли. После операции может понадобиться заместительная терапия. В случае неполного удаления опухоли и/или метастазов назначают препараты, подавляющие секрецию глюкокортикоидов (метирапон, кетоконазол и др.).
Прогноз неблагоприятный. Несмотря на оперативное лечение, 5-летняя выживаемость составляет 22%, а медиана выживаемости — 14 мес. Если больной получает лечение в специализированных центрах, показатели выживаемости оказываются лучше вследствие комплексного лечения, назначаемого онкологами и эндокринологами.
Синдром Иценко – Кушинга, вызванный эктопическим синтезом АКТГ (эктопический АКТГ-синдром)
Эктопический АКТГ-синдром вызывается в 50% случаев злокачественной мелкоклеточной опухолью легкого. Этот синдром может быть и проявлением нейроэндокринных опухолей, которые локализованы в тимусе (15%), поджелудочной железе (10%) или бронхе (10%). Эктопическая продукция КРГ встречается крайне редко.
Отличительные особенности эктопического АКТГ-синдрома:
•Очень высокий уровень кортизола.
•Доминируют клинические проявления артериальной гипертензии, гипокалиемии и метаболического алкалоза, что обусловлено стимуляцией минералокортикоидных рецепторов высоким уровнем кортизола.
•Нет абдоминального ожирения, если злокачественная опухоль быстро прогрессирует, вызывая кахексию.
•Наблюдаются другие симптомы гиперкортизолизма, в частности нарушение толерантности к глюкозе, склонность к инфекциям, тонкая кожа, плохое заживление ран, психические нарушения и др.
•Возможна выраженная гиперпигментация вследствие совместной с АКТГ гиперпродукции проопиомеланокортина, обладающего биологической активностью меланоцит-стимулирующего гормона.
•Уровень АКТГ может быть очень высоким (обычно более 100 пг/мл).
•В 90% случаев в большом дексаметазоновом тесте (2 мг 4 р./сут) содержание кортизола не снижается более чем на 50% от базального уровня, т. к. в опухоли нарушен механизм саморегуляции секреции АКТГ.
•В случае нейроэндокринной опухоли клиническая картина и результаты диагностических тестов могут быть неотличимы от таковых при болезни Иценко – Кушинга (гиперпродукции АКТГ гипофизом), что требует для дифференциальной диагностики проведения селективного забора крови на АКТГ, оттекающей от гипофиза.
•У некоторых больных, несмотря на выраженную клиническую картину гиперкортизолизма, опухоль может быть очень небольших размеров (несколько миллиметров в диаметре), что делает невозможной ее локализацию. В этом случае назначают консервативное лечение гиперкортизолизма, а при очень выраженной клинической картине проводят двустороннюю адренал-эктомию. После устранения симптомов гиперкортизолизма у больного регулярно исследуют потенциально наиболее вероятные зоны локализации опухоли до тех пор, пока она не станет очевидной — тогда ее удаляют.
Лечение заключается в удалении АКТГ-продуцирующей опухоли, где это возможно. В противном случае назначаются препараты, блокирующие продукцию глюкокортикоидов (кетоконазол, например). Если удалить опухоль по тем или иным причинам невозможно, а общее тяжелое состояние больного определяется только гиперкортизолизмом, который трудно контролируется, удаляют надпочечники.
АКТГ-независимая двусторонняя макронодулярная гиперплазия надпочечников
Это редкий эктопический синдром Иценко – Кушинга, который чаще бывает спорадическим, реже – семейным. Наиболее частая причина — эктопический синтез в надпочечниках рецепторов гастроинтестинального полипептида. Секреция этого полипептида клетками желудочно-кишечного тракта повышается после приема пищи, что стимулирует секрецию глюкокортикоидов в надпочечниках, т. е. развивается связанный с приемом пищи гиперкортизолизм. Могут эктопически синтезироваться в надпочечниках и другие рецепторы — к лютеинизирующему гормону или β-адренергические.
Комплекс Карнея
– участки пигментации кожи;
– миксомы сердца, кожи или мукозные;
– чаще всего первичная пигментная узловая гиперплазия надпочечников (может быть как микро-, так и макроузловая), сопровождаемая гиперпродукцией глюкокортикоидов (синдром Иценко – Кушинга);
– СТГ/пролактин-секретирующая опухоль гипофиза, а также гиперплазия соматотрофов/пролактотрофов;
– аденома щитовидной железы;
– псаммоматозная меланотическая шваннома.
Синдром Мак-Кьюна – Олбрайта
Редкая болезнь (частота от 1:100 000 до 1:1000000), генетически обусловленная, но не наследственная, т. к. возникает вследствие постзиготной соматической мутации, что проявляется мозаицизмом. Возможна генетическая диагностика мутации, выявляемой в пораженных тканях или клетках крови.
Диагноз устанавливают, если присутствуют 2 из 3нижеперечисленных признаков.
– появление кист в костях нижних и верхних конечностей, таза, грудной клетки, с чем связаны самопроизвольные переломы с вовлечением нервных стволов и появлением на месте перелома очагов гипертрофии костей;
– чаще всего страдают бедренная кость и кости таза, и эту особенность можно использовать для скрининговой диагностики болезни;
– остеосаркома возникает редко;
– поражение костей проявляется обычно до 10-летнего возраста.
•Пигментация отдельных участков кожи:
– появляются бурые пятна на задней поверхности шеи, спине, в области поясницы и бедер величиной от маленькой родинки до больших пятен;
– контуры пигментации неровные, не пересекают средней линии тела;
– локализованы обычно на стороне поражения костей;
– степень пигментации часто соответствует величине поражения скелета.
– синдром Иценко – Кушинга (гиперплазия надпочечников или аденома);
– преждевременное половое созревание;
– узлы в щитовидной железе;
– СТГ-секретирующая опухоль гипофиза и пролактинома;
Кроме указанных выше диагностически значимых поражений, также возможны:
– кардиомегалия, тахиаритмия, внезапная кардиальная смерть;
– поражение гепатобилиарной системы;
– микроцефалия, задержка психического развития.
Субклинический синдром Иценко – Кушинга
Дать определение субклинического синдрома Иценко – Кушинга несложно: патологическое состояние, при котором, несмотря на повышенную секрецию кортизола, нет характерного (специфического) симптомокомплекса (стрии, центрипетальное ожирение, лунообразное лицо, плетора и др.). Однако это определение не годится для реальной практической работы клинициста-эндокринолога, т. к. оно неконструктивно, т. е. нет явных указаний, в каких клинических ситуациях следует использовать это понятие как диагноз. В связи с этим уточним определение. Сначала ответим на вопрос, который возникает в первую очередь: какие диагностические тесты и алгоритмы следует использовать для диагностики субклинического гиперкортицизма? Ответ: те же, что и для диагностики манифестного гиперкортицизма! При этом эти тесты обычно разбиваются на 2группы: скрининговые (предварительные) и верифицирующие (позволяющие с более высокой надежностью установить диагноз гиперкортизолизма, чем скрининговые).
К скрининговым (стартовым) диагностическим тестам чаще всего относят следующие:
– исследование кортизола в суточной моче (проводится двукратно для верификации гиперкортизолизма, если не сочетается с другим тестом);
– малый ночной (1 мг) дексаметазоновый тест (проводится однократно);
– кортизол слюны в полночь (проводится двукратно, если не сочетается с другим тестом);
В этом случае диагноз субклинического гиперкортизолизма сохраняется до тех пор, пока не будут получены результаты верифицирующих тестов. Если и с их помощью диагноз эндогенного гиперкортизолизма подтверждается, тогда диагноз субклинического синдрома Иценко – Кушинга считают доказанным.
В результате дополнительного обследования у части больных в этих тестах диагноз гиперкортизолизма может не подтвердиться, тогда диагноз субклинического гиперкортизолизма пересматривают, и скрининговые (стартовые) тесты интерпретируют с точки зрения неэндокринной патологии. К примеру, лабораторная ошибка, связанная с недостаточной надежностью скрининговых тестов, или наличие у больного депрессии, при которой секреция кортизола в дексаметазоновом тесте часто не подавляется, и т. п. Очевидно, что в этих случаях ранее поставленный предположительный диагноз субклинического гиперкортизолизма снимают.
Выше был представлен алгоритм обследования больного на субклинический гиперкортизолизм в клинической практике, где ключевым или стартовым поводом для обследования была выявленная инциденталома надпочечника.
Вместе с тем в научных исследованиях может быть поставлена задача выявления субклинического гиперкортицизма в других, кроме пациентов с инциденталомой, группах риска, например среди больных сахарным диабетом, который с высокой частотой сопровождает гиперкортизолизм. В этом случае именно сахарный диабет становится поводом для начала обследования на гиперкортизолизм, и точно так же, как в случае инциденталом, стартовый набор тестов, в котором дифференцируется истинный гиперкортизолизм от функционального, остается тем же. Следует заметить, что при таком подходе появляется возможность выявления не только АКТГ-независимого варианта субклинического синдрома Иценко – Кушинга, но и АКТГ-зависимого, т. е. спектр субклинических синдромов Иценко – Кушинга расширяется. Следовательно, в отличие от случая инциденталом, после подтверждения истинного гиперкортизолизма далее следует уточнять локализацию процесса путем визуализации надпочечников (синдром Иценко – Кушинга) и исследования АКТГ в крови (дифференциальная диагностика АКТГ-зависимого и АКТГ-независимого синдрома Иценко – Кушинга).
Дифференциальная диагностика синдрома Иценко – Кушинга
Первый этап диагностического поиска
Заключается в диагностировании эндогенного гиперкортизолизма. Однако следует заметить, что до сих пор общепринятого набора тестов для диагностики гипекортизолизма нет, и в разных клинических центрах он может существенно различаться. В таблице 2 приведены перечень тестов, которые используют для скрининга при подозрении на синдром Иценко – Кушинга, и их диагностическая значимость.
Второй этап диагностического поиска
К нему приступают после того, как диагностирован эндогенный гиперкортизолизм (синдром Иценко – Кушинга). Этот этап заключается в поиске причины гиперпродукции кортизола надпочечниками, а фактически в определении локализации патологического процесса, с которым связана гиперсекреция кортизола. С одной стороны, очевидно, что только надпочечник может продуцировать кортизол. С другой стороны, синтез кортизола надпочечниками управляется АКТГ, который может вырабатываться как в гипофизе, так и вне его (эктопически). В итоге получаем три точки возможной локализации: надпочечник (опухоль и/или гиперплазия), гипофиз (аденома) или эктопическая секреция опухолью (обычно легкие), что и составляет предмет дифференциальной диагностики второго этапа. Тесты для определения АКТГ-зависимого гиперкортизолизма представлены в таблице 3.
•У больных с подтвержденным на первом этапе диагностики синдромом Иценко – Кушинга определяют базальный уровень АКТГ в сыворотке крови, чтобы с помощью этого исследования дифференцировать АКТГ-зависимый синдром Иценко – Кушинга (уровень АКТГ повышен) от АКТГ-независимого (содержание АКТГ снижено). Уровень АКТГ >4 пмоль/л — показатель АКТГ-зависимого синдрома Иценко – Кушинга.
•По уровню АКТГ дифференцировать гипофизарную гиперсекрецию АКТГ от эктопической практически невозможно, хотя при эктопической секреции содержание АКТГ несколько выше.
Надпочечники – парные эндокринные железы, расположенные на вершине обеих почек. Каждый надпочечник состоит из двух слоев, внутреннего слоя – мозгового вещества, и внешнего слоя, известного как корковое вещество. Кора надпочечников секретирует множество стероидных гормонов, включая кортизол, который помогает организму реагировать на стресс и внутренние изменения организма, является регулятором жирового, углеводного и белкового обмена.
Секреция кортизола отрегулирована гипофизом, расположенным в основании мозга. Химические сигналы от гипофиза поступают в кровоток и действуют на клетки коры надпочечников, вызывая секрецию кортизола. Секреция и синтез кортизола регулируется кортикотропином или адренокортикотропным гормоном (АКТГ).
При необходимости АКТГ секретируется гипофизом, в результате чего кортизол поступает в кровоток. Высокие уровни кортизола в крови отслеживаются гипофизом и заставляют гипофиз по принципу обратной связи уменьшать секрецию АКТГ так, чтобы снизить уровень кортизола.
Так что такое синдром Кушинга?
Синдром Кушинга возникает при избыточной продукции гормона надпочечников – кортизола в крови, который выходит из под контроля регулирующей системы организма.
Каковы причины Синдрома Кушинга?
Синдром Кушинга – редкое нарушение, которое может быть вызвано различными проблемами в организме. Наиболее распространенной причиной (у 65-70 процентов) является доброкачественная опухоль гипофиза – аденома.
Второй главной причиной являются гормонально-активные опухоли надпочечников (у 20-30 процентов), которые могут быть как доброкачественными, так и злокачественными. В 10-15 процентов случаев причиной синдрома Кушинга является эктопическая продукция АКТГ или кортиколиберина при раке, происходящем в других органах, в результате повышенной секреции АКТГ.
Длительное или чрезмерное применение кортикостероидов также может приводить к развитию синдрома Кушинга.
Синдром Кушинга из-за гипофизарной опухоли иногда называют болезнью Кушинга, названной в честь доктора Харви Кушинга, основоположника нейрохирургии, детально описавшего проявления болезни.
Каковы проявления синдрома Кушинга?
Признаки, которые указывают на развитие синдрома Кушинга, проявляются у пациентов крайне медленно. Часть пациентов могут указать несколько симптомов, в то время как у других может быть их множество. Самым очевидным симптомом является изменение физического состояния пациента. Лицо становится округлым (лунообразным), розовым и опухшим. Пациенты отмечают развитие жирового горбика, расположенного чуть ниже задней части шеи, и увеличение веса (ожирение), причем исключительно туловища, без жировых отложений в конечностях. Фигура больного становится похожа на лимон с воткнутыми в него спичками. Появляется истончение кожи с легкой кровоточивостью и розовыми или фиолетовыми растяжками (стрии). У некоторые пациентов появляется постоянная жажда и может развиться так называемый стероидный диабет. Пациенты могут испытывать нарушение сна, депрессию. Другие жалуются на мышечную слабость и боль в мышцах. Так как признаки и симптомы могут развиваться в течение нескольких лет, последовательные фотографии человека являются зачастую лучшим способом зарегистрировать все изменения. У женщин возможна олигоменорея или аменорея, могут появляться признаки маскулинизации.
Как диагностировать синдром Кушинга?
Наиболее широко используемый анализ – измерение общего количества кортизола в суточной моче.
Другим необходимым методом диагностики является анализ супрессии дексаметазона.
Пациент вечером принимает дексаметазон в таблетированной форме и наутро измеряет уровень кортизола в крови. В норме дексаметазон подавляет способность секретировать кортизол. В случае синдрома Кушинга уровень кортизола не будет подавлен и останется повышенным.
Как только диагноз поставлен, необходимо идентифицировать причину!
Следующим шагом является анализ крови на определение уровня АКТГ и кортизола, взятого поздно днем. В случае, если уровень АКТГ очень низок или не выявлен, подозрения падают на опухоль надпочечников. Компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) обычно подтверждают диагноз. Умеренно увеличенный АКТГ связан с опухолью гипофиза. МРТ мозга подтверждает или опровергает это предположение. Более сложное обследование может быть необходимо в случаях, когда гипофизарная опухоль столь маленькая, что не может быть обнаружена. В случае высокого уровня АКТГ причина, как правило, связана с эктопическим синдромом АКТГ.
Как лечить синдром Кушинга?
Если синдром Кушинга является побочным эффектом применения больших доз предписанных гормонов – стероидов, то отмена этих препаратов в большинстве случаев позволит пациенту избавиться от проблем.
Гипофизарные опухоли могут лечиться хирургическим путем. Обычно операция проводится нейрохирургом с доступом через нос (транссфеноидальная хирургия). Надпочечные опухоли могут быть удалены хирургом или урологом. Если опухоль надпочечников меньше шести сантиметров, опухоль вероятнее всего будет доброкачественной. Эти опухоли могут быть удалены лапароскопическим методом. Несколько точечных разрезов, сделанных в брюшной полости, в отличие от открытых операций, значительно легче переносятся пациентами и существенно сокращают время пребывания в стационаре. В ряде случаев, лапароскопия может быть невыполнима и может быть преобразована в "открытую" операцию. Опухоли больше шести сантиметров, более вероятно, являются злокачественными. Эти опухоли часто удаляются, используя открытый разрез. Во время удаления большой надпочечной опухоли смежные органы и ткани, такие как селезенка, почка или часть толстой кишки, регионарные лимфатические узлы возможно будут удалены, чтобы гарантировать полное удаление опухоли.
Что может ожидаться после лечения Синдрома Кушинга?
Восстановление после лапароскопической хирургии непродолжительное. Полное восстановление физической активности составляет от трех до пяти недель. Обычно нет никаких физических ограничений после восстановления. В случае открытой операции сроки пребывания в стационаре увеличиваются до 7-10 дней, а полное восстановление физической активности увеличивается до восьми недель.
Высокие уровни секреции кортизола от одного надпочечника подавляют функцию другой железы. Во избежание дифицита стероидов, пациентам требуется их послеоперационное назначение. Другой надпочечник со временем восстанавливается, но это восстановление может затянуться до года. У 25 процентов пациентов надпочечник не восстанавливается и требуется постоянная гормональная заместительная терапия.
Может ли хронический стресс являться причиной синдрома Кушинга?
Обусловленное стрессом увеличенное производство кортизола надпочечниками является нормальным и физиологическим состоянием и не приводит к синдрому Кушинга.
Синдром Иценко–Кушинга (синдром Кушинга) — гиперкортицизм, обусловленный повышением содержания в крови эндогенных или экзогенных ГК. Эндогенные ГК появляются вследствие их гиперпродукции корой надпочечников при наличии: • глюкостеромы; • гиперпродукции АКТГ передней долей гипофиза (наличие аденомы; в этом случае говорят о болезни Иценко–Кушинга); • секретирующей АКТГ опухоли различных органов (в первую очередь лёгких; в этом случае говорят о синдроме эктопической продукции АКТГ). Экзогенные ГК обусловливают лекарственный синдром Иценко–Кушинга, встречающийся значительно чаще, чем спонтанный; обычно развивается у больных, длительное время получающих ГК по поводу различных заболеваний (например, аутоиммунных).
Статистические данные. Наиболее часто синдром Иценко–Кушинга имеет ятрогенную природу. В США частота развития синдрома Иценко–Кушинга, обусловленного эндогенной гиперпродукцией ГК, составляет 13 случаев на 1 млн населения. Из них 70% обусловлено болезнью Иценко–Кушинга с наличием АКТГ-продуцирующей аденомы, 15% — эктопической продукцией АКТГ и 15% — первичной опухолью надпочечников (глюкостеромы). Преобладающий пол — женский (5:1). Преобладающий возраст: для синдрома Кушинга, обусловленного аденомой гипофиза или надпочечников, — 25–40 лет, для эктопической продукции АКТГ вследствие рака лёгких — пожилой возраст.
Этиология
• Лечение ГК: обычно синдром Иценко–Кушинга возникает при системном применении ГК, однако возможно его развитие при внутрисуставном введении ГК и даже ингаляционном использовании. Спектр заболеваний, при которых назначают ГК, очень широк и включает разнообразную ревматологическую, нефрологическую, лёгочную и неврологическую патологию; кроме того, назначение ГК возможно при наличии трансплантированных тканей и органов.
• Эндогенная гиперпродукция ГК вследствие: •• наличия АКТГ-продуцирующей аденомы гипофиза (в рамках болезни Иценко–Кушинга), при больших размерах сдавливающей ткань гипофиза и подавляющей выработку большинства гипофизарных гормонов, а также приводящей к офтальмологическим нарушениям; •• поражения надпочечников: глюкостерома (аденома или карцинома), макро- или микронодулярная гиперплазия (возможно одновременное увеличение гиперпродукции как ГК, так и андрогенов клетками ретикулярной или пучковой зон коры надпочечников) •• эктопической продукцией АКТГ раковыми клетками при овсяно-клеточном или мелкоклеточном раке лёгкого.
Патогенез
• Усиление синтеза АКТГ приводит к надпочечниковым и вненадпочечниковым эффектам •• Надпочечниковые — повышение содержания ГК и андрогенов сетчатого слоя коры надпочечников. В меньшей степени АКТГ влияет на повышение концентрации минералокортикоидов •• Вненадпочечниковые — гиперпигментация кожи и слизистых оболочек (в 10% случаев) и психические расстройства
• Повышение продукции ГК — ключевой момент патогенеза синдрома/болезни Иценко–Кушинга. Эффекты: •• Катаболическое действие на белковый и углеводный обмен приводит к атрофии мышечной (в т.ч. сердечной) ткани и кожи, а также гипергликемии с развитием стероидного диабета (в 20% случаев). В патогенезе стероидного диабета также играют роль относительная недостаточность инсулина (с усилением глюконеогенеза в печени) и инсулинорезистентность •• Анаболическое действие на жировой обмен приводит к ожирению (более 90% случаев) •• Минералокортикоидная активность способствует активации системы ренин-ангиотензин-альдостерон с развитием артериальной гипертензии и гипокалиемии. Определённое значение в патогенезе артериальной гипертензии имеет потенцирование ГК эффекта катехоламинов и биогенных аминов (в частности, серотонина) •• Катаболическое действие на костную ткань приводит к снижению способности костной ткани фиксировать кальций и развитию остеопороза (более 80% случаев). Определённую роль в патогенезе остеопороза играет уменьшение ГК реабсорбции кальция в ЖКТ, что связано с торможением процессов гидроксилирования кальциферола •• Подавление специфического иммунитета приводит к развитию вторичного иммунодефицита •• Повышение секреции андрогенов (тестостерона) надпочечниками приводит к снижению гонадотропной функции гипофиза и развитию половых расстройств •• Изменение секреции других тропных гормонов — снижение уровня СТГ и ТТГ, увеличение содержания пролактина.
Клинические проявления
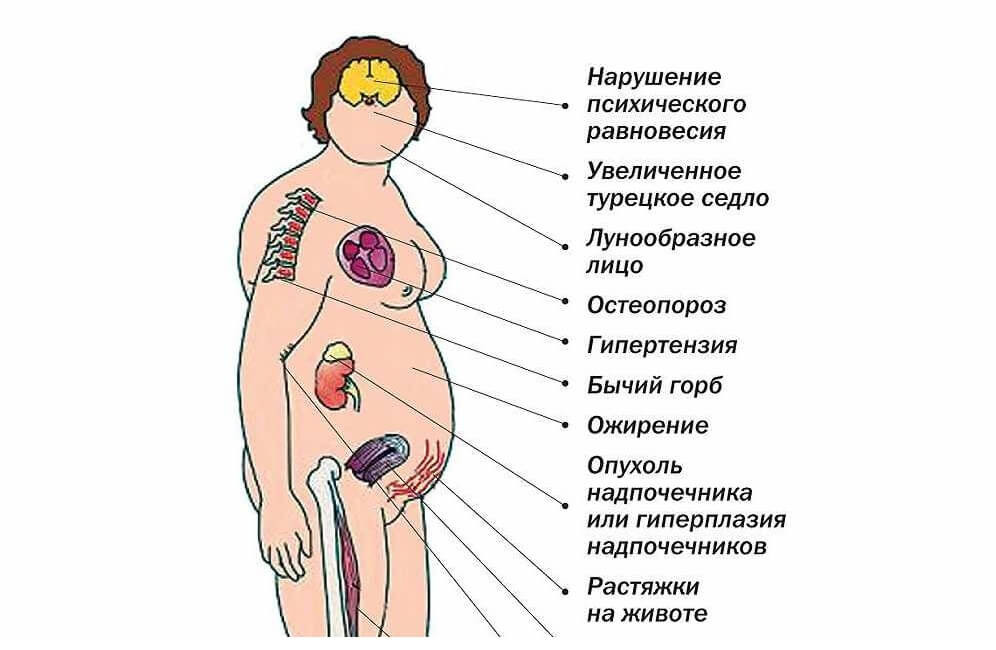
• Симптомы нарушения углеводного обмена — стероидный диабет или снижение толерантности к глюкозе с быстро нарастающей гипергликемией и/или глюкозурией.
• Симптомы нарушения белкового обмена: •• Мышечная слабость — стероидная миопатия: у больных возникают затруденения при подъёме по лестнице, вставании с низкого стула, поднятии рук •• Полосы растяжения (стрии) красно-фиолетового цвета на коже живота, груди и бёдер •• Предрасположенность к возникновению экхимозов (в связи с повышенной ломкостью капилляров) •• Замедленное заживление ран •• Предрасположенность к инфекциям вследствие иммунодефицита.
• Симптомы нарушения водно-электролитного обмена: увелчиние ОЦК вследствие задержки воды и натрия.
• Наличие АКТГ-продуцирующей аденомы гипофиза (в рамках болени Иценко–Кушинга) проводит к появлению офтальмологических расстройств, головных болей, галактореи и других нарушений (см. Аденома гипофиза).
• Другие нарушения: •• Артериальная гипертензия (выявленная впервые или прогрессирующая) •• Нарушения липидного обмена (увеличение синтеза как ЛПВП, так и ЛПНП, триглицеридов) способствуют быстрому прогрессированию атеросклероза коронарных артерий и развитию ИБС •• Петические язвы, иногда бессимптомные, особенно у пациентов, получающих высокие дозы ГК •• Остеопения и остеопороз (вплоть до остеопоретических переломов); также возможен аваскулярный некроз бедренной кости •• Расстройства гормональной регуляции половой сферы (дисменорея, аменорея, бесплодие) •• Акне, гирсутизм •• Образование трофических язв и гнойничковых поражений кожи (вследствие развития вторичного иммунодефицита) •• Гиперпигментация кожи и слизистых оболочек (эффект АКТГ), обычно в местах трения кожи — важный дифференциально-диагностический признак для выявления избыточной продукции АКТГ •• Эмоциональная лабильность, депрессия, когнитивные расстройства •• У детей — задержка роста.
Надпочечниковый (адреналовый) криз. Неотложное состояние; может возникнуть у больных с синдромом Иценко–Кушинга вследствие резкого прекращения приёма ГК, а также в том случае, если при развитии у пациента какого-либо острого заболевания не увеличить дозу ГК. Кроме того, возникает в послеоперационном периоде после удаления АКТГ- или ГК-продуцирующей опухоли.
Клинически проявляется артериальной гипотензией, болями в животе, рвотой и нарушениями сознания. Лабораторные изменения включают гипогликемию, гипонатриемию, гиперкалиемию и метаболический ацидоз.
Лабораторные данные. Основная цель — определение гиперпродукции ГК в организме больного с одновременным определением содержания АКТГ (условие достоверных результатов — отсутствие у больного острого заболевания). Первый шаг — оценка зависимости/независимости проявлений от АКТГ • Для выявления гиперпродукции ГК необходимо обнаружение повышенного содержания в крови самого кортизола или в моче его самого либо его метаболитов (повышение суточной экскреции с мочой свободного кортизола или 17-оксикортикостероидов [17-ОКС]) •• Повышение концентрации кортизола в крови в ночное время (предпочтительно ближе к полуночи) более 7,5 мкг% — достоверный признак синдрома Иценко–Кушинга. Ещё более достоверным считают выявление повышенного содержания в крови кортизола в течение нескольких дней подряд. В настоящее время разработы методики определения содержания кортизола в слюне (сбор слюны в домашних условиях), одноко их применение ограничено вследствие дороговизны • Повышение уровня АКТГ в плазме до 20 пг/мл (наиболее достоверно ночное повышение) — важный дифференциально-диагностический признак •• При глюкостероме вследствие чрезмерной продукции кортизола секреция АКТГ гипофизом подавляется, что приводит к снижению его уровня в плазме (менее 5 пг/мл) •• При синдроме эктопической продукции АКТГ или АКТГ-серетирующей аденомы гипофиза его концентрация составляет 10–20 пг/мл и выше.
Тем не менее для выявления синдрома Иценко–Кушинга обычно применяеют два скрининговых теста (более удобны).
• Тест суточной экскреции кортизола. Это наиболее достоверный тест для выявления суточной гиперпродукции ГК. Повышение более чем в 3–4 раза (относительно верхней границы нормы) свидетельствует о несомненном диагнозе синдрома/болезни Иценко–Кушига, тогда как при повышении в 2–3 раза необходимо проводить дифференциальную диагностику с псевдосиндромом Иценко–Кушинга. При проведении теста следует убедиться, что больной правильно собирал суточную мочу — для этого нужно определить в той же суточной моче количество креатинина.
При необходимости дальнейшего обследования применяют следующие тесты.
• Стандартный тест подавления дексаметазоном — надёжный тест диагностики синдрома/болезни Иценко–Кушинга, хотя чувствительность и специфичность данного теста составляют примерно 70%. Подавление гипоталамо-гипофизарно-надпочечниковой системы исследуют при введении дексаметазона в низких дозах (0,5 мг дексамтезона, разделённого на 8 доз, каждые 6 ч внутрь в течение 2 дней) с измерением концентрации кортизола в сыворотке и уровня 17-ОКС в моче на второй день (ожидается снижение). В настоящее время перспективным считают сочетание стандартного теста подавления дексаметазоном с дополнительным введением кортиколиберина (1 мкг/кг в/в через 2 ч после приёма восьмого приёма дексаметазона). При проведении теста также возможно определение снижения экскреции 17-ОКС более чем на 50%.
• Ночной тест подавления большой дозой дексаметазона удобнее в исполнении, чем стандартный тест. Его применяют, когда содержание АКТГ промежуточное между 5 и 10 пг/мл. Концентрацию кортизола сыворотки крови определяют в 8 ч утра в течение двух дней подряд, в 11 ч вечера первого дня принимают 8 мг дексаметазона. Падение уровня кортизола сыворотки более чем на 50% на второй день указывает гипофизарное происхождение избыточного АКТГ в большей степени, чем на эктопическую продукцию АКТГ или первичную надпочечниковую патологию.
• Тест стимуляции кортиколиберином. Парентерально вводят кортиколиберин и через 15 мин измеряют уровень АКТГ и кортизола. При болезни Иценко–Кушинга показатели обычно повышены (для кортизола — более 1,4 мкг%), отсутствие ответа свидетельствует об эктопическом или надпочечниковом генезе гиперкортицизма.
Другие критерии • Нейтрофильный лейкоцитоз (иногда более 11 ´ 10 9 /л) • Гипергликемия и глюкозурия • Гиперлипидемия • Гипокалиемия • Лимфопения • Эозинопения.
Инструментальные данные. Применение специальных методов исследования необходимо предварять тщательным лабораторным обследованием.
• Рентгенография черепа позволяет выявить макроаденомы гипофиза (10% случаев), рентгенография поясничного отдела позвоночника — остеопороз. Тем не менее для диагностики синдрома и болезни Иценко–Кушинга данный метод в настоящее время считают малоинформативным.
• При подозрении на болезнь Иценко–Кушинга (гипофизарное происхождение избыточной продукции АКТГ) необходимо проведение визуализирующих исследований головы •• КТ головы с введением контраста позволяет выявить около 50% аденом гипофиза •• МРТ с гадолиновым контрастом — метод выбора — повзоляет выявить около 75% таких опухолей •• Зачастую даже при МРТ не обнаруживают никаких изменений вследствие микроаденом очень небольшого размера или диффузной гиперплазии соотвествующих гипофизарных клеток. В этом случае полезно раздельное определение содержания АКТГ в крови из нижнего каменистого синуса и периферических вен. Забирают пробы крови из периферических вен и (путём катетеризации) из нижнего каменистого синуса твёрдой мозговой оболочки. Соотношение уровня АКТГ в крови синуса к уровню АКТГ в периферических венах больше 2,0 наблюдают при болезни Иценко–Кушинга, тогда как соотношение менее 1,5 характерно для синдрома эктопической продукции АКТГ.
• При подозрении на потологию надпочечников проводят следующие диагностические процедуры •• КТ брюшной полости, позволяющую выявить увеличение надпочечников (при их размерах более 4–6 см в первую очередь следует исключить карциному, для чего возможно проведение прицельной аспирационной биопсии под контролем КТ). Равномерное увеличение обоих надпочечников предполагает болезнь Иценко–Кушинга или синдром эктопической продукции АКТГ. Увеличение одного надпочечника при наличии соответствующей клиники предполагает глюкостерому • Радиоизотопное исследование с использованием 19-йодхолестерина, меченного радиоактивным йодом, выявляет двустороннюю гиперплазию в случае болезни Иценко–Кушинга или синдрома эктопической продукции АКТГ, при глюкостероме — несимметричное поглощение препарата.
• При подозрении на синдром эктопической продукции АКТГ: •• КТ грудной и брюшной полостей •• Сцинтиграфию с меченным октреотидом (клетки нейроэндокринных опухолей имеют рецепторы к соматостатину).
Диагностическая тактика. Заподозренный на основании анамнестических и клинических данных синдром Иценко–Кушинга после исключения экзогенного поступления ГК (даже ингаляционного или внутрисуставного) нуждается в верификации с помощью тщательного лабораторного обследования, преследующего цель выявления источника гиперпродукции ГК и зависимости состояния от АКТГ. Специальные инструментальные методы исследования (головы, надопочечников или грудной полости) назначают для окончательной верификации диагноза после того, как сформулировано обоснованное лабораторными находками предположение о причине синдрома Иценко–Кушинга.
ЛЕЧЕНИЕ
Общая тактика. Лечение синдрома/болезни Иценко–Кушинга зависит от причины. Ятрогенный синдром (лечение обязательно и в этом случае) предполагает постепенную отмену ГК (с заменой их при необходимости на другие иммунодепрессанты).
При синдроме Иценко–Кушинга с гиперпродукций ГК метод выбора — хирургическое удаление причинно-значимой опухоли (гипофиза, надпочечников, лёгких). При неффективности или невозможности хирургического лечения (что чаще бывает при синдроме эктопической секреции АКТГ или метастатической карциноме) предпринимают попытку медикаментозного лечения. К сожалению, последнее часто оказывается неэффективным, и тогда прибегают к двусторонней адреналэктомии. При АКТГ-продуцирующей аденоме гипофиза часто прибегают в т.ч. к лучевой терапии.
Лучевая терапия. Её применяют при неэффективности проводимого лечения — хирургического или медикаментозного, обычно в комбинации с ними. Лучевая терапия увеличивает эффект медикаментозного лечения.
Хирургическое лечение
• Метод выбора при болезни Кушинга — транссфеноидальная резекция аденомы гипофиза при максимально возможном сохранении его функций. В настоящее время становится доступной эндоскопическая методика. Операция успешна в 60–80% случаев и сопровождается установлением в последующем нормальной функции гипофиза и надпочечников и излечением синдрома Иценко–Кушинга. При неээфективности обычного хирургического лечения необходимо иметь ввиду возможность проведения операции на гипофизе по контролем МРТ.
• При эктопической продукции АКТГ проводят хирургическое лечение выявленной опухоли; при его невозможности показаны лекарственное лечение или двусторонняя адреналэктомия.
• При опухоли надпочечников обычно проводят одностороннюю адреналэктомию.
• Двусторонняя адреналэктомия показана в двух случаях: •• неэффективность проводимой ранее терапии (хриругической, лучевой, лекарственной); •• необходимость быстрой нормализации концентрации в крови кортизола. Процедура излечивает болезнь Иценко–Кушинга, но у больного развивается болезнь Аддисона и возникает необходимость пожизненного возмещения стероидов (ГК и минералокортикоидов). Кроме того, в некоторых случаях вслед за адреналэктомией развивается синдром Нельсона, при котором аденома гипофиза начинает быстро расти, т.к. она больше не ингибируется повышенным уровнем кортизола.
Осложнения • Остеопороз • Предрасположенность к гнойно-воспалительным заболеваниям • Гирстутизм • СД • Артериальная гипертензия • Адреналовый криз • Пангипопитуитаризм • Несахарный диабет • Следует иметь ввиду, что при повышенном содержании в крови ГК клиническая картина острой патологии брюшной полости может быть крайне скудной.
Прогноз. Зависит от причины состояния, а также возможности и эффективности проведения оперативного лечения.
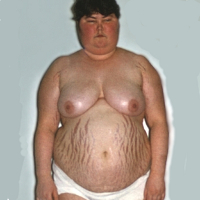
Болезнь Иценко-Кушинга – нейроэндокринное расстройство, развивающееся вследствие поражения гипоталамо-гипофизарной системы, гиперсекреции АКТГ и вторичной гиперфункции коры надпочечников. Симптомокомплекс, характеризующий болезнь Иценко-Кушинга, включает ожирение, гипертонию, сахарный диабет, остеопороз, снижение функции половых желез, сухость кожных покровов, стрии на теле, гирсутизм и др. С диагностической целью проводится определение ряда биохимических показателей крови, гормонов (АКТГ, кортизола, 17-ОКС и др.), краниограмма, КТ гипофиза и надпочечников, сцинтиграфия надпочечников, проба Лиддла. В лечении болезни Иценко-Кушинга применяется медикаментозная терапия, рентгенотерпия, хирургические методы (адреналэктомия, удаление опухоли гипофиза).
Общие сведения
В эндокринологии различают болезнь и синдром Иценко-Кушинга (первичный гиперкортицизм). Оба заболевания проявляются общим симптомокомплексом, однако имеют различную этиологию. В основе синдрома Иценко-Кушинга лежит гиперпродукция глюкокортикоидов гиперпластическими опухолями коры надпочечников (кортикостеромой, глюкостеромой, аденокарциномой) либо гиперкортицизм, обусловленный длительным введением экзогенных глюкокортикоидных гормонов. В некоторых случаях, при эктопированных кортикотропиномах, исходящих из клеток АПУД-системы (липидоклеточной опухоли яичника, раке легкого, раке поджелудочной железы, кишечника, тимуса, щитовидной железы и др.), развивается, так называемый эктопированный АКТГ-синдром с аналогичными клиническими проявлениями.
При болезни Иценко-Кушинга первичное поражение локализуется на уровне гипоталамо-гипофизарной системы, а периферические эндокринные железы вовлекаются в патогенез заболевания вторично. Болезнь Иценко-Кушинга развивается у женщин в 3-8 раз чаще, чем у мужчин; болеют преимущественно женщины детородного возраста (25-40 лет). Течение болезни Иценко-Кушинга характеризуется тяжелыми нейроэндокринными нарушениями: расстройством углеводного и минерального обмена, симптомокомплексом неврологических, сердечно-сосудистых, пищеварительных, почечных расстройств.

Причины болезни Иценко-Кушинга
Развитие болезни Иценко-Кушинга в большинстве случаев связано с наличием базофильной или хромофобной аденомы гипофиза, секретирующей адренокортикотропный гормон. При опухолевом поражении гипофиза у пациентов выявляется микроаденома, макроаденома, аденокарцинома. В некоторых случаях отмечается связь начала заболевания с предшествующими инфекционными поражениями ЦНС (энцефалитом, арахноидитом, менингитом), черепно-мозговыми травмами, интоксикациями. У женщин болезнь Иценко-Кушинга может развиваться на фоне гормональной перестройки, обусловленной беременностью, родами, климаксом.
Основу патогенеза болезни Иценко-Кушинга составляет нарушение гипоталамо-гипофизарно-надпочечниковых взаимоотношений. Снижение тормозящего влияния дофаминовых медиаторов на секрецию КРГ (кортикотропного рилизинг-гормона) приводит к гиперпродукции АКТГ (адренокортикотропного гормона).
Повышенный синтез АКТГ вызывает каскад надпочечниковых и вненадпочечниковых эффектов. В надпочечниках увеличивается синтез глюкокортикоидов, андрогенов, в меньшей степени – минералокортикоидов. Повышение уровня глюкокортикоидов оказывает катаболический эффект на белково-углеводный обмен, что сопровождается атрофией мышечной и соединительной ткани, гипергликемией, относительной недостаточностью инсулина и инсулинорезистентностью с последующим развитием стероидного сахарного диабета. Нарушение жирового обмена вызывает развитие ожирения.
Усиление минералокортикоидной активности при болезни Иценко-Кушинга активизирует ренин-ангиотензин-альдостероновую систему, способствуя тем самым развитию гипокалиемии и артериальной гипертензии. Катаболическое влияние на костную ткань сопровождается вымыванием и снижением реабсорбции кальция в желудочно-кишечном тракте и развитием остеопороза. Андрогенные свойства стероидов вызывают нарушение функции яичников.
Формы клинического течения болезни Иценко-Кушинга
Тяжесть течения болезни Иценко-Кушинга может быть легкой, средней или тяжелой. Легкая степень заболевания сопровождается умеренно-выраженными симптомами: менструальная функция может быть сохранена, остеопороз иногда отсутствует. При средней степени тяжести болезни Иценко-Кушинга симптоматика выражена ярко, однако осложнения не развиваются. Тяжелая форма заболевания характеризуется развитием осложнений: атрофии мышц, гипокалиемии, гипертонической почки, тяжелых психических расстройств и т. д.
По скорости развития патологических изменений различают прогрессирующее и торпидное течение болезни Иценко-Кушинга. Прогрессирующее течение характеризуется быстрым (в течение 6-12 месяцев) нарастанием симптомов и осложнений заболевания; при торпидном течении патологические изменения формируются постепенно, на протяжении 3-10 лет.
Симптомы болезни Иценко-Кушинга
При болезни Иценко-Кушинга развиваются нарушения жирового обмена, изменения со стороны костной, нервно-мышечной, сердечно-сосудистой, дыхательной, половой, пищеварительной системы, психики.
Эндокринные нарушения у женщин с болезнью Иценко-Кушинга выражаются нарушением менструального цикла, иногда – аменореей. Отмечается избыточное оволосение тела (гирсутизм), рост волос на лице и выпадение волос на голове. У мужчин наблюдается уменьшение и выпадение волос на лице и на теле; снижение полового влечения, импотенция. Начало болезни Иценко-Кушинга в детском возрасте, может приводить к задержке полового развития вследствие снижения секреции гонадотропных гормонов.
Изменения со стороны костной системы, являющиеся следствием остеопороза, проявляются болями, деформацией и переломами костей, у детей – задержкой роста и дифференцировки скелета. Сердечно-сосудистые нарушения при болезни Иценко-Кушинга могут включать артериальную гипертензию, тахикардию, электролитно-стероидную кардиопатию, развитие хронической сердечной недостаточности. Пациенты с болезнью Иценко-Кушинга подвержены частой заболеваемости бронхитом, пневмонией, туберкулезом.
Неврологические нарушения при болезни Иценко-Кушинга могут выражаться в развитии болевого, амиотрофического, стволово-мозжечкового и пирамидного синдромов. Если болевой и амиотрофический синдромы потенциально обратимы под воздействием адекватной терапии болезни Иценко-Кушинга, то стволово-мозжечковый и пирамидный синдромы являются необратимыми. При стволово-мозжечковом синдроме развиваются атаксия, нистагм, патологические рефлексы. Пирамидный синдром характеризуется сухожильной гиперрефлексией, центральным поражением лицевого и подъязычного нервов с соответствующей симптоматикой.
При болезни Иценко-Кушинга могут иметь место психические расстройства по типу неврастенического, астеноадинамического, эпилептиформного, депрессивного, ипохондрического синдромов. Характерно снижение памяти и интеллекта, вялость, уменьшение величины эмоциональных колебаний; пациентов могут посещать навязчивые суицидальные мысли.
Диагностика болезни Иценко-Кушинга
Разработка диагностической и лечебной тактики при болезни Иценко-Кушинга требует тесного сотрудничества эндокринолога, невролога, кардиолога, гастроэнтеролога, уролога, гинеколога.
При болезни Иценко-Кушинга отмечаются типичные изменения биохимических показателей крови: гиперхолестеринемия, гиперглобулинемия, гиперхлоремия, гипернатриемия, гипокалиемия, гипофосфатемия, гипоальбуминемия, снижение активности щелочной фосфатазы. При развитии стероидного сахарного диабета регистрируются глюкозурия и гипергликемия. Исследование гормонов крови выявляет повышение уровня кортизола, АКТГ, ренина; в моче обнаруживаются эритроциты, белок, зернистые и гиалиновые цилиндры, увеличивается выделение 17-КС, 17-ОКС, кортизола.
С целью дифференциальной диагностики болезни и синдрома Иценко-Кушинга выполняются диагностические пробы с дексаметазоном и метопироном (проба Лиддла). Повышение экскреции 17-ОКС с мочой после приема метопирона или снижение экскреции 17-ОКС более чем на 50% после введения дексаметазона указывает на болезнь Иценко-Кушинга, тогда как отсутствие изменений экскреции 17-ОКС свидетельствует в пользу синдрома Иценко-Кушинга.
С помощью рентгенографии черепа (турецкого седла) выявляются макроаденомы гипофиза; при КТ и МРТ головного мозга с введением контраста – микроаденомы (в 50-75% случаев). При рентгенографии позвоночника обнаруживаются выраженные признаки остеопороза.
Исследование надпочечников (УЗИ надпочечников, МРТ надпочечников, КТ, сцинтиграфия) при болезни Иценко-Кушинга выявляет двустороннюю гиперплазию надпочечников. В то же время, несимметричное одностороннее увеличение надпочечника указывает на глюкостерому. Дифференциальная диагностика болезни Иценко-Кушинга проводится с аналогичным синдромом, гипоталамическим синдромом пубертатного периода, ожирением.
Лечение болезни Иценко-Кушинга
При болезни Иценко-Кушинга требуется устранить гипоталамические сдвиги, нормализовать секрецию АКТГ и кортикостероидов, восстановить нарушенный обмен веществ. Для лечения заболевания может применяться медикаментозная терапия, гамма-, рентгенотерапия, протонотерапия гипоталамо-гипофизарной области, хирургическое лечение, а также сочетание различных методов.
Медикаментозная терапия применяется в начальных стадиях болезни Иценко-Кушинга. С целью блокады функции гипофиза назначается резерпин, бромокриптин. Кроме препаратов центрального действия, подавляющих секрецию АКТГ, в терапии болезни Иценко-Кушинга могут применяться блокаторы синтеза стероидных гормонов в надпочечниках. Проводится симптоматическая терапия, направленная на коррекцию белкового, минерального, углеводного, электролитного обмена.
Гамма-, рентгено- и протонотерапия обычно проводятся пациентам, у которых отсутствуют рентгенологические данные за опухоль гипофиза. Одним из методов лучевой терапии является стереотаксическая имплантация в гипофиз радиоактивных изотопов. Обычно через несколько месяцев после лучевой терапии наступает клиническая ремиссия, которая сопровождается снижением массы тела, АД, нормализаций менструального цикла, уменьшением поражения костной и мышечной систем. Облучение области гипофиза может сочетаться с односторонней адреналэктомией или направленной деструкцией гиперплазированного вещества надпочечника.
При тяжелой форме болезни Иценко-Кушинга может быть показано двустороннее удаление надпочечников (двусторонняя адреналэктомия), требующее в дальнейшем пожизненной ЗТ глюкокортикоидами и минералокортикоидами. В случае выявления аденомы гипофиза производится эндоскопическое трансназальное или транскраниальное удаление опухоли, транссфеноидальная криодеструкция. После аденомэктомии ремиссия наступает в 70-80% случаев, примерно у 20% может возникать рецидив опухоли гипофиза.
Прогноз и профилактика болезни Иценко-Кушинга
Прогноз болезни Иценко-Кушинга определяется длительностью, тяжестью заболевания, возрастом больного. При раннем лечении и легкой форме заболевания у молодых пациентов возможно полное выздоровление. Длительное течение болезни Иценко-Кушинга, даже при устранении первопричины, приводит к стойким изменениям в костной, сердечно-сосудистой, мочевыводящей системах, что нарушает трудоспособность и отягощает прогноз. Запущенные формы болезни Иценко — Кушинга заканчиваются летальным исходом в связи с присоединением септических осложнений, почечной недостаточности.
Пациенты с болезни Иценко-Кушинга должны наблюдаться эндокринологом, кардиологом, неврологом, гинекологом-эндокринологом; избегать чрезмерных физических и психо-эмоциональных нагрузок, работы в ночную смену. Предупреждение развития болезни Иценко-Кушинга сводится к общепрофилактическим мерам – профилактике ЧМТ, интоксикаций, нейроинфекций и т. д.
Читайте также:

