Берут ли в армию с болезнью виллебранда
Обновлено: 30.06.2024
Прежде чем отвечать на вопрос о том, можно ли ставить прививку от Ковид при варикозе, необходимо разобраться в том, что такое это варикозное расширение вен.
Оно является очень распространенным заболеванием, которому в равной степени подвержены представители обеих половин человечества. Данное заболевание поражает нижние конечности и глубокие вены человека. Это может привести к образованию тромбоза и посттромбофлебитической болезни.
Признаки варикозного расширения вен
Все симптомы этого заболевания делятся на два вида: субъективные и объективные. К первым можно отнести следующие проявления:
- ноющие боли в икроножных мышцах;
- чувство зуда и жжения вдоль венозных артерий, которые поражены варикозом;
- ощущение тяжести в нижних конечностях, которая усиливается к вечеру;
- появление гиперпигментации кожи;
- образование трофической венозной язвы голени;
- болевые ощущения в икрах, которые усиливаются во время ходьбы;
- появление отечности в районе стоп и голени.
Ко второму типу признаков относятся следующие:
- изменение цвета и структуры кожи;
- появление сосудистых звездочек;
- образование венозной трофической язвы;
- проявление расширенных внутрикожных и подкожных вен;
- образование липодерматосклероза;
- возможность увидеть расширенные венозные сосуды даже без использования специального оборудования.

Стадии заболевания и его классификация
Как и большинство других болезней, варикозное расширение вен проходит несколько стадий. Они отличаются друг от друга распространением патологии и ее симптомами. Принято выделять три стадии:
- компенсация;
- субкомпенсация;
- декомпенсация.
Необходимо учитывать, что осложнения могут возникать на любой из этих стадий, однако максимальная вероятность этого возможна только на двух последних. Варикозное расширение вен способно послужить спусковым механизмом для развития следующих патологий:
- трофической экземы;
- тромбоза глубоких вен;
- рожистых воспалений;
- тромбофлебита.
Причины развития заболевания
Развитию варикозного расширения вен на ногах могут способствовать определенные обстоятельства и факторы. Среди них принято выделять следующие:
- Нарушение работы венозного клапана. Это приводит к тому, что поток крови устремляется вниз под действием силы тяжести всякий раз, когда человек становится на ноги. Расположенные вокруг глубоких вен мышечные волокна начиная сокращаться при ходьбе. Таким образом эти вены опустошаются. Кровь начинает попадать в поверхностные вены через специальные сосуды с недостаточными клапанами. Вследствие этого они переполняются кровью, которая приводит к их растяжению и расширению.
- Наследственное предрасположение. Ученые до сих пор не могут прийти к единому мнению по поводу степени влияния этого фактора на вероятность заболевания.
- Нарушение гормонального фона. За последние годы роль этого фактора в развитии болезни значительно усилилась. Этот факт обуславливается тем, что многие женщины в качестве контрацептива употребляют гормональные препараты. Также широкое распространение получило гормонозаместительное лечение остеопороза.
- Образ жизни, связанный с длительными статическими нагрузками или регулярным поднятием тяжестей.
- Ожирение. Научно доказано что эта патология оказывает непосредственное влияние на вероятность развития варикозного расширения вен.
Прививка от коронавируса при диагностировании варикозе
Всем интересующимся вопросом, можно ли делать прививку от коронавируса при варикозе, стоит знать, что можно. Данное заболевание не является обязательным ограничением от вакцинации против Covid-19. Однако необходимо учитывать, что прививка допускается только при отсутствии обострения варикоза. Если у человека диагностирован острый тромбофлебит, который относится к стадии декомпенсации, он является противопоказанием к вакцинации, а значит делать прививки от коронавируса категорически запрещено.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Тромбоцитопения: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Тромбоциты – клетки крови, имеющие форму пластинки, которые участвуют в процессах свертывания крови. Их основная функция – закрытие раны при кровотечении путем образования тромба, или сгустка крови. Тромбообразование является естественным процессом защиты от массивной кровопотери при любых травмах. Дефицит тромбоцитов в крови называется тромбоцитопенией. Данное состояние достаточно часто протекает бессимптомно, однако может являться опасным для жизни при значительном уменьшении числа тромбоцитов крови.
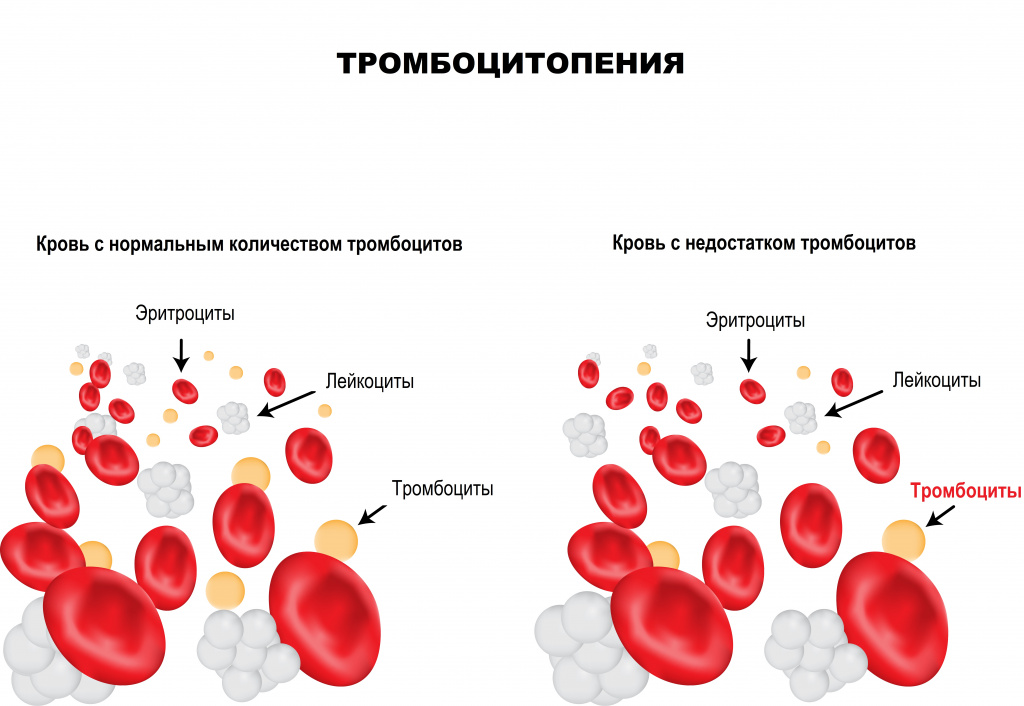
Помимо остановки кровотечения (гемостаза), тромбоциты выполняют ряд важных функций в организме человека: выделение веществ, суживающих сосуды при кровотечении; стимуляция восстановления тканей при любой травме; регулирование процессов местного воспаления и иммунитета.
Эти функции активизируются при любом повреждении эндотелия (внутреннего слоя, покрывающего стенки сосудов). Недостаток тромбоцитов приводит к нарушению системы свертывания крови и, как результат, повышенной кровоточивости, гематомам (синякам) и темно-красной сыпи на коже и слизистых (при надавливании такая сыпь не исчезает).
Продолжительная кровоточивость десен, большой объем кровотечений из маленьких ран и при менструациях – тревожный сигнал, говорящий о возможной проблеме системы свертывания крови.
Разновидности тромбоцитопении
Под тромбоцитопенией понимают уменьшение количества тромбоцитов в периферической крови ниже 150 тыс./мкл. Среди всех тромбоцитопений выделяют следующие состояния:
- Тромбоцитопения разведения – возникает при массивных кровотечениях и восполнении объема циркулирующей крови растворами.
- Тромбоцитопения распределения – часто возникает при избыточной патологической утилизации тромбоцитов в увеличенной селезенке.
- Продуктивная тромбоцитопения – возникает при нарушении функции костного мозга в результате различных заболеваниях или лучевой терапии.
- Тромбоцитопения потребления – возникает при ДВС-синдроме (диссеминированном внутрисосудистом свертывании крови – патологическом состоянии, когда образуются тромбы в кровеносном русле многих органов) или при постоянном аутоиммунном повреждении эндотелия сосудов. Происходит патологическая активация тромбоцитов и их быстрое расходование (потребление) организмом.
- Псевдотромбоцитопения – возникает при нарушении техники проведения анализа с развитием агрегации тромбоцитов.
Одной из частых причин тромбоцитопении является избыточное потребление тромбоцитов в организме, например, при ДВС-синдроме.
Иммунная форма тромбоцитопении считается самой частой иммунной патологией крови. Развивается быстро, с подъемом температуры тела и появлением обильной сыпи на коже нижних конечностей, ягодиц, вокруг крупных суставов, иногда достигая лица. Сыпь представляет собой мелкие кровоизлияния в кожу, часто сопровождается болью в суставах, отеками и нарушением движения в пораженных суставах. Иногда проявляется схваткообразной болью в животе, тошнотой, рвотой и жидким стулом. Описаны случаи появления крови в моче.
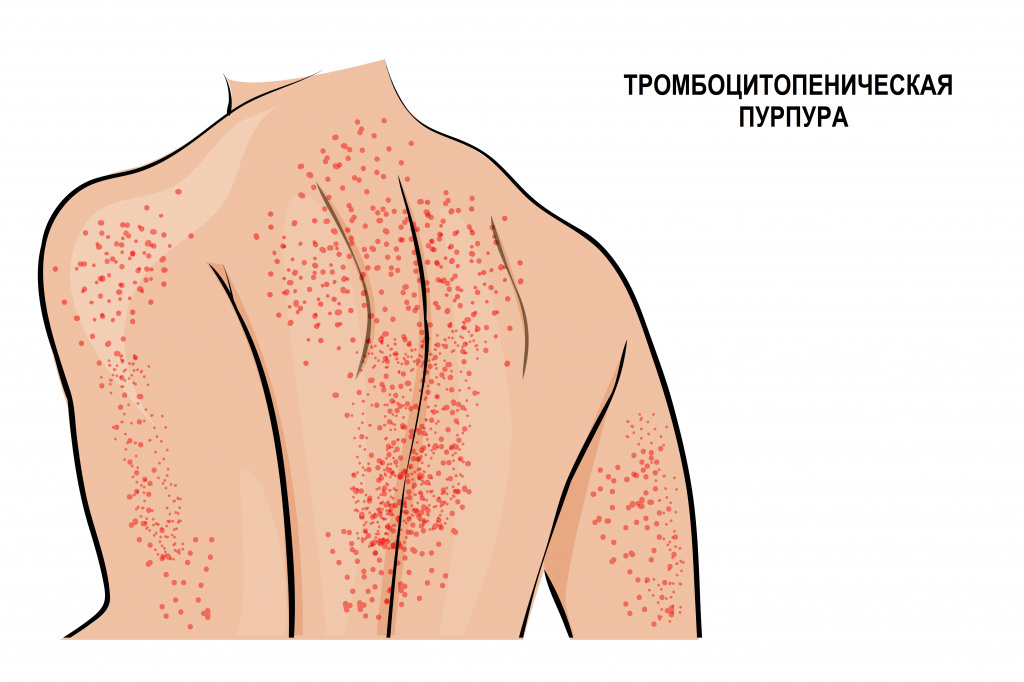
Аутоиммунная тромбоцитопения (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) вызвана уменьшением продолжительности жизни тромбоцитов из-за воздействия антитромбоцитарных аутоантител. Такая тромбоцитопения может протекать волнообразно – с чередованием периодов обострения и ремиссии. Нередко заболевание дает о себе знать на фоне инфекционных заболеваний: гриппа, вируса иммунодефицита человека (ВИЧ), вируса Эпштейна–Барр (ВЭБ), парвовируса В19, цитомегаловирусной инфекции (ЦМВ), вирусных гепатитов В и С.
Среди продуктивных тромбоцитопений особое место занимают апластические анемии, опухолевые процессы в костном мозге, лучевые поражения.
Для всех перечисленных состояний характерно резкое снижение гемопоэтической (кроветворной) функции костного мозга за счет тех или иных структурных изменений.
Апластическая анемия характеризуется уменьшением продукции всех трех ростков кроветворения: эритроцитов, лейкоцитов и тромбоцитов. Каждый росток отвечает за определенные функции в организме, и уменьшение производимых клеток приводит к появлению соответствующих симптомов. Уменьшение тромбоцитов ведет к повышенной кровоточивости, снижение количества эритроцитов говорит о признаках анемии (бледность, утомляемость, ломкость волос, боль за грудиной), а уменьшение лейкоцитов ведет к инфекционным осложнениям в виде рецидивирующих ангин, пневмоний и др. В некоторых случаях костный мозг замещается жировой тканью, что также нарушает образование клеток крови.
При В12- и фолиеводефицитной анемиях происходит нарушение созревания будущих тромбоцитов, они погибают еще до стадии созревания. Заболевание проявляется бледностью кожи, учащенным сердцебиением, одышкой. При выраженном дефиците витамина В12 возможны нарушение чувствительности, парезы и параличи.
Различные виды лейкозов приводят к появлению опухолевых клеток, которые делятся с огромной скоростью и вскоре замещают собой костный мозг. При этом нарушается функция всех трех ростков кроветворения. В костном мозге и крови появляются незрелые клетки, неспособные выполнять свою функцию.
Медикаментозная тромбоцитопения может развиться в результате приема некоторых лекарственных препаратов, например, цитостатиков, которые угнетают образование тромбоцитов в костном мозге.
Заболевания, сопровождающиеся увеличением размера селезенки (спленомегалией), способны привести к повышенному разрушению тромбоцитов, или гиперспленизму (увеличению утилизации тромбоцитов селезенкой). Помимо тромбоцитов также разрушаются эритроциты, что ведет к развитию не только тромбоцитопенического состояния, но и к гемолитической анемии.
К таким заболеваниям относят цирроз печени, в том числе алкогольной этиологии, хроническую сердечную недостаточность, лимфопролиферативные заболевания.
Диагностика и обследования при тромбоцитопении
При выявлении признаков тромбоцитопении врач назначит комплекс лабораторно-инструментальных методов исследования:
-
клинический анализ крови: общий анализ с подсчетом тромбоцитов, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Одно из основных лабораторных исследований для количественной и качественной оценки всех классов форменных элементов крови. Включает цитологическое исследование мазка крови для подсчета процентного содержания разновидностей лейкоцитов и определение скорости оседания эритроцитов.
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область
Два случая склеродермии у военнослужащих (возвращаясь к напечатанному)
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область





На основании данных литературы рассматриваются атипичные формы (течение) ограниченной склеродермии, особенности классификации и диагностики заболевания. Приводятся два собственных наблюдения склеродермии у военнослужащих, представляющие интерес в плане диагностики и принятия экспертного решения.
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область
Главный военный клинический госпиталь внутренних войск МВД России, Балашиха, Московская область
Увеличение числа больных склеродермией отмечают ряд авторов [1]. Мы не можем об этом судить из-за редкости патологии в воинском коллективе, о чем писали недавно [2]. Вместе с тем за последний год мы встретились с 2 случаями склеродермии со своеобразной клинической картиной, вызвавшей трудности в диагностике и принятии экспертного решения.
Локализованная (ограниченная) склеродермия (ОСД) — хроническое заболевание соединительной ткани, характеризующееся очаговыми воспалительно-склеротическими изменениями кожи и подлежащих тканей без вовлечения в патологический процесс внутренних органов [4].
Общепринятой классификации нет. В зависимости от клинических проявлений большинство авторов, в том числе военные дерматологи [5], различают несколько форм ОСД — бляшечную (пузырную и глубокую), линейную (полосовидную), пятнистую — поверхностную ограниченную (болезнь белых пятен, белый лихен Цумбуша, первичный склероатрофический лихен), идиопатическую атрофодермию Пазини—Пьерини, ОСД с гемиатрофией лица Ромберга. Различные формы ОСД существенно различаются как по ряду клинических и морфологических признаков, так и по течению [1, 4—8].
Идиопатическая атрофодермия Пазини—Пьерини многими авторами считается абортивным (первичным атрофическим) вариантом ОСД и клинически проявляется длительно существующими, незначительно западающими очагами коричневого или серо-коричневого цвета с фиолетово-сиреневым оттенком без признаков уплотнения кожи. Очаги располагаются чаще всего на туловище (спине) и верхних конечностях [4—8].
Некоторые авторы считают склероатрофический лихен Цумбуша и идиопатическую атрофию Пазии—Пьерини самостоятельными заболеваниями.
Алгоритм обследования больного склеродермией основывается в основном на анамнестических данных и физикальном обследовании. В начале развития ОСД, когда уплотнение еще не выражено и имеется только обесцвеченное пятно, процесс может напоминать витилиго или депигментированное пятно при недифференцированной лепре [8]. Обязательные и дополнительные лабораторные исследования указаны во всех современных руководствах [4].
Среди больных преобладают лица с группой крови 0(I), что косвенно подтверждает генетическую обусловленность склеродермии. Несомненна связь склеродермии с состоянием эндокринной системы. Наличие эндокринных расстройств у больных склеродермией является показанием к назначению препаратов гипофиза, щитовидной железы, околощитовидных желез, половых гормонов [9].
Типична эозинофилия. Реакция на антиядерные антитела обычно положительная у пациентов с генерализованным заболеванием. Исследование биопсийного материала позволяет выявить различную степень воспаления (типично для ранних очагов) и склероз дермы [10]. Приводим два собственные наблюдения.
Из анамнеза: со слов, в 12—14-летнем возрасте появилось темное пятно в области поясницы слева. Врачи в военкомате интересовались происхождением пятна, но поскольку жалоб больной не предъявлял, диагноз не выставлялся. Закончил ВВУЗ и служит на командной должности. В 2004 г. появилось коричневое пятно на левой половине туловища; в 2007 г. — два белых пятна на левой боковой поверхности туловища и спине. Пятно в области поясницы постепенно увеличивалось в размере, уплотнения на очагах никогда не замечал.
Результаты специальных исследований: клинический анализ крови и мочи без патологии; группа крови Аβ (II) резус-положительная; RW — отрицательная, антитела к ВИЧ, НВS антиген, anti HCY не обнаружены; ревматоидный фактор, С-реактивный белок, титр АСТЛ-О не обнаружены; антиядерные антитела (полуколичественный анализ) 0,5; антитела к двуспиральной ДНК — 6,5; антитела к односпиральной ДНК — 7,5 (количественное исследование). Биохимия крови без патологии, кроме увеличения уровня непрямого билирубина до 16,4 мкмоль/л; общего до — 17,9 мкмоль/л; АлАТ до 89,4 ед/л.
Рентгенография органов грудной клетки — без патологии. ЭФГДС: недостаточность кардии; очаговый поверхностный гастрит (антральный отдел желудка). Заключение УЗИ органов брюшной полости, почек и щитовидной железы: признаки диффузных изменений печени (жировой гепатоз?, реактивные изменения?). Рекомендован контроль УЗИ печени через 6 мес. Заключение специалистов: ЛОР, невропатолог, хирург — здоров. Окулист: сложный дальнозоркий астигматизм, амблиопия слабой степени левого глаза. Гастроэнтеролог: стеатогепатит низкой активности.

Биопсия с очага на грудной клетке (рис. 2.), Рисунок 2. Гистопатологическая картина ОСД у больного Г., 34 лет. Значительное истончение эпидермиса с атрофией сосочков; мономорфный коллагеноз дермы с очаговой лимфоидной инфильтрацией, редукция сальных и потовых придатков кожи. Окраска гематоксилином и эозином, ув. 50. заключение: фиброматоз подкожной клетчатки с умеренным хроническим воспалением.
Дерматологический диагноз: ограниченная склеродермия.
Лечение в течение 2 нед (ксантинола никотинат 15% 2 мл внутримышечно ежедневно; трентал 400 мг 2 раза в сутки; эссенциале форте по 1 капсуле 3 раза в сутки, солкосерил 5% мазь 2 раза в сутки на очаги; фонофорез с пелоидином (гель ПО-КУР) клинических изменений не вызвало. На военно-врачебную комиссию офицер не представлялся. Взят на диспансерное наблюдение.
Больной В., 20 лет, солдат, поступил в июне 2009 г. с жалобами на слегка зудящие высыпания на голенях и в области коленных суставов, появившиеся в марте и увеличившиеся в количестве.

Результаты специальных исследований: клинический анализ крови без патологии, кроме относительной эозинофилии 8—11%; анализ мочи без патологических изменений; группа крови 0 (I) резус-положительная; RW — отрицательная, антитела к ВИЧ, НВS антиген, anti HCY не обнаружены; ревматоидный фактор и С-реактивный белок не обнаружены, титр АСТЛ-О 200 МЕ/мл; антиядерные антитела 1,0; гормоны щитовидной железы: ТЗ свободный — 5,66 пмоль/л; Т4 свободный — 10,28 пмоль/л; ТТГ— 0,75 МЕ/мл; антитела к тирепероксидазе — менее 0,16 МЕ/мл. Инцизионная биопсия с очага на голени (рис. 4, а—в), Рисунок 4. Гистопатологическая картина ОСД у больного В., 20 лет. Истончение эпидермиса, редукция сосочков; поля гиалиноза коллагеновых волокон-пучков, с частичным замещением подкожной клетчатки и участки гомогенизации коллагена дермы; диффузно-очаговая лимфоцитарная инфильтрация (и вокруг сосудов); редукция сальных, потовых, волосяных придатков кожи. Окраска гематоксилином и эозином, ув.100 (а, б); ув. 200 (в). заключение: гистологическая картина не противоречит клиническому диагнозу. Рентгенография органов грудной клетки — без патологии; придаточных пазух носа: недоразвитие лобной пазухи. Снижение пневматизации клеток решетчатого лабиринта. При УЗИ органов брюшной полости и почек патологии не выявлено; паренхима щитовидной железы эхонеоднородна за счет анэхогенных множественных образований размерами до 5 мм. Объем щитовидной железы в пределах возрастной нормы. Заключение: ультразвуковые признаки множественных коллоидных кист щитовидной железы. Эндокринолог: коллоидный зоб, эутиреоз. Дерматологический диагноз: ОСД.
В результате проведенного лечения (за время обследования): курс пенициллина, антигистаминная терапия, эутирокс, физиотерапия — очаги остались прежних размеров, но исчезли границы в виде сиреневого валика, явления атрофии сохраняются (рис. 3, ж).
Решением военно-врачебной комиссии больной признан: В — ограниченно годен к военной службе. Заболевание получено в период военной службы.
У одного больного могут быть представлены различные формы ОСД и даже системной склеродермии, что подтверждает мнение о единстве этих форм заболевания. Очаги могут находиться в различной стадии развития [4—8].
Дифференциальный диагноз атрофодермии Пазини—Пьерини с бляшечной склеродермией представляет лишь академический интерес и основывается на отсутствии мраморно-белых, деревянистой плотности бляшек с сиреневым венчиком и склероза дермы, характерных для склеродермии [6].
Течение ОСД медленное, с прогрессированием склероза кожи. Несмотря на различную клиническую картину в обоих случаях первые проявления ОСД возникли в юношеские годы и в дальнейшем медленно прогрессировали в виде появления новых очагов. У офицера по сравнению с солдатом отмечается более длительный анамнез и по гистологической картине явления фиброза более выражены. Профилактика ОСД заключается в диспансерном наблюдении и лечении для предотвращения рецидивов и утяжеления заболевания.

Цель. Изучить уровень и активность фактора фон Виллебранда (von Willebrand factor, vWF) у больных с периферическим атеросклерозом при выполнении эндоваскулярных или открытых операций на артериях нижних конечностей.
Материалы и методы: в исследование включено 115 пациентов с хронической ишемией нижних конечностей IIб – IV стадий заболевания по А.В. Покровскому-Фонтейну. 55 больным выполнены эндоваскулярные вмешательства на артериях нижних конечностей, 60 – открытые шунтирующие. Всем пациентам до и через 3 месяца после проведенного лечения выполнен забор периферической крови для оценки уровня – антигена (АГ) vWF и активности vWF. В течение года больные наблюдались каждые 3 мес. для оценки развития неблагоприятных исходов, включая прогрессирование заболевания, рестеноз, тромбоз зоны реконструкции, онкологическое заболевание, инфаркт миокарда (ИМ), потерю конечности, инсульт и летальные исходы.

Рис. 1. Антиген vWF до и после вмешательств в изучаемых группах (n = 115).
Антиген vWF был ниже у пациентов группы эндоваскулярного лечения по сравнению с лицами, которым потребовались шунтирующие операции и составил 0,90 (0,20; 95% доверительный интервал (ДИ) 0,83–0,97) мкг/мл и 1,04 (0,22; 95% ДИ 0,98–1,12) мкг/мл, соответственно (р

Рис. 2. Активность vWF до и после вмешательств в изучаемых группах (n = 115).
У пациентов группы эндоваскулярных операций активность vWF среди лиц, у которых в течение года развился ИМ, при включении в исследование существенно превышала активность vWF по сравнению с теми, у которых не развился ИМ, составив 1200 (95% ДИ 900–1200) % и 300 (95% ДИ 160–800) % соответственно (р = 0,022). Повышенная активность vWF отмечались среди лиц после эндоваскулярного лечения, у которых в течение года наблюдения развился летальные исходы: активность vWF при включении в исследование в случае развития летального исхода составила 1200 (95% ДИ 640–1200) % по сравнению с пациентами, доступными к контакту к окончанию года наблюдения — 300 (95% ДИ 160–600) % (р = 0,009).
У больных группы открытых операций активность vWF в срок 3 мес. была статистически значимо выше при подвздошно-бедренной окклюзии по сравнению с бедренно-подколенной и составила 1200 (95% ДИ 640–1200) % и 600 (95% ДИ 160–1200) % соответственно (р = 0,045). Несмотря на снижение активности vWF в срок 3 мес., она оставалась существенно выше по сравнению с нормальными показателями (70–150%, рис. 2). В срок 3 мес. после оперативного вмешательства активность vWF статистически значимо различалась среди пациентов с разными стадиями заболевания, составив 160 (95% ДИ 150–320) % при IIб стадии заболевания, 640 (95% ДИ 300–1200) % — при III стадии и 770 (95% ДИ 320–1200) % — при IV стадии (p

Рис. 3. ROC-кривая в прогностической модели зависимости активности vWF и развития летального исхода в группе эндоваскулярных операций.
Значимость модели — 0,01. Пороговое значение vWF в точке cut-off, определенное с помощью индекса Юдена, — 620%. Таким образом, при значении vWF, равном или выше точки cut-off (620%), прогнозируется летальный исход. Чувствительность и специфичность метода — 83,3 и 75,5%, соответственно.
Таким образом, нами было выявлено, что АГ и активность vWF повышены у пациентов с периферическим атеросклерозом. При этом, они были тем выше, чем более распространенным было поражение артериального русла и тяжелее степень ишемии конечностей. Кроме того, высокая активность vWF регистрировалась у больных, которым выполнялись эндоваскулярные операции и у которых, при этом, в течение последующего года развились острый ИМ и летальный исход.
Ряд опубликованных в последнее время работ также свидетельствует о важной роли vWF у больных с атеросклерозом. Так, Т. Nowakowski, et al. (2019) опубликовали результаты исследований, где описали повышение уровня vWF у пациентов с периферическим атеросклерозом, особенно у пациентов в группе рестеноза. Несмотря на то что ни наше исследование, ни предыдущие испытания не находили четкой ассоциации между vWF и рестенозом у пациентов с периферическим атеросклерозом, Т. Nowakowski, et al. не исключают, что повышенные уровни vWF отражают тяжесть эндотелиальной дисфункции и могут влиять на развитие рестеноза [7].
Полученные нами данные по связи повышенных АГ и активности vWF у пациентов с периферическим атеросклерозом, у которых в течение года развились ИМ и/или летальный исход, не противоречат мировым литературным данным, согласно которым vWF рассматривается в качестве важного прогностического маркера развития больших сердечно-сосудистых событий, что, согласно нашему исследованиям, справедливо и для пациентов с периферическим атеросклерозом [8]. Роль vWF как предиктора развития ИМ может быть объяснена его биологическими свойствами и эффектами: vWF способствует адгезии тромбоцитов к эндотелию и защите фактора коагуляции VIII от протеолиза протеином С, тем самым определяя тромбоцитарный и фибриновый компоненты тромбоза.
Таким образом, vWF отражает тяжесть течения периферического атеросклероза и играет важную роль в патогенезе ишемической болезни сердца, в частности, ИМ; vWF может стать потенциальной терапевтической мишенью, оказывающей влияние на тактику ведения пациентов с мультифокальным атеросклерозом [9–11].
Выводы
- У пациентов с периферическим атеросклерозом повышены антиген и активность фактора фон Виллебранда, при этом степень их повышения соответствует распространенности поражения артериального русла и тяжести ишемии конечностей с максимальными величинами при многоуровневом поражении артерий нижних конечностей и IV стадии заболевания.
- Повышенные антиген и активность фактора фон Виллебранда характеризовались развитием инфаркта миокарда и летальных исходов в течение года наблюдения у больных после эндоваскулярных операций на артериях нижних конечностей.
ДОПОЛНИТЕЛЬНО
Финансирование. Бюджет Рязанского государственного медицинского университета им. акад. И.П. Павлова, исследовательский грант ESVS.
Вклад авторов: Калинин Р.Е., Сучков И.А. — концепция и дизайн исследования, редактирование, Мжаванадзе Н.Д. — дизайн и концепция исследования, сбор и обработка материала, статистическая обработка, написание текста, редактирование, перевод, Журина О.Н., Климентова Э.А. — сбор и обработка материала, Поваров В.О. — статистическая обработка, редактирование.
Читайте также:

