За что ответственны рибосомы бактериальной клетки
Обновлено: 25.05.2024
Во всех живых организмах, от простейших бактерий до человека, белки синтезируются специальными клеточными устройствами рибосомами. На этих уникальных фабриках происходит образование белковой цепи из отдельных аминокислот.
В клетках, ведущих интенсивный белковый синтез, рибосом очень много: так, в одной бактериальной клетке содержится около 10 тыс. этих минифабрик, составляющих до 30% общей сухой массы клетки! В клетках высших организмов рибосом содержится меньше — их число зависит от типа ткани и уровня метаболизма клетки.
О генетическом коде
Программа, задающая последовательность аминокислотных остатков в белке, записана в геноме клетки: около полувека назад было установлено, что аминокислотные последовательности всех белков непосредственно закодированы в ДНК с помощью так называемого генетического кода. Согласно этому коду, универсальному для всех живых организмов, каждой из двадцати существующих аминокислот соответствует свой кодон — тройка нуклеотидов, представляющих собой элементарные единицы цепочки ДНК. Любой белок закодирован в ДНК определенной последовательностью кодонов. Эта последовательность называется геном.
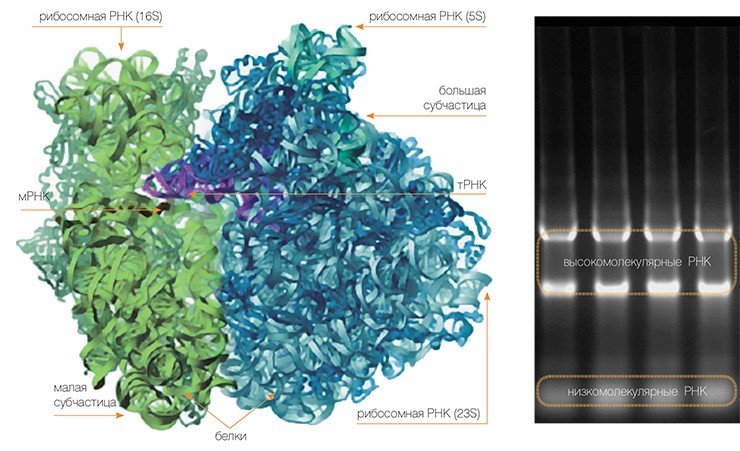
Одна клетка может содержать до 10 тыс. рибосом — белковых минифабрик, составляющих до 30% сухой клеточной массы
Как же эта генетическая информация доходит до рибосомы? На отдельном гене, как на матрице, синтезируется цепь еще одной информационной молекулы — рибонуклеиновой кислоты (РНК). Этот процесс копирования гена, называемый транскрипцией, осуществляется специальными ферментами — РНК-полимеразами.
В результате получается матричная РНК (мРНК), которая и используется рибосомами в качестве программы для синтеза белка. Сам синтез, т.е. перевод генетической информации с языка нуклеотидной последовательности мРНК на язык аминокислотной последовательности белка, называется трансляцией.
Декодирование и синтез
В клетках эукариот одну мРНК обычно транслирует сразу множество рибосом, образуя так называемые полисомы, которые можно отчетливо видеть с помощью электронной микроскопии, позволяющей получать увеличение в десятки тысяч раз.

Сама рибосома — одна из самых сложно организованных молекулярных машин клетки — состоит из двух неравных частей, так называемых субчастиц (малой и большой). Ее можно легко разделить на части центрифугированием при сверхвысоких скоростях в специальных пробирках с раствором сахарозы, концентрация которой увеличивается сверху вниз. Поскольку малая субчастица в два раза легче большой, они движутся от верха пробирки к дну с разными скоростями.
Малая субчастица отвечает за декодирование генетической информации. Она состоит из высокомолекулярной рибосомной РНК (рРНК) и нескольких десятков белков (около 20 у прокариот и более 30 — у эукариот).
В раковых клетках резко повышается уровень некоторых рибосомных белков. Возможная причина — сбои в механизмах авторегуляции их производства
Большая субчастица, ответственная за образование пептидной связи между аминокислотными остатками, состоит из нескольких рРНК: одной высокомолекулярной и одной (или двух в случае эукариот) низкомолекулярной, а также нескольких десятков белков (более 30 у прокариот и до 50 у эукариот). О масштабе деятельности рибосом можно судить хотя бы по тому факту, что рибосомная РНК составляет около 80 % всей РНК клетки, тРНК, транспортирующая аминокислоты, — около 15 %, тогда как матричная РНК, несущая информацию о белковой последовательности, — лишь 5 %!
Кроме того, чересчур интенсивный синтез некоторых рибосомных белков может свидетельствовать о развитии злокачественной трансформации клетки. Например, значительное повышение уровня пяти рибосомных белков было обнаружено в опухолевых клетках толстого кишечника (Zhang et al., 1999). Недавно сотрудниками лаборатории структуры и функции рибосом ИХБФМ СО РАН был открыт новый механизм авторегуляции биосинтеза рибосомных белков у человека, основанный на принципе обратной связи. Неуправляемый синтез рибосомных белков, характерный для опухолевых клеток, вероятно, вызван сбоями именно в этом механизме. Дальнейшие исследования в этой области представляют особый инте¬рес не только для ученых, но и для медиков.
Удивительно, но, несмотря на миллиарды лет эволюции, разделяющие бактерии и человека, вторичная структура рибосомальных РНК у них мало различается.
О том, как уложена рРНК в субчастицах и каким образом она взаимодействует с рибосомными белками, до недавнего времени было известно не много. Революционный сдвиг в понимании устройства рибосомы на молекулярном уровне произошел на рубеже нового тысячелетия, когда с помощью рентгеноструктурного анализа удалось расшифровать на уровне отдельных атомов структуру рибосом простейших организмов и их модельных комплексов с мРНК и тРНК. Это позволило понять молекулярные механизмы декодирования генетической информации и образования связей в молекуле белка.
Оказалось, что оба важнейших функциональных центра рибосомы — как декодирующий на малой субчастице, так и отвечающий за синтез белковой цепочки на большой субчастице — сформированы не белками, а рибосомной РНК. То есть, рибосома работает подобно рибозимам — необычным ферментам, состоящим не из белков, а из РНК.
Сама рабочая схема белкового цикла в принципе одинакова для рибосом всех живых существ. Однако до сих пор неизвестно, до какой степени схожи молекулярные механизмы работы рибосом у разных организмов. Особенно не хватает информации об устройстве функциональных центров рибосом высших организмов, которые изучены гораздо хуже, чем рибосомы простейших.
От низших — к высшим
И все-таки способы получения сведений о строении функциональных центров рибосом высших организмов существуют. Одним из таких методов является метод химического аффинного сшивания, разработанный 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.
Метод аффинного химического сшивания был разработан 35 лет назад в отделе биохимии НИОХ СО АН СССР (ныне ИХБФМ СО РАН) под руководством академика Д. Г. Кнорре.До появления рентгеноструктурного анализа рибосом он использовался во всем мире для изучения рибосом у прокариот.
Этот метод и сегодня является основным для изучения структурно-функциональной организации рибосом высших организмов
Достоинство этого метода в том, что сшивающую группу можно присоединить практически к любому нуклеотидному остатку мРНК и в результате получить детальную информацию о его окружении на рибосоме. Используя набор коротких мРНК с разным расположением сшивающей группы, нам удалось определить рибосомные белки и нуклеотиды рРНК рибосомы человека, образующие канал для считывания генетической информации в процессе трансляции.
Почему же, несмотря на то, что функция рибосомы практически не изменилась в процессе эволюции, в организации декодирующего центра рибосом у высших организмов появились специфичные черты? Вероятно, это связано с более сложной и многостадийной регуляцией белкового синтеза у эукариот по сравнению с прокариотами, в ходе которой рибосомные белки мРНК-связывающего канала могут взаимодействовать не только с мРНК, но и с различными факторами, влияющими на эффективность и точность трансляции. Так ли это, покажут дальнейшие исследования.
Сколько рибосом в клетке?

. "]">Рис. 1. Микрофотография бактериальной клетки, полученная с помощью электронного микроскопа. Различные части клетки выделены соответствующими цветами. Источник.
У млекопитающих количество рибосом еще более впечатляющее — в одной клетке их содержится порядка 10 миллионов!
Внешний вид рибосом
Под микроскопом рибосомы выглядят как компактные частички порядка 20–30 нм в диаметре (рис. 2).

."]">Рис. 2. Микрофотография, полученная с помощью сканирующего электронного микроскопа. Рибосомы выглядят, как маленькие плотные частички. При таком разрешении не видно, что рибосомы состоят из двух субъединиц. Источник.

"]">Рис. 3. Рибосома состоит из двух субъединиц — большой и малой. Большая субъединица примерно в два раза больше по массе, чем малая. Источник.
Рибосомы прокариот и эукариот отличаются между собой. Первое отличие, которое мы рассмотрим, касается их массы (рис.3).

."]">Рис. 3. Сравнение масс и констант седиментации прокариотической и эукариотической рибосомы. Источник.
Прокариотическая рибосома (рис.3) имеет молекулярную массу 2,5 млн Дальтон (4,15х10^(-18) грамм). Исследования методом центрифугирования (рис.4) показали, что у целой рибосомы коэффициент седиментации — 70S (часто прокариотические рибосомы так и называют — 70S рибосомы). S — это Сведберг, единица коэффициента седиментации. Большая субъединица имеет коэффициент седиментации 50S, а малая — 30S.
! Обратите внимание. При соединении 50S субъединицы и 30S субъединицы константа седиментации целой прокариотической рибосомы получается не 80S, как можно было бы подумать, а 70S. Это происходит потому, что седиментация (осаждение) при центрифугировании зависит не только от массы, но и от формы частицы. Поэтому, когда две субъединицы объединяются в целую рибосому, происходит не просто суммирование их масс, но и появление новой формы, которую нельзя рассматривать как сумму составляющих ее частей. То же самое справедливо и для эукариотической рибосомы.
Эукариотическая рибосома (рис.3) имеет молекулярную массу 4,2 миллиона Дальтон (6,97х10^(-18) грамм). Константа седиментации целой рибосомы — 80S, большой субъединицы — 60S, малой субъединицы — 40S.
Как вы могли заметить из предыдущих рисунков, ни целая рибосома, ни её субъединицы не являются по форме шариками, а имеют сложную структуру. Давайте немного подробнее рассмотрим морфологию рибосомальных субъединиц (рис. 5).

Помимо формы и размера большая и малая субъединица отличаются своими функциями. Важнейшая функция большой субъединицы — образование пептидной связи (рис.6). Малая субъединица ответственна за правильное декодирование триплетов иРНК. Ни большая, ни малая субъединица не могут работать по отдельности, для трансляции обязательно требуется их объединение.

Из каких молекул состоит рибосома
Рибосомы по своей природе являются нуклеопротеидами и состоят из РНК и белков.
Сначала рассмотрим рибонуклеиновый компонент рибосом. РНК, которая находится в рибосоме, называется рРНК, на её долю приходится примерно 80% от всей РНК в клетке. Рибосомальная РНК выполняет в рибосоме важнейшие функции, в том числе катализирует образование пептидной связи. Это может показаться очень странным, ведь обычно за катализ химических реакций в клетке отвечают ферменты — белки, а это другой класс соединений. Тот факт, что в рибосоме основную функцию выполняют именно РНК, является одним из аргументов в пользу гипотезы РНК-мира. Возможно, что рибосома изначально вообще состояла только из РНК, а белки присоединились к ней позднее в ходе эволюции (см. статью).
В рибосоме содержится несколько видов молекул рРНК. Молекулы рРНК у эукариот и прокариот гомологичны, то есть схожи между собой, однако имеются и некоторые отличия.
В большой субъединице у прокариот содержатся два вида рРНК — 23S и 5S рРНК. 23S рРНК ответственна за катализ образования пептидной связи. Зачем нужна 5S рРНК, до сих пор непонятно, хотя на этот счет выдвигаются разнообразные гипотезы.
У эукариотических рибосом 4 вида рРНК: 5S, 5.8S,18S и 28S РНК . В малой субъединице находится 18S рРНК (она гомологична 16S рРНК прокариот). У эукариот нет последовательности Шайна-Дальгарно, и 18S рРНК, похоже, напрямую не связывается с иРНК (в отличие от прокариотической 16S рРНК). В целом у эукариот связывание рибосомы с иРНК и другие стадии трансляции проходят несколько иначе, чем у прокариот, но об этом вы узнаете из наших следующих статей.
В большой субъединице находятся три молекулы рРНК. 5S рРНК гомологична такой же рРНК у прокариот. 5.8S и 28S РНК гомологичны 23S рРНК прокариот и, по сути, являются двумя отдельными ее кусочками.
Как и все другие РНК (за исключением РНК некоторых вирусов), рРНК синтезируются на матрице ДНК с использованием ферментов РНК-полимераз. У бактерий один и тот же вид РНК-полимеразы транскрибирует все виды РНК. У эукариот РНК-полимераз несколько. РНК-полимераза III синтезирует 5S рРНК, а все другие виды рРНК транскрибируются РНК-полимеразой I. Из-за этого факта некоторые ученые предполагают эволюционное родство 5S рРНК и тРНК, которые синтезируются той же РНК-полимеразой.
Все сказанное о рРНК бактерий и эукариот суммировано в таблице 1.

Рибосомальные РНК имеют очень сложную пространственную структуру. Чтобы убедиться в этом, посмотрите на рисунок 7. В качестве примера здесь показана структура 16S рРНК. Обратите внимание на многочисленные шпильки — самокомплементарные участки РНК, которые обеспечивают ее сворачивание и стабилизируют эту сложную структуру. В линейном виде рРНК не может выполнять свои функции.

"]">Рис. 7. Структура 16S рибосомальной РНК (А). Для сравнения показана структура тРНК (В). Источник.
Особенностью рРНК также являются химические модификации нуклеотидов. У рРНК модифицированы около 2% всех нуклеотидов, и это необходимо для правильного сворачивания рРНК и выполнения ею своих функций. Модификации рРНК происходят при созревании рибосом. Для осуществления некоторых модификаций необходимы другие виды РНК, например, малая ядрышковая РНК. Примеры химических модификаций нуклеотидов рРНК представлены на рисунке 8.

"]">Рис. 8. Две наиболее часто встречающиеся химические модификации нуклеотидов рРНК. Сверху — присоединение метильной группы к рибозе. Снизу — изомеризация уридина, заключающаяся в повороте его основания на 180 градусов — псевдоуридинилирование. Обе эти модификации протекают с участием малых ядрышковых РНК. Источник
Второй вид молекул, из которых состоят рибосомы, это белки. Они синтезируются в цитоплазме (с помощью рибосом, как и все другие белки), затем проходят через ядерные поры в ядро. В ядре идёт сборка рибосом, и рибосомальные белки, уже в составе рибосомы, снова возвращаются в цитоплазму. Вот такой сложный у них жизненный путь.

."]">Рис. 9. Сравнение рибонуклеинового и белкового состава прокариотических и эукариотических рибосом. Источник.
Внутреннее строение рибосом
Внутри рибосомы выделяют следующие важные части (рис.10):
- сайт связывания иРНК;
- туннель для выхода белка.


Рис. 11. Схема образования пептидной связи. Реакцию катализирует пептидилтрансфераза, ее каталитический центр представляет собой участок молекулы рРНК.
В строении рибосомы можно выделить еще и другие важные области — это места связывания с факторами трансляции. Факторы трансляции — это особые белки, которые необходимы для инициации, элонгации и терминации трансляции, без них рибосома функционировать не может. Подробнее о роли этих факторов мы расскажем в статье, посвященной трансляции.
Источники
1) Farber FE, Rawls WE. Isolation of ribosome-like structures from Pichinde virus. J Gen Virol. 1975 Jan;26(1):21-31. doi: 10.1099/0022-1317-26-1-21. PMID: 1168240.
3) Г.М. Гонгадзе Г.М. 5S рРНК И РИБОСОМА // Успехи биологической химии, Т. 51, 2011, С. 165–192.

Рибосо́ма — важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
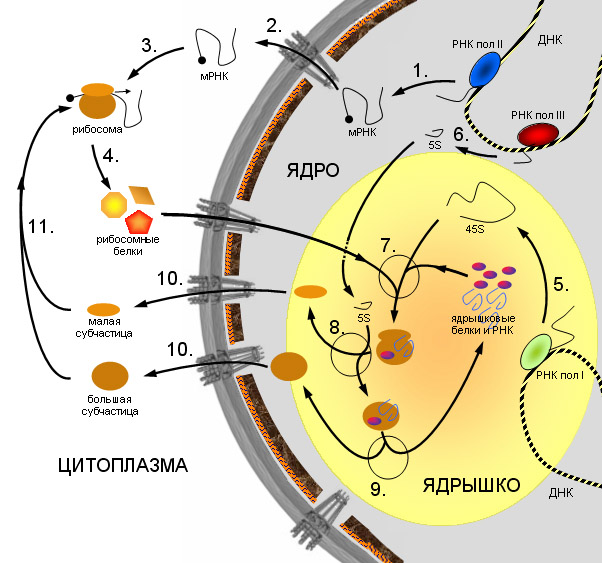

Схема синтеза рибосом в клетках эукариот.
1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Рибосомы представляют собой нуклеопротеид, в составе которого отношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5.8S и 28S рРНК синтезируются в ядрышке РНК полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируется РНК полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), бактериальных клеток (а также митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Содержание
История исследований рибосомы

В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы. [3]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3'-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5'-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК находится в P- (peptidyl-) сайте каталитического(пептидил-трансферазного) центра рибосомы. Следующая тРНК, несущая на 3'-конце аминокислоту и комплементарная второму кодону на мРНК, помещается с помощью фактора EF-Tu в А- (aminoacyl-) сайт каталитического центра рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-сайте) и аминокислотой, принесенной тРНК, находящейся в А-сайте. Механизм катализа образования пептидной связи в пептидил-трансферазном центре до сих пор полностью не ясен. На данный момент существует несколько гипотез, объясняющих детали этого процесса: 1. Оптимальное позиционирование субстратов (induced fit) [5] , 2. Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза [6] , 3. Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона [7] [8] , 4. Участие 2'-гидроксильной группы 3'-концевого нуклеотида тРНК (А76) в переносе протона [9] ;. Высокая эффективность катализа достигается взаимодействием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Изучение основных процессов, которые поддерживают существование органической жизни, ведется в разных направлениях. Львиная доля исследований приходится на молекулярную биологию и микробиологию. Как уже сейчас ясно, здоровье и жизнь многоклеточных сложных организмов по большей части зависит от тех операций, которые протекают внутри клеток. Изучение внутриклеточных метаморфоз – трудоемкое занятие, поскольку клетка многоклеточного эукариота не может жить жизнью отдельного организма. Жизнь эукариотов изучается, в том числе, и на базе знаний о простейших и бактерий. Так, рибосомы простейших бактерий очень похожи и по строению, и по функциям с ядерными клетками.

Изучая рибосомы в составе бактерий, человек получает не только важные знания о сложном процессе синтеза белка из аминокислот в органической клетке, но и добывает инструменты в борьбе со многими болезнями. Именно рибосомные нуклеопротеиды бактерий дают информацию о механизмах воздействия антибиотиков на патогенные микроорганизмы (вирусы, бактерии и т.д.).
Основная роль
В клетке бактерии рибосома выполняет функцию формировщика молекул белка. Ее строение обуславливает сложный процесс биосинтеза.
Суть работы нуклеопротеида заключается в том, что с его помощью на базе матричных РНК, с использованием транспортных РНК, производятся сложные полипептидные соединения, без которых бактериальная клетка не может продолжать свое существование.
Матричная и транспортная РНК не являются частью рибосомы, а содержатся в цитоплазме бактериальной клетки.
Таким образом, в синтезе белка принимает участие три клеточных структуры:
- матрица;
- транспортная РНК;
- рибосома.
Методы изучения
Современные биологические лаборатории имеют широкие возможности для изучения клетки и ее органоидов.
В сравнении с рибосомами эукариот, эти органоиды у прокариотов очень мелкие. Хотя в остальном эти составляющие клеток и бактерий и эукариотов очень похожи. Они также состоят из двух субчастиц, и сам процесс синтеза белка имеет массу схожих механизмов.

В связи с тем, что рибосомные нуклеопротеиды представляют одну из наиболее интересных человеку структурных единиц клетки, сегодня есть достаточно методов выявления закономерностей устройства и функционирования этого органоида.
Одним из самых широко используемых методов выявления нуклеопротеидов в бактериях является рибосомальный профилинг.
Этот метод выполняют следующим образом:
- Разрушение бактериальной клетки путем механического воздействия на нее. Химические реакции в данном случае исказят картину.
- Разрушение молекул РНК, которые не входят в состав рибосомы.
- Удаление всех полипептидных остатков из тех продуктов, которые были получены в результате разрушения.
- Обратное преобразование РНК в ДНК.
- Чтение аминокислотных последовательностей.
Само секвенирование может реализовываться с помощью нескольких методов, в частности, двух самых распространенных.
Метод Эдмана
Один из первых разработанных. Суть этого метода состоит в том, что пептид (белок) обрабатывают определенными реагентами, в результате чего происходит отщепление аминокислоты, из которой состоит белок.
Метод Сэнгера
Наиболее современный метод. Основан на использовании синтетического олигонуклеотида (олигонуклеотиды состоят более чем из двух нуклеиновых кислот).
Используемый метод позволяет идентифицировать все, даже наиболее мелкие участки РНК, которая исследуется. Благодаря получению полной информации об аминокислотах исследователи имеют возможность восстанавливать наиболее важные операционные моменты биосинтеза.
Большое значение эта информация имеет при исследовании реакции бактерий на антибиотики.
Строение
На данный момент наука имеет убедительное количество проверенных опытным путем сведений о строении рибосом бактерий и эукариотов.

Это макромолекулярный комплекс, который состоит из двух субчастиц разной величины:
- малая субчастица;
- большая субчастица.
Малая рибосома состоит из одной рибосомной РНК и трех десятков разных белков. Основная функция малой субчастицы состоит в том, чтобы связывать нуклеопротеид с матричной РНК (мРНК).
В течение всего процесса инициации и элонгации (присоединение мономеров к цепи макромолекулы) малая субчастица удерживает мРНК. Кроме того, она обеспечивает прохождение матрицы через нуклеопротеоид.
Таким образом, малая субчастица выполняет генетическую функцию декодирования информации.
В большой субчастице содержится 3 рибосомных РНК и около 50 белковых соединений. Большая субчастица с матрицей не вступает в контакт, она ответственна за протекание химических процессов в нуклеопротеидах при образовании полипептидных связей в транслируемом полипептиде.
Процесс трансляции
Процесс синтезирования белка (как у бактерий, так и эукариотов) имеет следующий цикл:
- инициация;
- элонгация;
- терминация.
Инициация
Инициация начинается с того, что к малой субчастице рибосомы присоединяется матричная РНК.
Если рибосомная макромолекула узнает тот трехбуквенный кодон, который есть на мРНК, то происходит присоединение антикодона тРНК.
Элонгация
Присоединений аминокислот, которые принесла тРНК и продвижение рибосомы вдоль матрицы с высвобождением молекулы тРНК.
Движение по мРНК осуществляется до тех пор, пока оно не достигает стоп-кодона, который имеется во всех матрицах.
Терминация
Новообразованный белок, который состоит из протранслированных аминокислот, отсоединяется.
В некоторых случаях завершение трансляции новообразованного белка сопровождается распадом (диссоциацией) рибосомы.
Отличия синтеза белка в клетках эукариотов
Несмотря на то, что рибосомы эукариотов состоят из тех же структурных частей, что и в клетках бактерий, синтез полипептидов эукариотов имеет свои особенности:
- Отличия в механизме инициации (узнавании кодонов и подборе антикодонов).
- Отличия на стадии терминации. У эукариотов в некоторых случаях после завершения синтеза белка и образования новой молекулы эта молекула не отсоединяется, а начинает инициацию заново.
Антибиотики
Воздействие на бактерию антибиотиками наиболее губительно сказывается на работе рибосом. Антигены, которые содержатся в антибиотиках, ингибируют все стадии трансляции белка, в результате чего белок не может нормально синтезироваться, в клетке прекращаются все обменные процессы, а также процессы, связанные с ростом и с размножением организма.
Работаю врачом ветеринарной медицины. Увлекаюсь бальными танцами, спортом и йогой. В приоритет ставлю личностное развитие и освоение духовных практик. Любимые темы: ветеринария, биология, строительство, ремонт, путешествия. Табу: юриспруденция, политика, IT-технологии и компьютерные игры.

спасибо вам за столь подробную информацию. очень полезно, просто и и нформативно
Лучшие лаборатории США уже несколько лет занимаются изучением ДНК и техники для генного конструирования. Самые популярные разработчики выращивают светящихся в темноте котят и флюоресцирующие растения. Но есть и страшные перспективы, медики и генные инженеры изобретают опасные для жизни соединения в военных целях. Как защищаться в случае утечки опасных материалов? Аварии на предприятиях с радиоактивными материалами не научили человечество понимать, что страшное когда-нибудь обязательно случится.
Радиацию мы хотя бы определим дозиметром, а что будет, если вырвутся на свободу генно-модифицированные опасные бактерии? Защищаться можно лишь там, где есть специалисты, который вовремя найдут опасные составляющие. И те, кто будет создавать интерес к науке с психологической установкой на выживание. Поэтому любые научные дискуссии, которые покажут уважение к мирному развитию науки, интересны. Они – не только как пища для ума, но и формирование системы защиты человечества. На сайте Проекта НПО АТ есть много данных по грантам на такие исследования.
Валерия, как бы мы не старались защитить себя и свою планету, но всегда были и будут, как говорится, “злые” гении, которые нарочно или случайно в процессе опытов и исследований создают такие вещи, существование которых, увы, может нанести человечеству и всему живому непоправимый вред. Идеи гуманизма, сохранение целостности и самобытности природы давно уже не являются ведущими направлениями. Ослеплённые жаждой денег, власти, контроля, люди в конечно итоге рискуют уничтожить самих себя, а виной тому будут фатальные опыты над микроорганизмами. Природа и без нас гениальна, всё продумано до мелочей, но человек всегда желает большего.
Эта статья отбросила меня в школьные годы на уроки биологии 10 класс. Материал сложноват для восприятия, но главное я поняла одно: рибосомы бактерий необходимо изучать для того, чтобы понимать механизмы, которые способны погубить эту клетку. А это важно: ученым нужно разрабатывать все более новые и новые лекарства для борьбы с “плохими” для здоровья человека бактериями.
Читайте также:

