У элементов одной группы происходит закономерное изменение свойств чем больше
Обновлено: 16.05.2024
В целом, внешние структуры атомов периодически повторяются.
По электронному строению элементы делят на группы:
s-элементы – последним заполняется s-подуровень, предыдущие энергетические уровни полностью заполнены, на внешнем энергетическом уровне находятся 1 или 2 электрона. Это элементы I периода Периодической системы: водород и гелий и элементы главных подгрупп 1 и 2 группы: щелочные и щелочноземельные металлы.
К семейству р-элементов относят элементы, у которых последними заполняются р-орбитали. Это элементы главных подгрупп 3, 4, 5, 6, 7, 8 групп.
У d-элементов электроны заполняют d-орбитали предвнешнего уровня. Это элементы побочных подгрупп, начиная с 4 периода.
Электроны, относящиеся к последнему (внешнему) заполняемому энергетическому уровню, называются внешними электронами. Именно эти электроны главным образом принимают участие в образовании химических связей. Но участие в образовании связей могут принимать и d-электроны предпоследнего (предвнешнего) уровня – они близки по энергии к электронам внешнего слоя. Валентные электроны – электроны, которые могут принимать участие в образовании химической связи, это электроны, относящиеся к последнему (или, для d-элементов, к последним) заполняемому энергетическому уровню.
Строение внешних энергетических уровней периодически повторяется, поэтому периодически повторяются и свойства химических элементов. Эта закономерность отражена в Периодическом законе Д. И. Менделеева.
Периодический закон и Периодическая система
химических элементов Д.И. Менделеева
В 1869 г. Дмитрий Иванович Менделеев увидел периодичность в свойствах простых веществ и их соединений по мере увеличения атомного веса. Открытие строения атома связало эту периодичность с количеством электронов в атоме и их распределением по энергетическим уровням.
Периодический закон Д.И. Менделеева (современная формулировка). Свойства элементов (простых веществ) и их соединений находятся в периодической зависимости от заряда ядра атома (порядкового номера) элемента.
Графическим отображением периодического закона является периодическая система (таблица) Д.И. Менделеева. На ЕГЭ к тексту задания предлагается классический (короткий) вариант таблицы, см. Приложение А [2].
Таблица состоит из горизонтальных и вертикальных рядов – периодов и групп. В коротком варианте 8 групп, они разделены на подгруппы – главные и побочные. Главные подгруппы начинаются с элемента 2 периода.
По номеру периода можно определить число энергетических уровней, заполненных электронами. Номер периода – это номер внешнего энергетического уровня n.
В большинстве случаев, по номеру группы можно определить число внешних электронов:
– для элементов главных подгрупп номер группы – это общее количество s и p электронов на внешнем энергетическом уровне n:
номер группы = ns + np
– для элементов побочных подгрупп номер группы – это общее количество s на внешнем энергетическом уровне и d электронов на предвнешнем (n–1), если он не заполнен:
номер группы = ns + (n–1)d
Например, элемент бериллий – элемент 2 периода, находится во второй группе, главной подгруппы. Внешний уровень – второй, на нем два s-электрона:
4Be 1s 2 2s 2
Элемент хлор – элемент 3 периода, находится в седьмой группе, главной подгруппы. Внешний уровень – третий, на нем два s-электрона и пять p-электронов:
17Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Элемент титан – элемент 4 периода, находится в четвертой группе, побочной подгруппе. Внешний уровень – четвертый, на нем два s-электрона, предвнешний – третий, на нем 2 d-электрона:
22Ti 1s 2 2s 2 2p 6 3s 2 3p 6 3d 2 4s 2
Элемент железо – элемент 4 периода, находится в восьмой группе, побочной подгруппе. Внешний уровень – четвертый, на нем два s-электрона, предвнешний – третий, на нем 6 d-электронов:
26Fe 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
В группе (сверху вниз):
– число электронов на последнем энергетическом уровне не изменяется;
– электроотрицательность, в целом, уменьшается (электроны внешнего слоя находятся дальше от ядра и для их отрыва требуется меньше энергии);
– металлические, восстановительные свойства усиливаются;
– неметаллические, окислительные свойства ослабевают;

– оснóвные свойства оксидов и гидроксидов усиливаются;
– кислотные свойства оксидов и гидроксидов ослабевают.
Таким образом, в группах формируются элементы со сходным электронным строением и проявляющие похожие (но не идентичные) свойства.
В периоде (слева направо):
– число энергетических уровней не меняется, количество электронов на данном энергетическом уровне увеличивается;
– радиусы атомов, в целом, уменьшаются (внешний электронный слой содержит больше электронов и сильнее притягивается к ядру);
– металлические, восстановительные свойства простых веществ уменьшаются;
– неметаллические, окислительные свойства усиливаются;
– оснóвные свойства оксидов и гидроксидов ослабевают;
– кислотные свойства оксидов и гидроксидов усиливаются.
Каждый период начинается элементом, в атоме которого впервые появляется электрон на энергетическом уровне, номер которого равен номеру этого периода. Заканчивается период элементом, в атоме которого до конца заполнен этот же энергетический уровень. Таким образом, период начинается типичным металлом (1 период – водородом), и заканчивается благородным газом.
Элементы, стоящие рядом в одном периоде, достаточно сильно отличаются по свойствам. В группах элементы имеют ряд общих свойств, у многих главных подгрупп есть название. Рассмотрим общие характеристики и характерные степени окисления для всех групп Периодической системы.

С помощью данного видеофрагмента учащиеся смогут узнать о причинах изменения металлических и неметаллических свойств в периодах и в группах.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности



Конспект урока "Изменение свойств элементов и их соединений в зависимости от положения в ПСХЭ Д. И. Менделеева"
Электронная конфигурация атомов химических элементов изменяется периодически с ростом зарядов их ядер, поэтому и все свойства, которые определяются электронным строением, закономерно изменяются по периодам и группам. К этим свойствам относятся: атомные и ионные радиусы, электроотрицательность и другие.

Условно форму атома или иона можно представить шарообразной, поэтому количественной характеристикой их размера служит радиус.
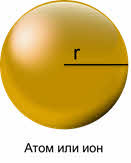
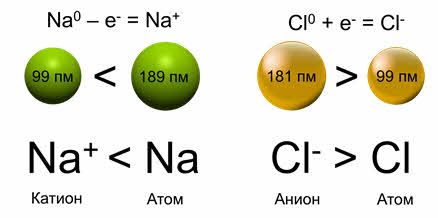
Различают атомные и ионные радиусы. Радиусы положительно заряженных ионов (катионов) всегда меньше радиусов атомов соответствующих элементов, так они отдают электроны, чтобы превратиться в катионы, а радиусы отрицательно заряженных ионов (анионов) больше радиусов атомов, потому что они образовались путём присоединения электронов к атомам.
Например, радиус атома натрия 189 пикометров, а иона натрия – 99 пикометров, радиус атома хлора 99 пикометров, а иона хлора – 181 пикометр.
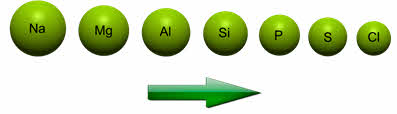
В периодах с увеличением зарядов ядер атомов, электроны сильнее притягиваются к ядру, что приводит к уменьшению радиусов атомов.
Например, у элементов третьего периода атомные радиусы уменьшаются от натрия к хлору.
Сравним строение атомов элементов, находящихся во втором периоде. Порядковый номер лития – три, азота – семь, фтора – девять, а неона – десять. Заряды ядер данных атомов, соответственно равны: у лития – плюс три, у азота – плюс семь, у фтора – плюс девять, у неона – плюс десять. Число электронов для каждого атома химического элемента равно значению заряда ядра, порядковому номеру и числу протонов в ядре. Значит у лития три электрона, у азота – семь, у фтора – девять, у неона – восемь.
Строение атомов элементов второго периода
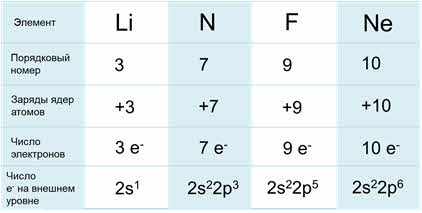
А чтобы определить, сколько электронов находится на внешнем уровне, необходимо посмотреть в какой группе Периодической системы находится данный химический элемент. Например, у лития на внешнем слое находится один электрон, так как он располагается в первой А группе. У азота на внешнем слое находится пять электронов, у фтора – семь электронов и у неона – десять электронов.
К концу второго периода количество электронов на внешнем энергетическом уровне возрастает.
Важно также знать, что число энергетических уровней атомов химических элементов равно номеру периода, в котором они находятся. У лития, азота, фтора и неона число энергетических уровней равно двум.
Атомный радиус к концу периода уменьшается, так как происходит взаимопритяжение ядра атома и электронов внешнего энергетического уровня.
В группах сверху вниз увеличивается число электронных слоёв, поэтому увеличиваются и радиусы атомов, и радиусы ионов. Например, в первой A группе идёт увеличения радиусов атомов: у лития – 155 пикометров, у натрия – 189 пикометров, у калия – 236 пикометров, радиус иона лития 68 пикометров, иона натрия – 99 пикометров, ионов калия – 138 пикометров.
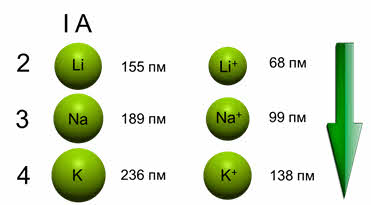
Рассмотрим изменение свойств для элементов второй группы главной подгруппы. Порядковый номер бериллия – четыре, у кальция – двадцать и у стронция – тридцать восемь. Сверху вниз по группе заряды ядер атомов увеличиваются. Количество электронов на внешнем энергетическом уровне остаётся неизменны, так как у всех химических элементов второй группы главной подгруппы на внешнем слое находится два электрона. К концу второй группы главной подгруппы количество энергетических уровней у атомов данных химических элементов постепенно возрастает, соответственно возрастает и атомный радиус.

Способность атомов отдавать электроны при увеличении атомного радиуса усиливается, а способность принимать электроны ослабевает. Значит, сверху вниз по группе металлические свойства увеличиваются.
Проявление металлических и неметаллических свойств связано со способностью присоединять или отдавать электроны.
Способности отдавать электроны количественно характеризуется энергией ионизации.
Энергия ионизации – это минимальная энергия, необходимая для отрыва от атома наиболее слабо связанного с ним электрона. Энергия ионизации выражается в килоджоулях на моль.
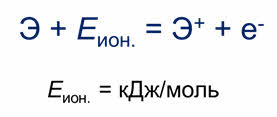
Наименьшую энергию ионизации имеют щелочные металлы, наибольшую – элементы седьмой A группы. Поэтому в периодах слева направо энергия ионизации увеличивается, так как увеличиваются заряды ядер и уменьшаются радиусы атомов.

В группах А сверху вниз энергия ионизации уменьшается, так как увеличивается расстояние между электронами внешнего слоя и ядром атома.

Вы знаете, что при отдаче электрона атом превращается в катион, поэтому энергия ионизации характеризует проявление металличности.
Для неметаллов, наоборот, характерна способность присоединять электроны, поэтому количественной характеристикой неметалличности является энергия сродства к электрону.
Энергия сродства к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому.
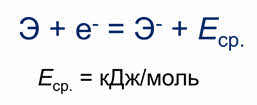
Следовательно, чем больше энергия сродства к электрону, тем легче атом присоединяет электрон. Эта величина также выражается в килоджоулях на моль.
Наибольшую энергию сродства к электрону имеют элементы седьмой A группы. Поэтому в периодах слева направо энергия сродства к электрону увеличивается, а в группах сверху вниз уменьшается.


Разберём, как же изменяется электроотрицательность по периодам и группам.
Электроотрицательность – это условная величина, характеризующая способность атомов в химических соединениях притягивать к себе электроны от других атомов.
Величина электроотрицательности зависит от энергии ионизации и от энергии сродства к электрону.

Для оценки этой способности принята условная шкала относительных электроотрицательностей. Здесь видно, что самым электроотрицательным является фтор, а наименее электроотрицательным рубидий.
Шкала электроотрицательности (Л. Полинг)
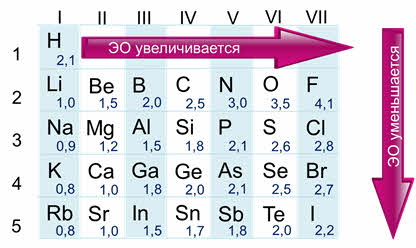
Как правило, у элементов А групп в периоде слева направо электроотрицательность возрастает, а в группах сверху вниз уменьшается. По величине электроотрицательности можно определить принадлежность элемента к металлам или неметаллам. Все неметаллы имеют большое значение электроотрицательности (больше двух), а у металлов это значение гораздо меньше (меньше двух). Элементы, у которых значение электроотрицательности близко к двум являются полуметаллами. Например, бор, кремний, германий, мышьяк, сурьма и тэллур.
Чтобы понять, в чем причина периодичности, сравним атомы элементов второй А группы. Порядковый номер бериллия четыре, номер двенадцать – у магния, номер двадцать – у кальция, номер тридцать восемь – у стронция.
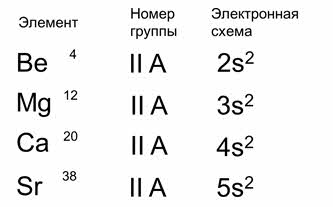
Во-первых, все эти элементы располагаются во второй группе главной подгруппе, имеют одинаковое строение внешнего энергетического уровня. Так, на внешнем энергетическом уровне у них по два электрона. Но электроны, которые находятся на внешнем энергетическом уровне расположены на разном удалении от их ядер. Поэтому активность у них разная, а свойства сходны. Это и есть причина периодичности – изменение строения внешнего и предвнешнего энергетических уровней и повторение числа электронов внешнего энергетического уровня.
А теперь, рассмотрим, как периодичность химических элементов сказывается на образуемых ими соединениях: оксидах и гидроксидах.
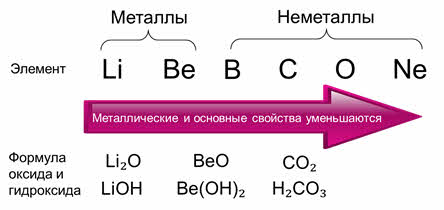
Литий и бериллий – это металлы, а бор, углерод, кислород и неон – это неметаллы. Значит, металлические свойства по периоду слева направо уменьшаются, а неметаллические усиливаются.
Литию соответствует оксид лития, который проявляет основные свойства, бериллию соответствует оксид бериллия, который проявляет амфотэрные свойства, углероду соответствует оксид углерода четыре, который проявляет кислотные свойства. Аналогично и гидроксиды: гидроксид лития проявляет основные свойства, гидроксид бериллия – амфотэрные свойства, а гидроксид углерода – угольная кислота – проявляет кислотные свойства.
Значит, по периоду кислотные свойства увеличиваются, а основные уменьшаются слева направо.
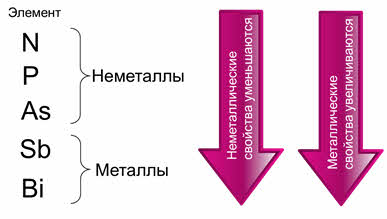
Азот, фосфор и мышьяк являются неметаллами, а сурьма и висмут – металлами. Сурьма и висмут считаются полуметаллами, так как находятся на границе с неметаллами. Значит, неметаллические свойства атомов химических элементов уменьшаются сверху вниз по группе, а металлические – увеличиваются.
Таким образом, в периоде при переходе от одного элемента к другому происходит ослабление основных и усиление кислотных свойств высших оксидов и гидроксидов.
Элементы, расположенные в одной группе, имеют одинаковое строение внешних электронных оболочек и поэтому проявляют схожие химические свойства.
Характер изменения свойств элементов и их соединений повторяется во всех периодах (кроме первого), поэтому такое изменение свойств называется периодическим.

Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон
2) алюминий
3) калий
4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий
2) бор
3) калий
4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb
2) Li
3) Mg
4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
5. Наибольшее число валентных электронов у элемента
1) фтор
2) водород
3) натрий
4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород
2) кремний
3) водород
4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg
2) Al, Mg, Ca, K
3) Li, Cs, Mg, Ba
4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl
2) O, S, Se, Te
3) Se, I, S, O
4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний
2) калий, магний, алюминий
3) хлор, натрий, фтор
4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий
2) углерод, кремний, калий
3) натрий, хлор, фтор
4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
12. Кислотные свойства водородных соединений ослабевают в ряду
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH
2) LiOH – KOH – Ca(OH)2
3) Ca(OH)2 – KOH – Mg(OH)2
4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность
2) уменьшается заряд ядра
3) возрастает атомный радиус
4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная
2) азотная
3) фтороводородная
4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний
2) литий
3) алюминий
4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен
2) фтор
3) йод
4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус
2) возрастают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус
2) ослабевают металлические свойства
3) уменьшается число протонов в атомном ядре
4) увеличивается число электронных слоёв
Объяснить и предсказать химические свойства веществ (металлические и неметаллические, окислительно-восстановительные и кислотно-основные) можно, используя сведения о периодическом изменении свойств атомов по мере увеличения заряда их ядра, важнейшие из которых — радиус атома, значения его электроотрицательности и степени окисления. Проанализируем, как эти свойства зависят от электронного строения атомов.
Периодичность изменения радиусов атомов элементов
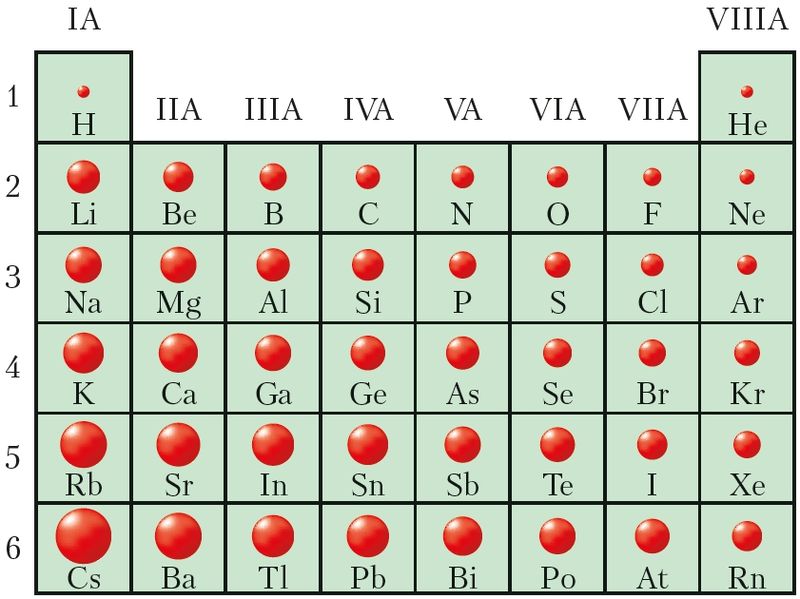
Рис. 21. Относительные размеры атомов
Радиус атома определяется размером его электронной оболочки. С точки зрения вероятности нахождения электрона в околоядерном пространстве атом не имеет чётких границ. Поэтому радиус атома — это условная величина. За радиус атома будем принимать расстояние от ядра до внешней электронной оболочки, занятой электронами. Как указано в § 9, в сфере с таким радиусом сосредоточено около 90 % электронной плотности.
Сопоставив характер изменения радиусов атомов ( рис. 21 ) с их электронным строением, можно сделать следующие выводы:
- • в периоде радиусы атомов уменьшаются, так как с ростом заря а ядра электроны сильнее притягиваются к ядру;
- • в группе радиусы атомов увеличиваются из-за роста числа электронных слоёв;
- • изменение значений радиусов атомов с ростом заряда ядра носит периодический характер. В пределах каждого периода наибольшим радиусом обладают атомы щелочных металлов, а наименьшим — атомы благородных газов.
Значения радиусов атомов являются важной характеристикой химических элементов, поскольку они определяют связь внешних, валентных, электронов с атомом. Чем меньше радиус, тем сильнее валентные электроны удерживаются в атоме и наоборот.
Силы притяжения или отталкивания заряженных частиц определяются законом Кулона: сила взаимодействия двух заряженных тел прямо пропорциональна произведению модулей их зарядов и обратно пропорциональна квадрату расстояния между ними:
Периодичность изменения электроотрицательности атомов
В 1932 году Л. Полинг ввёл в химию понятие электроотрицательности как меры способности данного атома притягивать к себе электроны от химически связанных с ним других атомов.
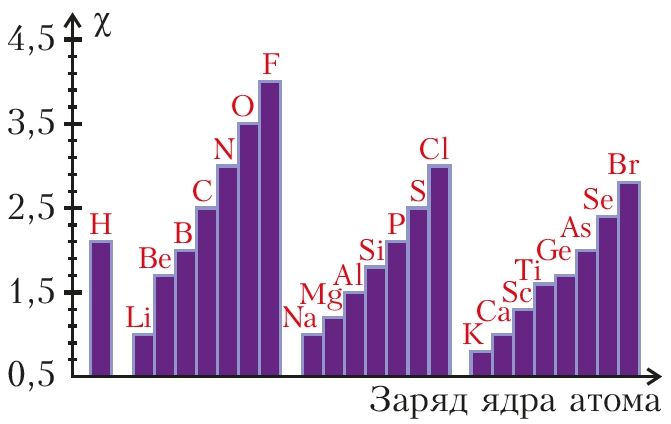
Рис. 22. Изменение электроотрицательности
атомов с ростом заряда их ядер
Значения электроотрицательности (χ) приводятся в справочниках ( рис. 22 , табл. 7 ). Существует несколько шкал и способов определения электроотрицательности. Мы будем использовать шкалу Полинга.
Анализ данных рисунка 22 указывает на периодический характер изменения электроотрицательности с ростом атомного номера элемента: по периоду она увеличивается, по группе — уменьшается. Объяснить это можно тем, что в периоде по мере роста заряда ядра электроны сильнее притягиваются к ядру, в группе с ростом числа электронных слоёв притяжение ослабевает.
К элементам с наибольшей электроотрицательностью относятся F, O, N, Cl. Самым электроотрицательным элементом является фтор ( χ = 4,0 ). Самая низкая электроотрицательность у щелочных металлов.
Периодичность изменения степеней окисления
Напомним, что степень окисления — это условный заряд атома в химическом соединении, вычисленный из предположения, что это соединение состоит из ионов. При определении степени окисления считают, что электроны, участвующие в химической связи, полностью переходят к более электроотрицательному атому. Число присоединённых атомом электронов показывает значение отрицательной степени окисления, число отданных — значение положительной степени окисления.
Анализ высших и низших степеней окисления, значения которых приведены в таблице 7, позволяет сделать следующие выводы:
- • у атомов металлов наблюдаются только положительные степени окисления, у неметаллов — как отрицательные, так и положительные;
- • высшая положительная степень окисления атома равна максимальному числу электронов на внешней электронной оболочке атома, поэтому она по каждому периоду возрастает;
- • низшая отрицательная степень окисления атомов неметаллов определяется числом электронов, которые атом может принять до заполнения внешней электронной оболочки, поэтому она отрицательна и в периоде убывает по абсолютной величине от 4 (элементы IVA-группы ) до 1 (элементы VIIA-группы );
- • атомы в химических соединениях могут быть в промежуточных степенях окисления; чем больше на внешнем электронном слое электронов, тем больше у атома возможных степеней окисления и, следовательно, больше вариантов возможных химических соединений.
Таблица 7. Наиболее характерные степени окисления и электроотрицательность атомов элементов 1 – 3-го периодов
Периодичность в изменении свойств простых и сложных веществ
При делении химических элементов на металлы и неметаллы используют критерии, связанные со свойствами образуемых ими простых и сложных веществ ( табл. 8 ).
Таблица 8. Отличительные признаки металлов и неметаллов
Проявление металлических свойств простыми веществами связано со способностью атомов, имеющих низкие значения электроотрицательности, терять электроны. В периодах с уменьшением размеров атомов электроотрицательность растёт, ослабевают металлические и восстановительные свойства простых веществ. Периоды начинаются щелочными металлами, а заканчиваются неметаллами — благородными газами. В группах с увеличением радиуса атома электроотрицательность уменьшается, усиливаются металлические и восстановительные свойства простых веществ, соответственно, неметаллические и окислительные — ослабевают.
Ослабление металлических свойств по периоду выражается ещё и в том, что у оксидов и гидроксидов элементов основные свойства постепенно ослабевают и переходят в амфотерные, а далее нарастают кислотные свойства ( табл. 9 ). Атомы с наиболее высокими значениями электроотрицательности образуют кислоты.
Таблица 9. Кислотно-основные свойства оксидов и гидроксидов элементов третьего периода
При одинаковом значении степеней окисления атомов основные свойства гидроксидов (и оксидов) возрастают с увеличением размера атомов и уменьшением их электроотрицательности, так как ослабевает взаимодействие катионов металлов с гидроксид-ионами. Поэтому сила оснований возрастает по группам периодической системы.
В группах с увеличением радиусов атомов элементов кислотные свойства оксидов и гидроксидов постепенно ослабевают ( табл. 10 ).
Следует отметить, что водородные соединения металлов — твёрдые вещества, а неметаллов — как правило, газообразные вещества.
Т аблица 10. Кислотно-основные свойства оксидов и гидроксидов некоторых элементов IIA-группы
*Зависимость свойств оксидов и гидроксидов от значения степени окисления элемента в соединении
Степень окисления атомов, образующих оксиды и гидроксиды, влияет на характер свойств этих веществ.
Например, в ряду оксидов по мере увеличения степени окисления атомов элемента происходит ослабление основных и нарастание кислотных свойств. Так, у Li2O выражены основные свойства, у BeO — уже амфотерные, у остальных оксидов — кислотные, причём сила кислотных свойств нарастает с увеличением степени окисления в ряду .
Аналогичная закономерность наблюдается и для соответствующих этим оксидам гидроксидов: LiOH — сильное основание; Be(OH)2 — амфотерный гидроксид; Н3ВО3 (или B(OH)3) и H2CO3 — слабые кислоты; HNO3 — сильная кислота.
| Оксиды | |||||
| Гидроксиды | |||||
| Растёт степень окисления, уменьшается радиус атома элемента | |||||
| Нарастают кислотные свойства | |||||
| Ослабевают основные свойства | |||||
Усиление кислотных свойств оксидов и гидроксидов с увеличением значения степени окисления элемента в соединении наблюдается и для отдельных элементов. Так, изменение свойств в ряду кислородсодержащих кислот хлора можно выразить следующей схемой:
| Растёт степень окисления атома хлора | |||
| Усиливаются кислотные свойства, повышается устойчивость соединений | |||
| Усиливается окислительная способность |
Таким образом, c увеличением значения степени окисления хлора устойчивость его гидроксидов (кислот) растёт, а их окислительная способность уменьшается. Наиболее сильным окислителем является хлорноватистая кислота (HClO), а наименее сильным — хлорная кислота (HClO4).
Такая же закономерность — усиление кислотных свойств гидроксида (и, соответственно, ослабление его основных свойств) — с ростом степени окисления элемента характерна не только для хлора, но и для других элементов. Наиболее ярко эта закономерность прослеживается в оксидах и гидроксидах хрома и марганца, что мы специально рассмотрим в § 49.1.
- С увеличением заряда атомных ядер происходит периодическое изменение:
- • свойств атомов (радиусов, электроотрицательности, степеней окисления);
- • свойств образуемых элементами простых веществ (металлических и неметаллических, окислительных и восстановительных);
- • свойств сложных веществ (окислительно-восстановительных и кислотно-основных свойств оксидов, гидроксидов, а также водородных соединений).
Вопросы, задания, задачи
1. Расположите в порядке возрастания атомных радиусов элементы: Cl, N, Si, He, Li, Al. Дайте объяснение.
2. Объясните, почему атомный радиус при переходе:
- а) от алюминия к кремнию уменьшается;
- б) от неона к натрию резко возрастает.
3. Используя закономерности в изменении атомных радиусов, объясните изменение электроотрицательности атомов в ряду элементов:
4. Вам известно, что сходство свойств элементов одной и той же группы объясняется одинаковым числом валентных электронов. Укажите, чем обусловлено различие свойств элементов одной группы.
5. Укажите максимальные и минимальные степени окисления атомов: Ca, Cl, K, Na, Mg, Si, P.
| Свойства | Характер изменения при движении в таблице | |
| По периоду | По группе | |
| Заряд ядра атома | ||
| Число электронных слоёв в атоме | ||
| Число электронов на внешнем слое атома | ||
| Радиус атома | ||
| Электроотрицательность | ||
| Способность притягивать электроны | ||
| Способность отдавать электроны | ||
| Металлические свойства простых веществ | ||
| Неметаллические свойства простых веществ | ||
| Основные свойства оксидов и гидроксидов элементов | ||
| Кислотные свойства оксидов и гидроксидов | ||
7. Из предложенного перечня характеристик выберите те, которые линейно (а не периодически) изменяются с ростом заряда ядра атома: электроотрицательность, число протонов, радиус атома, масса атома, общее число электронов, число электронов на внешнем слое, степень окисления.
8. Для азота характерны следующие степени окисления: +5, +4, +3, +2, +1, 0, –1, –2, –3. Какие свойства — окислительные или восстановительные — выражены у азота в каждой из этих степеней окисления?
9. Исходя из положения элементов N, P, С, Al, S в периодической системе, сравните кислотные свойства:
10. Массы двух водородных соединений равны. Сравните численно их объёмы при н. у., если известно, что оба соединения газообразны и образованы элементами с конфигурацией [Ne]3s 2 3p 5 и [He]2s 2 2p 3 .
*Самоконтроль
1. Состав высших оксидов выражается общей формулой ЭО3 для элементов:
2. Электроотрицательность элементов возрастает в рядах:
- а) С, F, Cl;
- б) S, Cl, F;
- в) S, O, F;
- г) C, O, N.
3. Осно́вные свойства веществ сначала возрастают, а затем убывают в рядах:
4. Металлические свойства у первого простого вещества выражены сильнее, чем у второго, в паре:
Читайте также:

