Температуры кипения и плавления алкинов так же как и алкенов закономерно повышаются при
Обновлено: 28.06.2024
Слайды и текст этой презентации


Сегодня на уроке вы узнаете:
Понятие о непредельных углеводородах.
Характеристика тройной связи.
Изомерия и номенклатура алкинов.
Физические свойства.
Получение алкинов.
Свойства алкинов.
Применение алкинов.

Понятие об алкинах
Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а качественный и количественный состав выражается общей формулой
СnН2n - 2, где n ≥ 2.
Алкины относятся к непредельным углеводородам, так как их молекулы содержат меньшее число атомов водорода, чем насыщенные.

Характеристика тройной связи
Вид гибридизации – sp
Валентный угол – 180
Длина связи С = С – 0,12 нм
Строение ─ линейное
Вид связи – ковалентная полярная
По типу перекрывания – δ и 2 π

Схема образования sp -гибридных орбиталей

Схема образования sp -гибридных орбиталей

Гомологический ряд алкинов
C2H2
C3H4
C4H6
C5H8
C6H10
C7H12

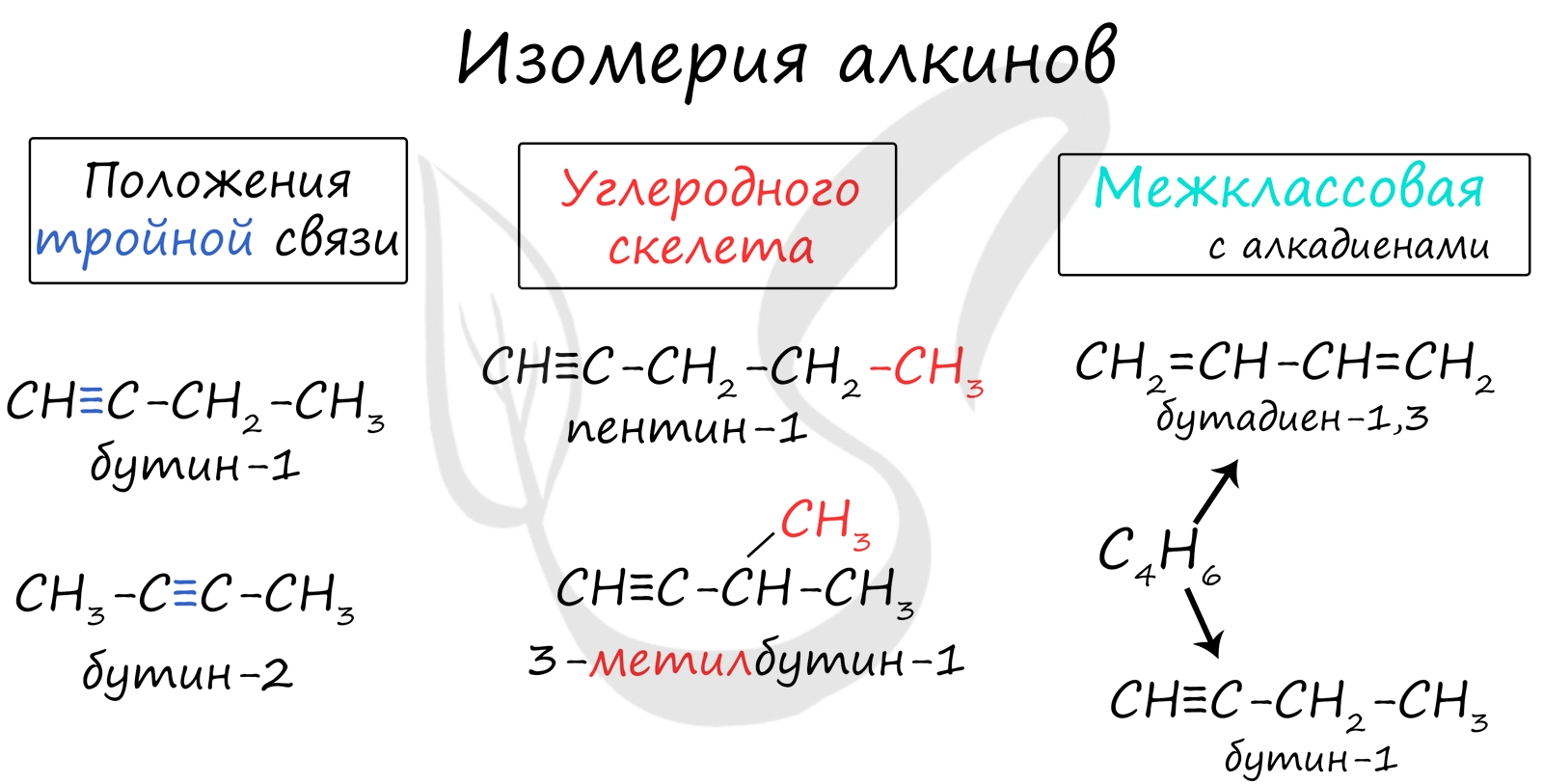
1. Изомерия положения тройной связи (начиная с С4Н6):
СН ≡С−СН2−СН3 СН3−С≡С−СН3
бутин-1 бутин-2
2. Изомерия углеродного скелета (начиная с С5Н8):
СН ≡С−СН2−СН2−СН3 СН ≡С−СН−СН3
⏐
СН3
пентин-1 3-метилбутин-1
3. Межклассовая изомерия с алкадиенами и циклоалкенами, (начиная с С4Н8):
СН = СН
СН ≡С–СН2–СН3 СН2=СН–СН=СН2 ⏐ ⏐
СН2 –СН2
бутин-1 бутадиен-1,3 циклобутен

Назовите вещество.
Составьте к нему три изомера разных видов изомерии. Назовите изомеры.

Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.

Ацетилен получают в промышленности двумя способами:
1. Термический крекинг метана:
1500°С
2СН4 ⎯⎯→ С2Н2 + 3Н2
2. Гидролиз карбида кальция:
CaC2 + 2H2O ⎯⎯→ C2H2 + Ca(OH)2

Химические свойства алкинов
Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах тройной связи. Наиболее характерны для алкинов реакции присоединения.

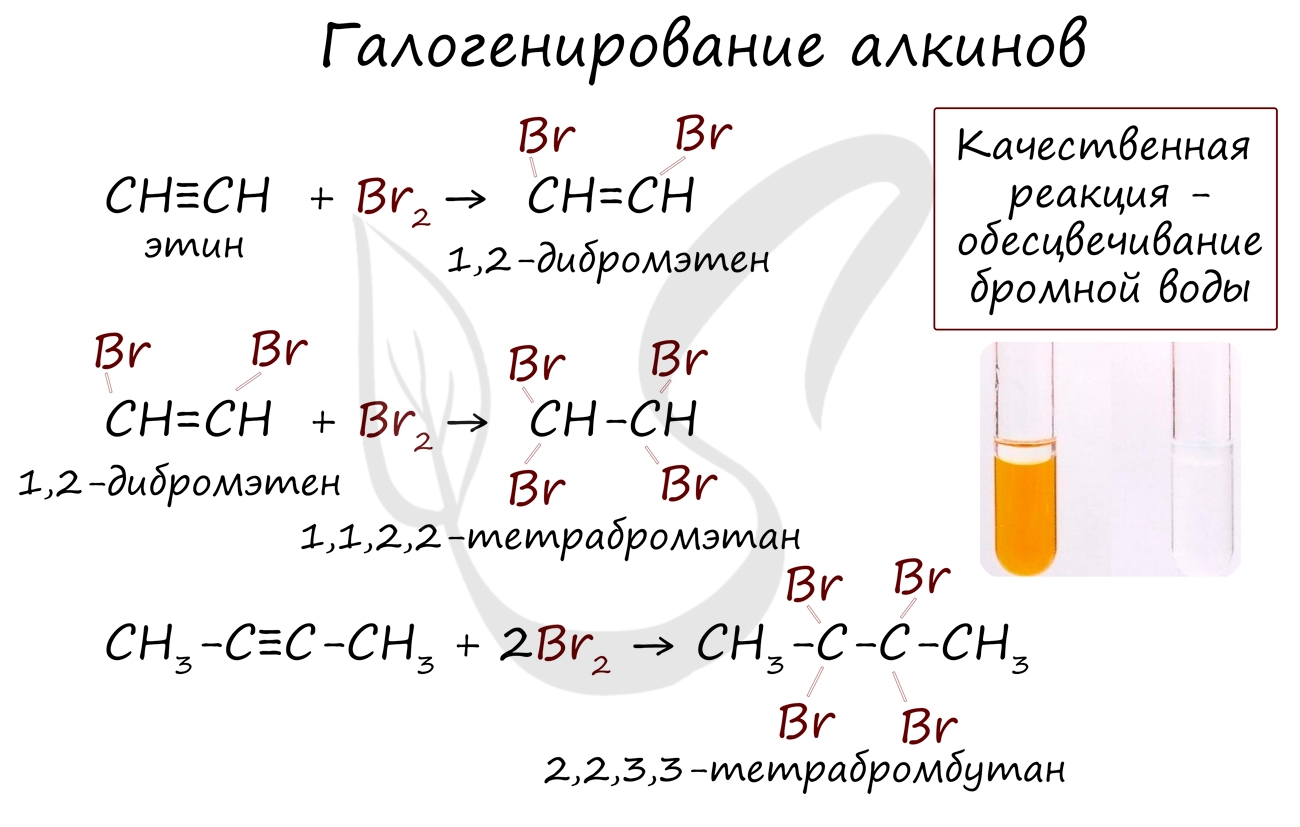
1. Галогенирование
Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды
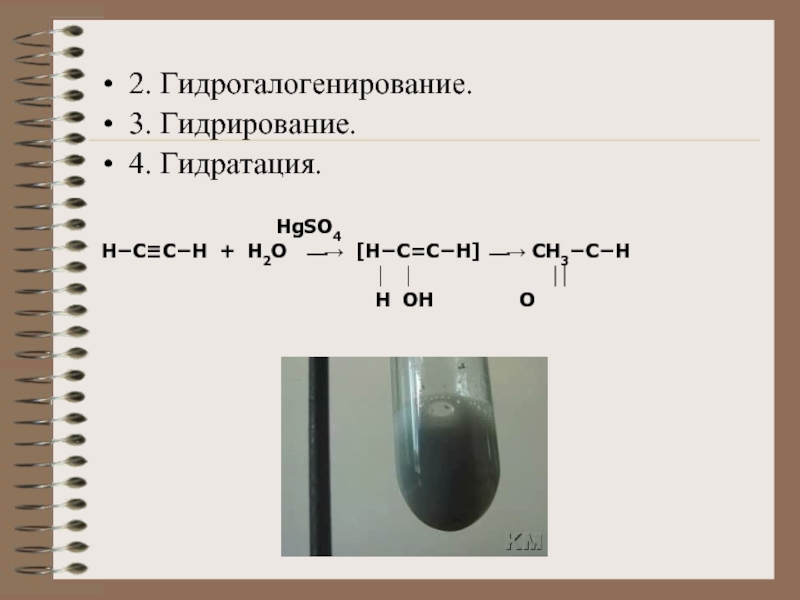
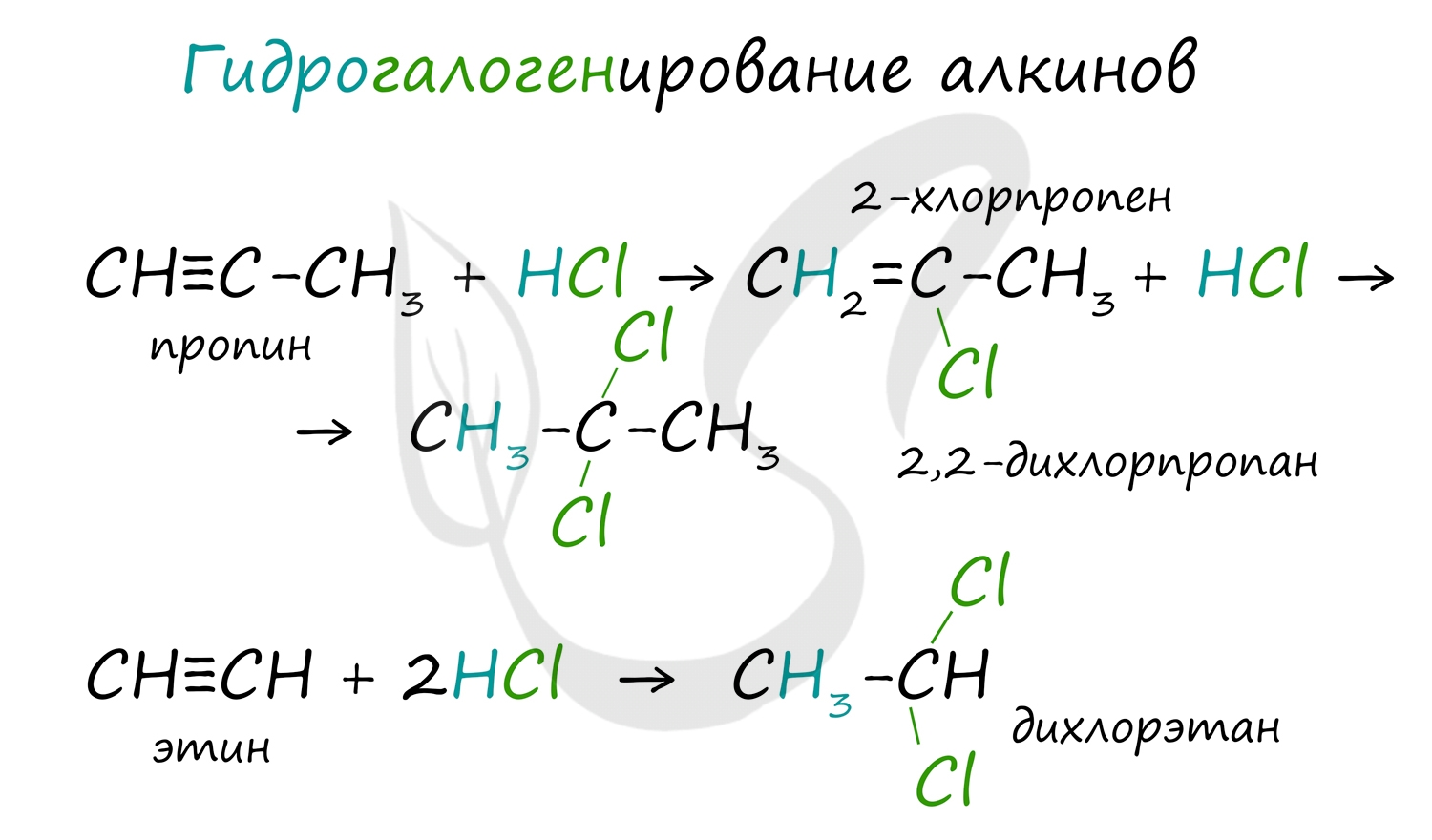
2. Гидрогалогенирование.
3. Гидрирование.
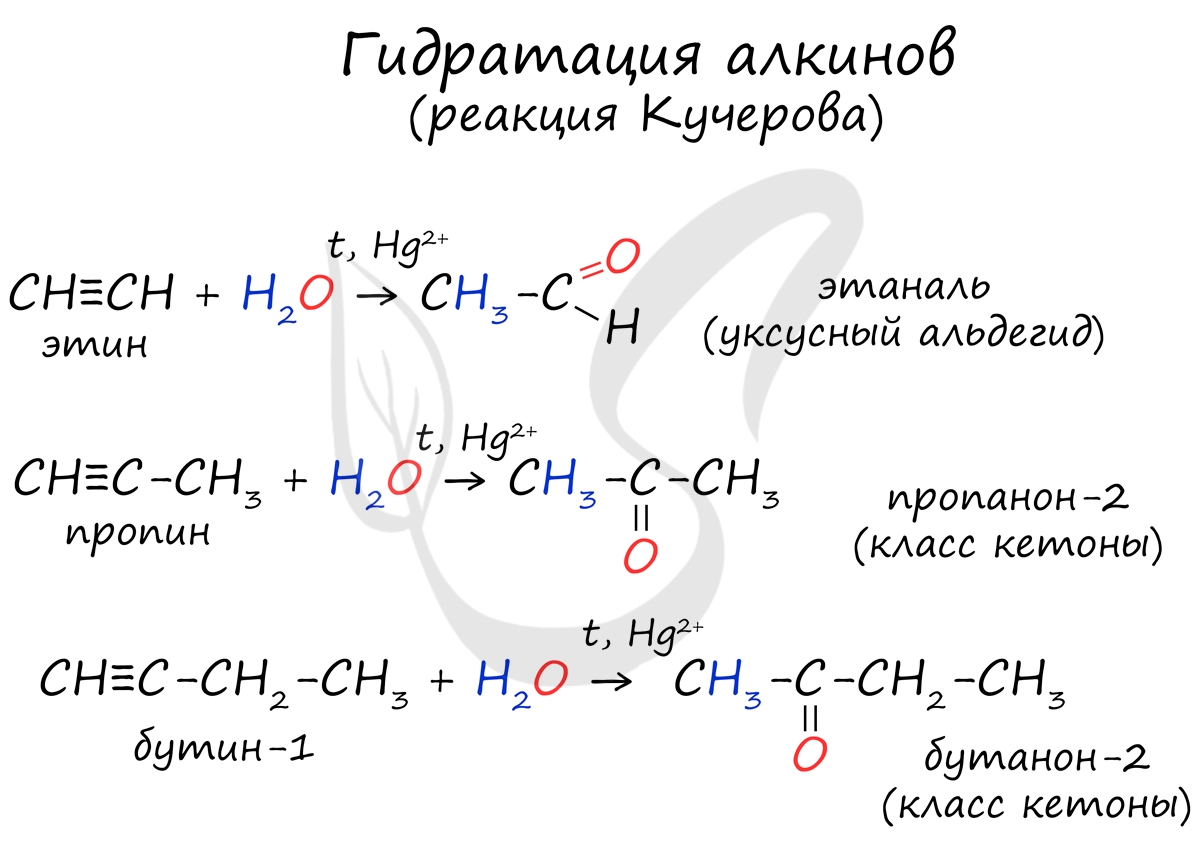
4. Гидратация.
HgSO4
Н−C≡C−H + H2O ⎯→ [H−C=C−H] ⎯→ CH3−C−H
⏐ ⏐ ⏐⏐
H OH O
![ОкислениеАцетилен и его гомологи окисляются перманганатом калия срасщеплением тройной связи и образованием карбоновых кислот:R−C≡C−R’ + 3[O] +](https://theslide.ru/img/thumbs/5e149281de77440f7fb6279e4945aa42-800x.jpg)
Ацетилен и его гомологи окисляются перманганатом калия с
расщеплением тройной связи и образованием карбоновых кислот:
R−C≡C−R’ + 3[O] + H2O ⎯→ R−COOH + R’−COOH
Алкины обесцвечивают раствор KMnO4, что используется
для их качественного определения.

При сгорании (полном окислении) ацетилена выделяется большое количества тепла:
HC≡CH + 2О2 ⎯→ 2СО2 + Н2О + Q
![Реакции замещенияПри взаимодействии ацетилена (или R−C≡C−H) с аммиачнымирастворами оксида серебра выпадают осадки нерастворимых ацетиленидов:HC≡CH + 2[Ag(NH3)2]OH ⎯→](https://theslide.ru/img/thumbs/6548850ed42c4e02e3a3fb505380d951-800x.jpg)
При взаимодействии ацетилена (или R−C≡C−H) с аммиачными
растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
HC≡CH + 2[Ag(NH3)2]OH ⎯→ AgC≡CAg ↓ + 4NH3 + 2H2O
Качественная реакция на
концевую тройную связь

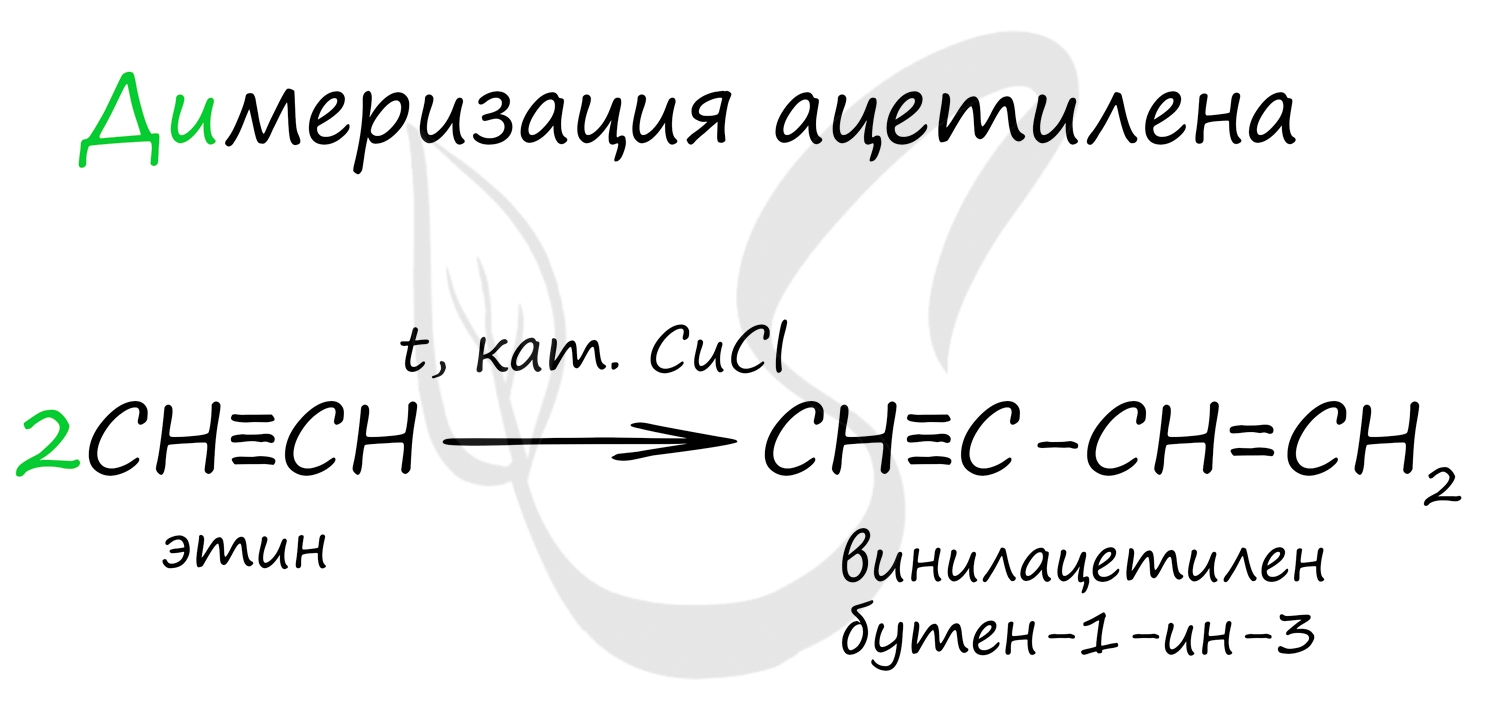
1. Димеризация под действием водного раствора CuCl и NH4Cl:
НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
(винилацетилен)
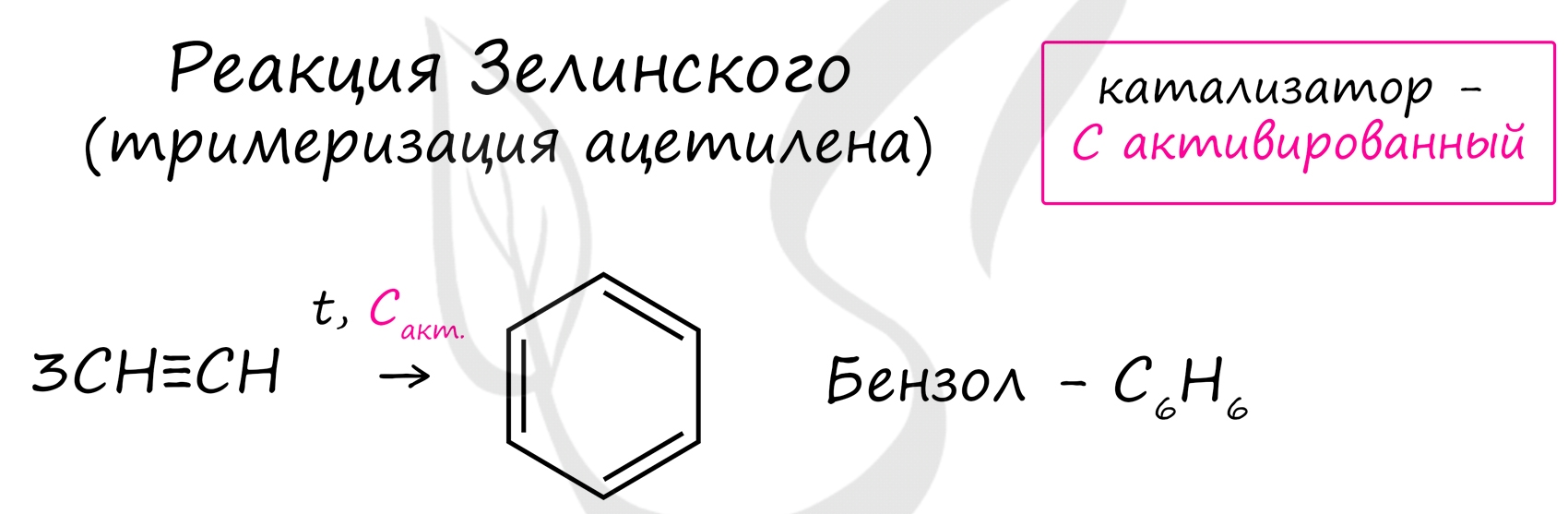
2. Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
С, 600 °С
3НC≡CH ⎯⎯→ С6H6 (бензол)
Презентация по теме "Алкины" дает возможность наглядно представить информацию о строении, свойствах, способах получения и применении алкинов.




















Строение алкинов Алкины – вещества, молекулы которых состоят из атомов углерода и водорода и содержат одну тройную связь. Общая формула алкинов – CnH2n-2.

Алкины – непредельные углеводороды, в молекулах которых имеется одна тройная связь. CnH2n –2 n = 2 n = 3 n = 4 H-C ≡ C-H этин (ацетилен) H-C ≡ C-СH3 пропин HC ≡ C-СH2-СH3 H 3C-C ≡ С-СH3 бутин-1 бутин-2

Изомерия алкинов C5H8 СН ССН2СН2СН3 СН3 СССН2СН3 СН ССНСН3 СН3 пентин-1 пентин-2 3- метилбутин-1 Структурная изомерия: 1.Изомерия положения тройной связи 2. Изомерия углеродного скелета 3. Межклассовая изомерия(с алкадиенами) СН2=СН– СН2–СН=СН2 СН2= С = СН–СН2–СН3 СН2= СН–СН = СН–СН3 пентадиен-1,2 пентадиен-1,3 пентадиен-1,4

Строение алкинов H-C ≡ C-H Вид связи Н-С – ковалентная полярная Вид связи С ≡ С – ковалентная неполярная C ≡ C σ –св. π –св. Всего в молекуле ацетилена: σ -связей – π -связей – 3 2

Строение алкинов Модели строения молекулы ацетилена s p возбужден. s p гибридизация sp s p 1800

Строение алкинов Вид гибридизации – sp Валентный угол – 1800 Длина связи С ≡ С 0,12 нм Строение молекулы линейное

При обычных условиях: от С2Н2 до С4Н6 – газы с С5Н8 – жидкости с С16Н30 – твердые тела Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены. Физические свойства алкинов

Физические свойства Название Формула Температура кипения Ацетилен (этин) СH CH - 83,8 Пропин СH3 – С CH -23,3 Бутин – 1 СH3 – CH2 – С CH +8,5 Бутин – 2 СH3 – C С – CH3 +27,0 Температуры кипения и плавления алкинов закономерно повышаются при увеличении молекулярной массы соединений.

Получение алкинов 1.Термический крекинг метана: 2.Карбидный способ: 3.Способ дегидрогалогенирования: H3C–CН – СH2 Cl Cl H-C ≡ C-СH3 +2KOH (спирт) + 2KСl +2H2O



1) СH CH+2H2 CH3 – CH3 2) СH CH + 2Br2 CHBr2– CHBr2 O 3) СH CH + H2OHgSO4 CH3 –C реакция Кучерова H 4) 3СH CH C;4500 Бензол СH C – CH3 + HBr СH2 = CBr – CH3 Химические свойства 1. Гидрирование 2. Галогенирование 3. Гидратация 4. Полимеризация 5. Гидрогалогенирование



Контрольные вопросы 1.Вставьте в текст соответствующие слова и символы из скобок. Алкинами называются…(ациклические, циклические) углеводороды, содержащие в молекуле одну… (двойную, тройную) углерод – углеродную связь и имеющие общую формулу…(CnH2n+2, CnH2n, CnH2n-2). Первым представителем этого гомологического ряда является…(этин, этен, этан). Атомы углерода, связанные кратной связью, находятся в состоянии…(sp-, sp2-, sp3-) гибридизации. Угол между осями гибридных орбиталей равен…(900,109028',1200,1800). Каждый из таких атомов углерода образует с соседними атомами…(одну, две, три, четыре) σ-связи и… (одну, две, три, четыре) π-связь. Длина углерод – углеродной связи в ацетилене… (больше, меньше), чем в этане, и равна…(0,154 нм, 0,120 нм, 0,134 нм).

2. Укажите формулу алкина: а) C3H4, б) C4H8, в) C5H12, г) C6H6 . 3. Как называется углеводород CH3 – CH – C C - CH3 CH3 а) 2-этилпентин–3 б) 4-метилпентин–2 в) 3-метилгексин–4 г) 4-метилгексин–4 4. Укажите формулу 4,4-диметилпентина-2: CH3 а) CH C – CH – CH – CH3 б) CH C – C – CH2 – CH3 CH3 CH3 CH3 CH3 СH3 в) CH3 – C C – C – CH3 г) CH C – CH2 – C – CH3 CH3 СH3

5. Для пентина-2 выберите формулы: 1) гомологов; 2) изомеров. а) CH3 – C C – CH3 б) CH C – CH – CH3 CH3 в) CH C – CH2 – CH2 – CH3 г) CH3 – C C – CH2 – CH2 – CH3 6.Как называется углеводород CH3 – CH– CH – C C – CH –CH3 СH3 CH3 C2H5 а) 2-этил-5,6-диметилгептин-3 б) 2,4-диметил-6-этилгептин-2 в) 1,4,5-триметил-1-этилгексин-2 г) 2,3,6-триметилоктин-4 7. У алкинов отсутствует изомерия: а) углеродного скелета б) геометрическая, в) положение кратной связи, г) верного ответа нет.

8. Ацетилен представляет собой: а) газ, б) жидкость, в) твердое вещество. 9. Реакцией Кучерова называется: а) гидратация ацетилена, б) тримеризация ацетилена, в) галогенирование ацетилена, в) гидрогалогенирование ацетилена. 10. Бензол получается из ацетилена по реакции: а) димеризации, б) тримеризации, в) окисления, г) гидратации.
Свойства алкинов – физические и химические похожи на свойства алкенов и алкадиенов. Однако кислотные свойства алкинов создают ряд отличительных химических свойств.
Физические свойства алкинов
Алкины, за исключением ацетилена, не имеют цвета и запаха. При нормальных условиях первые 4 члена ряда являются газами, с 5 по 15 – жидкостями, более 15 – твердыми веществами.
Растворимость алкинов
Алкины являются относительно полярными молекулами, поэтому хорошо растворимы в полярных растворителях или растворителях с низкой полярностью. В воде алкины растворяются незначительно, но лучше, чем алканы и алкены.
Точки плавления и кипения алкинов
Как правило, алкины плавятся и кипят при более высоких температурах, по сравнению соответствующих алканов и алкенов. Температуры плавления и кипения алкинов, увеличиваются пропорционально их молекулярной массе.
В таблице приведены физические постоянные некоторых алкинов:

Химические свойства алкинов
В общем алкины более реакционноспособны, чем алканы и алкены. Большинство реакций, в которых они участвуют являются реакциями электрофильного присоединения. Однако терминальные алкины (тройная связь находится в конце цепи) также подвергаются и реакциям замещения. Атомы водорода при sp-гибридизованном атоме углерода способны подвергаться протонизации, вследствие чего алкины имеют относительно кислую природу.
Реакции электрофильного присоединения (реакции тройной углерод-углеродной связи)

1) Гидрирование алкинов. В присутствии активных катализаторов (никель, платина) восстанавление алкинов водородом происходит сразу до алканов. При использовании менее активных катализаторов (Pd, железо Ренея) реакция протекает через стадию образования алкена:
При гидрировании гомологов ацетилена на первой стадии получаются цис-олефины.

2) Галогенирование алкинов протекает в две легко разделимые стадии, из которых первая стадия протекает более энергично. При недостатке галогена реакция идет в одну стадию, при избытке – две стадии:

3) Гидрогалогенирование алкинов также протекает в две разделимые стадии. При гидрохлорировании ацетилена на первоначальном этапе образуется важный в промышленности продукт – хлористый винил, далее происходит образование 1,1-дихлорэтан:
Присоединение молекулы HCl к хлористому винилу происходит по правилу Марковникова. Аналогичным образом присоединяется молекула HBr.
4) Гидратация алкинов происходит согласно правилу Марковникова с участием Hg 2+ в качестве катализатора (реакция Кучерова). В ходе такой реакции, из ацетилена образуется ацетальдегид, а из его гомологов — кетоны: 5) Присоединение спиртов и меркаптанов. При воздействии едкого кали ацетилен и монозамещенные ацетилены под давлением присоединяют спирты, образуя акрилвиниловые эфиры (Реппе, Фаворский А.Е., М.Ф. Шоствковский): Подобным образом происходит присоединение меркаптанов.
6) Присоединение кислот.

Присоединение уксусной кислоты к ацетилену происходит в условиях гетерогенного катализа (H3PO4 или B2O3) с образованием винилацетата:

Винилацетат хорошо полимеризуется с образованием поливинилацетата (ПВА):

Присоединение синильной кислоты к ацетилену происходит с образованием акрилонитрила:

Акрилонитрил используют для получения полиакрилонитрила: 7) Присоединение хлоридов некоторых металлов к ацетилену:

8) Реакции полимеризации
Димеризация ацетилена происходит в присутствии солей Cu (I) с образованием винилацетилена. Дальнейшее его взаимодействие с соляной кислотой приводит к образованию хлоропрена, который используют при получении хлоропреновых каучуков:


А.Д. Петров путем кросс-димеризации ацетилена получил изобутилен. В качестве катализаторов выступает никель в присутствии хлорида цинка:

Тримеризация ацетилена в присутствии активного угля и при температуре около 600°С ведет к образованию такого важного продукта, как бензол (реакция Зелинского):

Ученый Шеффер в 1966 г обнаружил, что при пропускании над хлоридом алюминия раствора диметилацетилена в бензоле, последний тримеризуется. Продуктом реакции является гексаметилбицикло[2,2,0]гексадиен (гексаметилдьюаровский бензол), который далее при при воздействии температуры подвергается изомеризации в гексаметилбензолПри использовании в качестве катализатора димезитиленкобальта гексаметилбензол получается непосредственно из диметилацетилена:

Тетрамеризация ацетилена под действием комплексных солей никеля ведет к образованию циклоокта-1,3,5,7-тетраена (синтез Реппе):

10) Окисление алкинов концентрированным раствором перманганата калия (KMnO4) в кислой среде протекает с образованием карбоновых кислот. Розовый раствор KMnO4 в ходе реакции обесцвечивается:

Окисление алкинов в мягких условиях, т.е. разбавленный раствор KMnO4, комнатная температура, происходит без разрыва связей. При окислении ацетилена продуктом реакции является щавелевая кислота, при окислении его гомологов в нейтральной среде реакцию можно остановить на стадии образования дикетонов:

При горении алкинов происходит их полное окисление до углекислого газа и воды. Реакция экзотермическая и протекает с выделением 1300 кДж/моль тепла:
Реакции замещения водородных атомов ацетилена
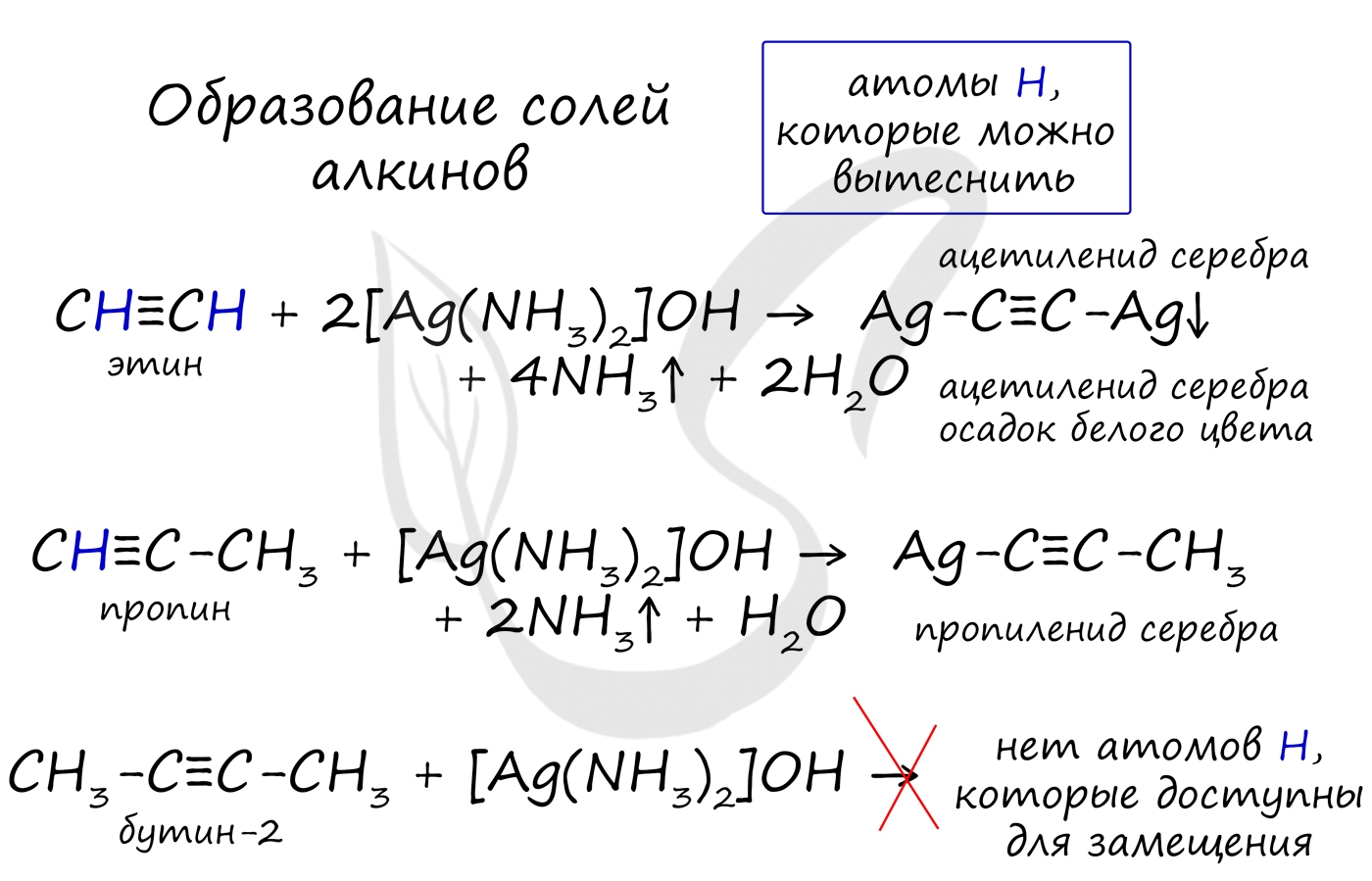
1) Взаимодействие с солями тяжелых металлов (качественная реакция). При взаимодействии ацетилена и монозамещенных гомологов с аммиачными растворами окиси серебра или полухлористой меди обрадуются нерастворимые осадки ацетиленидов:
Ацетилинид серебра Ag-C≡C-Ag – бесцветный и R-C≡C-Ag — белый

Ацетилинид меди Cu-C≡C-Cu – вишнево-бурый и R-C≡C-Cu – желто-бурый
Ацетилениды – взрывчатые вещества. Под действием кислот разлагаются с образованием ацетилена и соответствующих солей металлов.

2) Взаимодействие ацетилена и его гомологов с щелочными и щелочноземельными металлами в жидком аммиаке также приводит к образованию ацетилинидов:
Действие производных Na и Mg, известных как реактив Иоцича, подобно реактиву Греньяра, поэтому широко используются в органическом синтезе.
Алкины - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда - этин - CH≡CH (ацетилен). Общая формула их гомологического ряда - CnH2n-2.
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса "ин" к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.
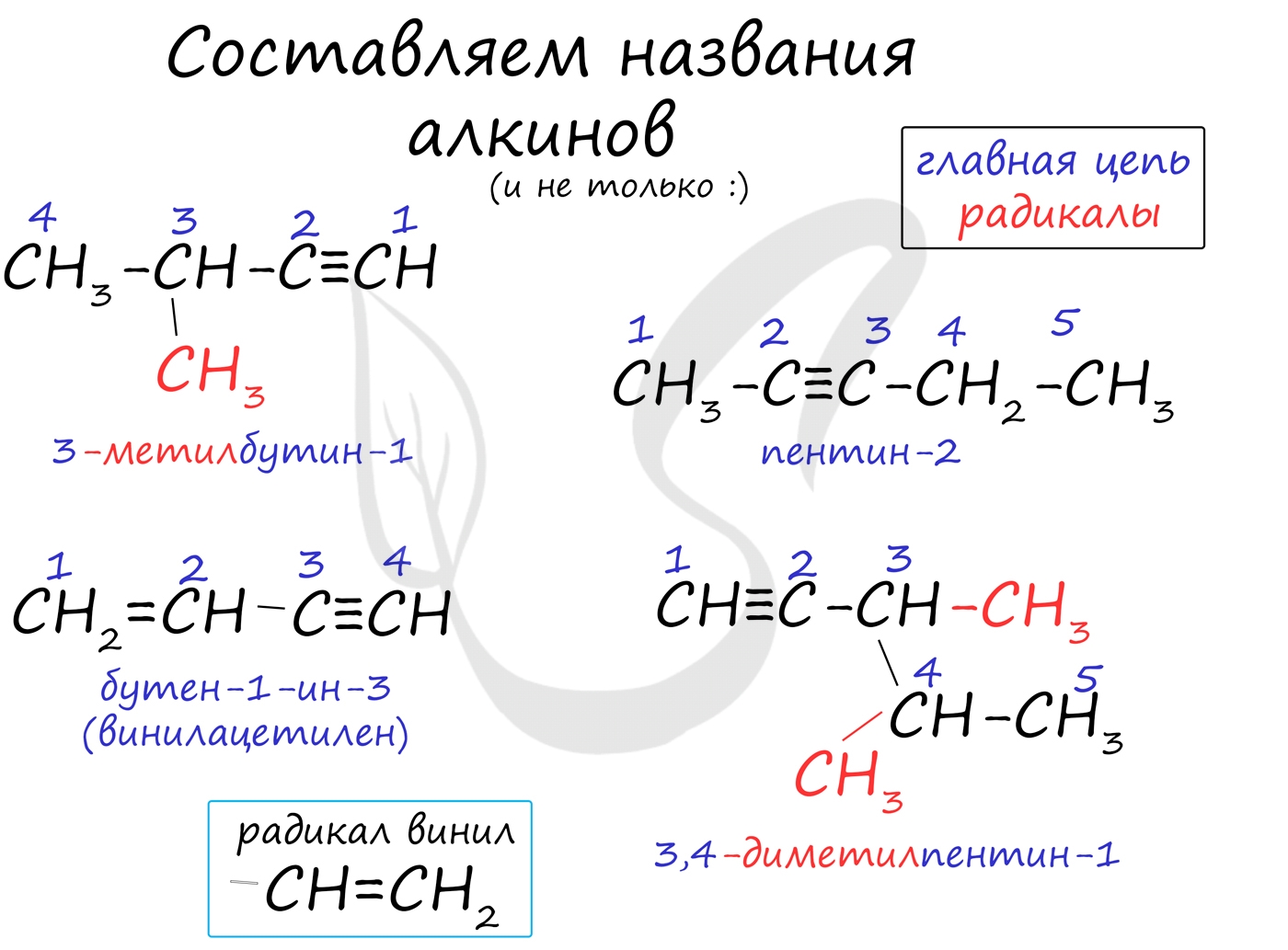
Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода - sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород.
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II.
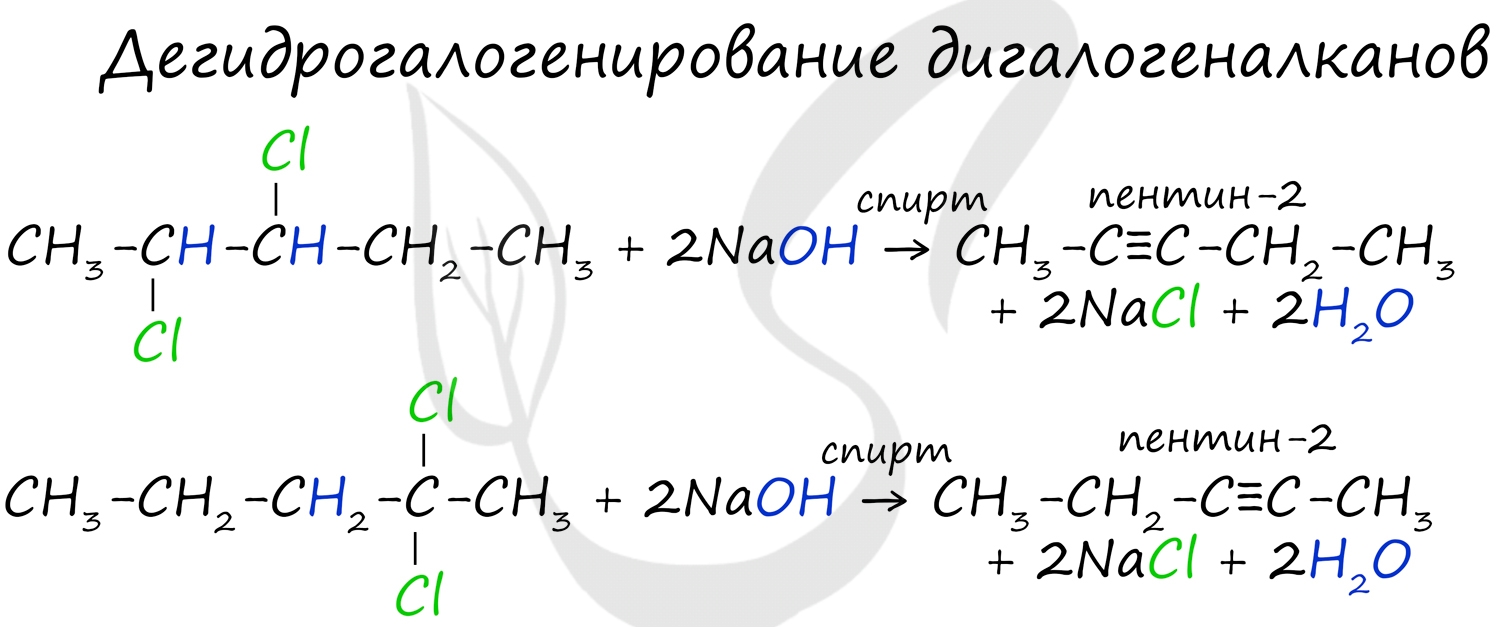
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.
Химические свойства алкинов
Алкины - ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.
Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор - соли ртути Hg 2+ .
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.
При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды - полное окисление.
Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте - в месте тройной связи.
Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.

Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.
Димеризация ацетилена происходит при наличии катализатора - солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен.
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена - качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

