Какие сложные белки осуществляют перенос электронов в дыхательной цепи фосфопротеины
Обновлено: 05.07.2024
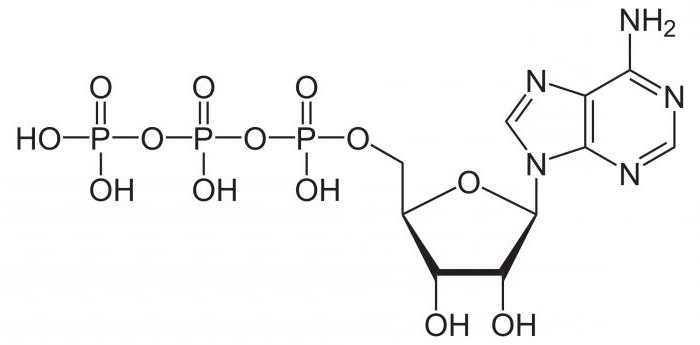
Все биохимические реакции в клетках любого организма протекают с расходованием энергии. Дыхательная цепь – это последовательность специфических структур, которые расположены на внутренней мембране митохондрий и служат для образования АТФ. Аденозинтрифосфат является универсальным источником энергии и способен аккумулировать в себе от 80 до 120 кДж.
Дыхательная цепь электронов - что это такое?
Электроны и протоны играют важную роль в образовании энергии. Они создают разность потенциалов на противоположных сторонах мембраны митохондрий, что порождает направленное движение частиц – ток. Дыхательная цепь (она же ЭТЦ, цепь переноса электронов) является посредником при переносе положительно заряженных частиц в межмембранное пространство и отрицательно заряженных частиц в толще внутренней мембраны митохондрий.
Главная роль в образовании энергии принадлежит АТФ-синтазе. Этот сложный комплекс видоизменяет энергию направленного движения протонов в энергию биохимических связей. К слову, практически идентичный комплекс находится и в хлоропластах растений.
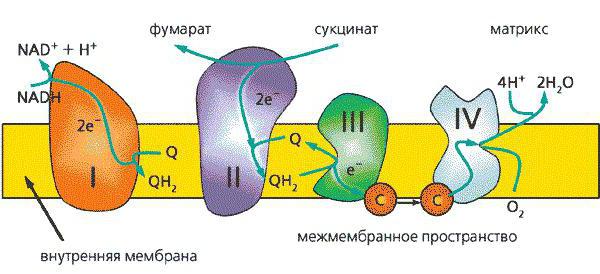
Комплексы и ферменты дыхательной цепи
Перенос электронов сопровождается биохимическими реакциями в присутствии ферментативного аппарата. Эти биологически активные вещества, многочисленные копии которых образуют большие комплексные структуры, служат посредниками при переносе электронов.
Комплексы дыхательной цепи – это центральные компоненты транспортировки заряженных частиц. Всего во внутренней мембране митохондрий находятся 4 таких образования, а также АТФ-синтаза. Все эти структуры объединены общей целью – перенос электронов по ЭТЦ, перенос протонов водорода в межмембранное пространство и, как следствие, синтез АТФ.
Комплекс представляет собой скопление белковых молекул, среди которых встречаются ферменты, структурные и сигнальные протеины. Каждый из 4 комплексов выполняет свою, только свойственную ему, функцию. Давайте разберемся, для каких задач в ЭТЦ присутствуют эти структуры.
I комплекс
В переносе электронов в толще мембраны митохондрий главную роль выполняет дыхательная цепь. Реакции отщепления протонов водорода и сопутствующих им электронов – одна из центральных реакций ЭТЦ. Первый комплекс транспортной цепи принимает на себя молекулы НАД*Н+ (у животных) или НАДФ*Н+ (у растений) с последующим отщеплением четырех протонов водорода. Собственно, из-за этой биохимической реакции I комплекс также называется НАДН – дегидрогеназой (по названию центрального фермента).
В состав дегидрогеназного комплекса входят железосерные белки 3 видов, а также флавинмононуклеотиды (ФМН).
II комплекс
Работа данного комплекса не сопряжена с переносом протонов водорода в межмембранное пространство. Основная функция этой структуры заключается в поставке дополнительных электронов в электрон-транспортную цепь посредством окисления сукцината. Центральный фермент комплекса – сукцинат-убихинон-оксидоредуктаза, который катализирует отщепление электронов от янтарной кислоты и перенос на липофильный убихинон.
Поставщиком протонов водорода и электронов ко второму комплексу также является ФАД*Н2. Однако КПД флавинадениндинуклеотида меньше, чем у его аналогов – НАД* Н или НАДФ*Н.
В состав II комплекса входят три вида железосерных белков и центральный фермент сукцинат-оксидоредуктаза.
III комплекс
Следующий по счету компонент, ЭТЦ, состоит из цитохромов b556, b560 и c1, а также железосерного белка Риске. Работа третьего комплекса сопряжена с переносом двух протонов водорода в межмембранное пространство, и электронов от липофильного убихинона на цитохром С.
Особенностью белка Риске является то, что он растворяется в жире. Другие протеины этой группы, которые встречались в составе комплексов дыхательной цепи, водорастворимы. Эта особенность влияет на положение белковых молекул в толще внутренней мембраны митохондрий.
Третий комплекс функционирует как убихинон-цитохром с-оксидоредуктаза.
IV комплекс
Он же цитохром-оксидантный комплекс, является конечным пунктом в ЭТЦ. Его работа заключается в переносе электрона с цитохрома-с на атомы кислорода. Впоследствии отрицательно заряженные атомы О будут вступать в реакцию с протонами водорода с образованием воды. Главный фермент – цитохром с-кислород-оксидоредуктаза.
В состав четвертого комплекса входят цитохромы a, a3 и два атома меди. Центральная роль в переносе электрона к кислороду досталась цитохрому a3. Взаимодействие этих структур подавляется цианидом азота и угарным газом, что в глобальном смысле приводит к прекращению синтеза АТФ и гибели.

Убихинон
Убихинон – это витаминоподобное вещество, липофильное соединение, которое свободно перемещается в толще мембраны. Дыхательная цепь митохондрий не может обойтись без этой структуры, т. к. она отвечает за транспортировку электронов от комплексов I и II к комплексу III.
Убихинон является производным бензохинона. Эта структура на схемах может обозначаться буквой Q или сокращенно ЛУ (липофильный убихинон). Окисление молекулы приводит к образованию семихинона – сильного окислителя, который потенциально опасен для клетки.
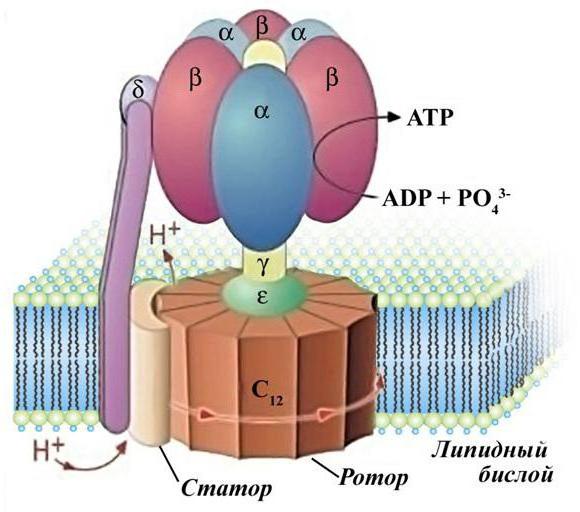
АТФ-синтаза
Главная роль в образовании энергии принадлежит АТФ-синтазе. Эта грибоподобная структура использует энергию направленного движения частиц (протонов) для преобразования ее в энергию химических связей.
Основной процесс, который встречается на протяжении всей ЭТЦ, - это окисление. Дыхательная цепь отвечает за перенос электронов в толще мембраны митохондрий и аккумулирование их в матриксе. Одновременно с этим комплексы I, III и IV перекачивают протоны водорода в межмембранное пространство. Разница зарядов на сторонах мембраны приводит к направленному движению протонов через АТФ-синтазу. Так Н+ попадают в матрикс, встречают электроны (которые связаны с кислородом) и образуют нейтральное для клетки вещество – воду.
АТФ-синтаза состоит из F0 и F1 субъединиц, которые вместе образуют роутер молекулы. F1 состоит из трех альфа и трех бета-субъединиц, которые вместе образуют канал. Этот канал имеет в точности такой же диаметр, какой имеют протоны водорода. При прохождении положительно заряженных частиц через АТФ-синтазу головка F0 молекулы крутится на 360 градусов вокруг своей оси. За это время к АМФ или АДФ (аденозинмоно- и дифосфат) присоединяются фосфорные остатки с помощью макроэргических связей, в которых заключено большое количество энергии.
АТФ-синтазы встречаются в организме не только в митохондриях. У растений эти комплексы также расположены на мембране вакуолей (тонопласте), а также на тилакоидах хлоропласт.
Также в клетках животных и растений присутствуют АТФ-азы. Они имеют схожую структуру, как и у АТФ-синтаз, однако их действие направлено на отщепление фосфорных остатков с затратой энергии.
Биологический смысл дыхательной цепи
Во-первых, конечным продуктом реакций ЭТЦ является так называемая метаболическая вода (300-400 мл в сутки). Во-вторых, происходит синтез АТФ и запасание энергии в биохимических связях этой молекулы. В сутки синтезируется 40-60 кг аденозинтрифосфата и столько же используется в ферментативных реакциях клетки. Срок жизни одной молекулы АТФ составляет 1 минуту, поэтому дыхательная цепь должна работать слаженно, четко и без ошибок. В противном случае клетка погибнет.
Митохондрии считаются энергетическими станциями любой клетки. Их количество зависит от энергозатрат, которые необходимы для тех или иных функций. Например, в нейронах можно насчитать до 1000 митохондрий, которые часто образуют скопление в так называемой синаптической бляшке.
Отличия дыхательной цепи у растений и животных
Также растения могут выживать в условиях высокой концентрации угарного газа, азота и цианидов за счет цианид-устойчивого пути в ЭТЦ. Дыхательная цепь, таким образом, заканчивается на убихиноне, электроны с которого сразу переносятся на атомы кислорода. В результате синтезируется меньше АТФ, однако растение может пережить неблагоприятные условия. Животные в таких случаях при длительном воздействии погибают.
Можно сравнить КПД НАД, ФАД и цианид-устойчивого пути с помощью показателя образования АТФ при переносе 1 электрона.
- с НАД или НАДФ образуется 3 молекулы АТФ;
- с ФАД образуется 2 молекулы АТФ;
- по цианид-устойчивому пути образуется 1 молекула АТФ.

Эволюционное значение ЭТЦ
Для всех эукариотических организмов одним из основных источников энергии является дыхательная цепь. Биохимия синтеза АТФ в клетке делится на два типа: субстратное фосфорилирование и окислительное фосфорилирование. ЭТЦ используется в синтезе энергии второго типа, т. е. за счет окислительно-восстановительных реакций.
У прокариотических организмов АТФ образуется только в процессе субстратного фосфорилирования на стадии гликолиза. Шестиуглеродные сахара (преимущественно глюкоза) вовлекаются в цикл реакций, и на выходе клетка получает 2 молекулы АТФ. Этот тип синтеза энергии считается наиболее примитивным, т. к. у эукариот в процессе окислительного фосфорилирования образуется 36 молекул АТФ.
Однако это не значит, что современные растения и животные потеряли способность к субстратному фосфорилированию. Просто этот тип синтеза АТФ стал только одним из трех этапов получения энергии в клетке.
Гликолиз у эукариот проходит в цитоплазме клетки. Там находятся все необходимые ферменты, которые смогут расщепить глюкозу до двух молекул пировиноградной кислоты с образованием 2 молекул АТФ. Все последующие этапы проходят в матриксе митохондрий. Цикл Кребса, или цикл трикарбоновых кислот, также протекает в митохондриях. Это замкнутая цепь реакций, в результате работы которой синтезируются НАД*Н и ФАД*Н2. Эти молекулы пойдут как расходный материал в ЭТЦ.
Цепь переноса электронов (дыхательная цепь) представляет собой организованную совокупность белковых и небелковых переносчиков электронов локализованную во внутренней митохондриальной мембране. Электроны перемещаются по цепи ступенчато, в одном направлении, от переносчика с низким редокс-потенциалом к переносчику с более высоким редокс потенциалом. Многоступенчатый транспорт электронов от НАДН и ФАДН2 к О2 по цепи этих переносчиков приводит к выбросу Н + из митохондриального матрикса в межмембранное пространство и генерированию протонного градиента. Протоны перекачиваются тремя видами электронпереносящих комплексов. АТФ синтезируется при обратном токе Н + через АТФ-синтетазный комплекс. Сопряжение окисления и фосфорилирования обеспечивается протонным градиентом через внутреннюю мембрану.
Дыхательная цепь включает в себя три основных белковых ферментативных комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану и две подвижные молекулы-переносчика (кофермент Q и цитохром С).
Сукцинатдегирогеназа, работающая в цикле трикарбоновых кислот, в цепи переноса электронов рассматривается как комплекс II. Комплексом V иногда называют АТФ-синтазу, хотя этот фермент не принимает участия в транспорте электронов. Комплексы (I-IV) дыхательной цепи состоят из большого числа полипептидных цепей и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками. К ним относятся ФМН (флавинмононуклеотид), ФАД (флавинадениндинуклеотид) в комплексах I и II; железо-серные (FeS) центры в комплексах I, II и III и группы гема в комплексах II, III и IV.
Коэнзим Q и цитохром С — мобильные переносчики электронов дыхательной цепи. Все другие белковые переносчики — интегральные белки, занимают в мембране строго фиксированное положение и ориентированы определенным образом.
Система цитохромов дыхательной цепи, убихинол-дегидрогеназа (цитохром с-редуктаза). Цитохром с-оксидаза.
Гем-содержащие белки-переносчики электоронов в дыхательной цепи называются цитохромами. В зависимости от спектральных характеристик выделяют три группы цитохромов a, b и c. Их структурные особенности определяют различия в электрохимических потенциалах этих белков. Все цитохромы, кроме цитохрома С, включены в состав ферментативных комплексов дыхательной цепи.
QH2-Дегидрогеназа (Коэнзим Q-цитохром с-редуктаза, комплекс III) состоит из 2 типов цитохромов (b1 и b2) и цитохрома с1. QH2-Дегидрогеназа переносит электроны от убихинола (QH2) на цитохром C. В комплексе III электроны передаются от цитохромов b на FeS-центры, затем на цитохром с1 и затем на цитохром С.
Цитохром С выполняет роль переносчика электронов от комплекса III к комплексу IV. Это водорастворимый белок массой 12,5 кДа, содержит 104 аминокислотных остатка, который перемещается по внешней стороне внутренней митохондриальной мембраны.
Цитохром с-оксидаза (комплекс IV) состоит из двух цитохромов типа аа3, каждый из которых имеет центр связывания с кислородом. Гем цитохромов типа а-а3 называют гем А. Он содержит вместо метильной (-СН3) и винильной (-СН=СН2) групп формильную (-СОН) группу и углеводородную цепь соответственно. Вторая особенность – наличие ионов меди в специальных белковых центрах (CuA-центры). Перенос электронов комплексом IV связан с изменением степени окисления ионов меди и железа в составе этого комплекса: Cu + ↔ Cu 2+ + e - и Fe 2+ ↔ Fe 3+ + e - . Этот ферментативный комплекс непосредственно переносит электроны на молекулярный кислород. При переносе электронов на О2 образуется, супероксид анион-радикал (супероксид радикал), далее гидропероксид-анион НО2‾,который связывая протон из митохондриального матрикса, превращается в пероксид водорода и далее восстанавливается до воды.
Окислительное фосфорилирование — синтез АТФ за счет энергии электронов мигрирующих по дыхательной цепи. Также окислительным фосфорилированием называют синтез АТФ за счет энергии трансмембранного электрохимического потенциала. Электрохимический потенциал является результатом переноса протонов из митохондриального матрикса в межмембранное пространство. Перенос протонов обусловлен движением электронов по дыхательной цепи. Окислительное фосфорилирование состоит из двух независимых, но функционально тесно связанных процессов:
• перенос электронов по дыхательной цепи, который катализируют ферментативные комплексы (от НАДН или QН2 к молекулярному кислороду), из-за высокой разности в электрохимических потенциалов доноров электронов (НАДН и QН2) и акцептора (О2) этот процесс является высоко экзергоническим и большая часть выделяющейся энергии используется для созданияпротонного градиента;
• синтез АТФ с помощью ферментативного комплекса (комплекс V), называемого протон-транспортирующая АТФ-синтаза, фосфорилирование АДФ с образованием АТФ процесс эндергонический, при этом используется энергия уже созданного протонного градиента.
Коэффициент Р/О (коэффициент окислительного фосфорилирования) является мерой эффективности дыхания как поставщика энергии для синтеза АТФ. Коэффициент Р/О (или Р/2е - ) численно равен отношению количества синтезированного АТФ к количеству атомов потребленного кислорода. Чем выше коэффициент, тем больше синтезируется АТФ в расчете на каждые 2 моль перенесенных электронов. В случае полной дыхательной цепи Р/О близок к 2,5 и в случае укороченной к 1,5.
Тканевое дыхание – это последовательность окислительно-восстановительных реакций, в результате которых происходит последовательный перенос водорода и электронов от субстрата к кислороду.
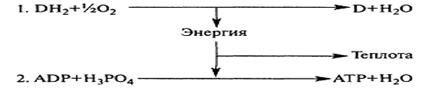
Тканевое дыхание включает:
Отнятие водорода от субстрата (дегидрогенирование);
Многоэтапный процесс переноса электронов на кислород;
Перенос электронов сопровождается уменьшением свободной энергии; часть этой энергии расходуется в виде тепла, а около 40 % используется на синтез АТФ. Тканевое дыхание и синтез АТФ энергетически сопряжены.
Ферменты отщепляющие водород от субстрата (дегидрогеназы), находятся в основном в матриксе митохондрий. Процесс тканевого дыхания протекает в митохондриях.
Всю систему реакций и ферментов тканевого дыхания называют дыхательной цепью. Перенос электронов на кислород происходит при участии системы переносчиков, встроенных во внутреннюю мембрану митохондрий и образующих цепь переноса электронов (ЦПЭ).
В состав ЦПЭ входят 3 ферментных комплекса:
НАДН – дегидрогеназа (І);( НАДН-ДГ-аза)
QН2 – дегидрогеназа (ІІІ);
Низкомолекулярные переносчики: кофермент Q, цитохром с небольшой по размерам белок.
Направление переноса протонов и электронов определяет окислительно-восстановительный потенциал – редокс-потенциал. Все компоненты ЦПЭ расположены в митохондриях в порядке возрастания редокс-потенциала; самый высокий редокс - потенциал у кислорода. Это обеспечивает последовательное перемещение электронов от НАДН на кислород, при котором происходит выделение энергии на каждом этапе ЦПЭ.
Таким образом, работа дыхательной цепи сводится к транспорту электронов от субстрата тканевого дыхания к кислороду, а также протонов, поставляемых субстратом и матриксом митохондрий. При транспорте в связи с падением редокс-потенциала освобождается энергия и в итоге образуется вода.
Все участники дыхательной цепи (ЦПЭ) разделены на четыре окислительно-восстановительные системы (комплексы).
I комплекс дыхательной цепи: НАДН – убихинон – оксидоредуктаза
Это сложный полиферментный комплекс, обладающий большой молекулярной массой. Он содержит более 20 различных белков, коферментом которых является ФМН. Кроме ФМН-зависимых ферментов, в состав I комплекса входят пять железосерных белков, которые осуществляют разделение потока протонов и электронов. В I комплексе дыхательной цепи непосредственно АТФ не образуется, а высвобождающаяся энергия аккумулируется или рассеивается в виде тепла.
SН2 – это субстраты доноры протонов и электронов - пируват, изоцитрат, малат, оксипроизводные жирных кислот, глутаминовая кислота. Они проникают вматрикс митохондрии и подвергаются воздействию НАДН – дегидрогеназы:
SН2 + НАД+ ДГ-аза → S + НАДН-ДГ-аза + Н+.
НАДН-ДГ-аза отнимает протоны и электроны у субстратов реакций, и передает их первому комплексу дыхательной цепи. В состав НАДН-ДГ-азы входит кофермент НАД + , содержащий витамин РР.
ФМН – флавинмононуклеотид, способен восстанавливаться, присоединяя два атома водорода (т.е. 2 протона и 2 электрона), отдаваемых НАДН-ДГ-ой:
Пять железосерных белков, осуществляют разделение потока протонов и электронов. При этом электроны от ФМНН2 переносятся к внутренней поверхности внутренней мембраны митохондрий (обращенной к матриксу), а протоны – к внешней поверхности внутренней мембраны, здесь они выделяются в межмембранное пространство.
II комплекс дыхательной цепи: сукцинат – убихинон – оксидоредуктаза
Этот комплекс отличается меньшей молекулярной массой, содержит железосерные белки. Субстратами комплекса являются: сукцинат, поступающий из матрикса митохондрий, а также жирные кислоты, которые находятся в матриксе. Коферментом комплекса является ФАД – флавинадениндинуклеотид. В II комплексе дыхательной цепи непосредственно АТФ не образуется, а высвобождающаяся энергия аккумулируется или рассеивается в виде тепла, этой энергии недостаточно для синтеза молекулы АТФ.
Убихинон (коэнзим Q) – посредник в передаче водородов. Это небольшая молекула (производное бензохинона) с длинной боковой цепью, способная свободно перемещаться как вдоль, так и поперек мембраны. Перемещаясь, молекулы убихинона захватывают протоны и электроны от комплексов I и II дыхательной цепи, а также протоны из матрикса. При этом убихинон восстанавливается:
КоQ + 2Н + + 2е ↔ КоQН2
Восстановленная форма (убихинол, КоQН2) в свою очередь передает 2 электрона III комплексу дыхательной цепи, а протоны при этом высвобождаются в межмембранное пространство.
III комплекс дыхательной цепи: убихинол – цитохром-с – оксидоредуктаза
IV комплекс дыхательной цепи: цитохром-с – оксидаза

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Тканевое дыхание — процесс окисления водорода кислородом до воды ферментами дыхательной цепи. Как указывалось выше, процесс образования воды описывается уравнением:

Дыхательная цепь — последовательность переносчиков электронов на кислород, локализованная во внутренней мембране митохондрий (ВММ). Роль таких переносчиков выполняют:
- активные формы витамина В2 — ФМН и ФАД (присоединяют электроны и протоны);
- атомы железа и меди в составе цитохромов;
- железосерные белки(FeS-белки); цитохромы и железосерные белки переносят только электроны;
- жирорастворимый переносчик электронов и протонов, свободно перемещающийся по мембране, — убихинол (КоQ).
Цель работы дыхательной цепи: провести реакцию окисления водорода кислородом с образованием эндогенной воды.
Принцип работы дыхательной цепи: разделение потоков протонов и электронов, поступающих из матрикса. Электроны передаются на конечный акцептор — кислород; протоны выбрасываются в межмембранное пространство (ММП).
Место того или иного переносчика в дыхательной цепи определяется величиной редокс-потенциала. Все реакции в дыхательной цепи направлены по термодинамической лестнице от компонента с самым отрицательным редокс-потенциалом (НАДH·Н + ) к кислороду, имеющему самый положительный редокс-потенциал.
Редокс-потенциал (Ео) численно равен э. д. с. в вольтах, возникающей между растворами окислителя и восстановителя (концентрации 1М, рН = 7,0, температура 25С). Чем отрицательнее редокс-потенциал системы, тем выше ее способность отдавать электроны (восстановители). Чем положительнее редокс-потенциал, тем выше способность вещества присоединять электроны (окислители).
Перенос электронов по дыхательной цепи осуществляется в следующей последовательности:

Во внутренней митохондриальной мембране переносчики электронов и протонов сгруппированы в 4 белково-липидных комплекса, пересекающих мембрану. Убихинол (КоQ) не входит в состав комплексов; цитохром с, являясь водорастворимым, находится в межмембранном пространстве:

Условные обозначения: ВММ — внутренняя мембрана митохондрий; ММП — межмембранное пространство; ПДГ — пиридинзависимые дегидрогеназы; ФДГ — флавинзависимые дегидрогеназы; ЭХП — электрохимический потенциал; РП — разность потенциалов между восстановителем и окислителем.
Комплексы дыхательной цепи
Ι. НАДН-убихинон-оксидоредуктаза. Принимает электроны и протоны от НАДН·Н + ; протоны выбрасываются в межмембранное пространство, электроны передаются на КоQ.
ΙΙ. Сукцинат-убихинон-оксидоредуктаза. Принимает электроны и протоны от субстратов в матриксе и передает их на убихинон.
Убихинон — липофильная молекула, хинон, легко перемещается по мембране, принимает электроны и протоны от Ι и ΙΙ комплексов дыхательной цепи и передает электроны на ΙΙΙ комплекс.
Цитохромы, входящие в состав дыхательной цепи, представляют собой железосодержащие белки, простетическая группа которых представлена гемом. Цитохромы могут переносить только электроны за счет атома железа с переменной валентностью, входящего в состав гемма:
Ш. Убихинол-цитохром с-оксидоредуктаза. Переносит электроны с убихинола на цитохром с. Одновременно за счет энергии, выделившейся при переносе, из матрикса переносятся протоны в межмембранное пространство.
IV. Цитохром с-оксидаза. Переносит электроны с цитохрома с непосредственно на кислород. Цитохромы а и а3, помимо атомов железа, содержат атомы меди, поэтому этот комплекс одновременно осуществляет полное (4-электронное) восстановление молекулы кислорода. Энергия переноса электронов используется на перекачивание в межмембранное пространство протонов.

Как указывалось выше, для синтеза АТФ необходимо затратить около 32 кДж/моль энергии. Для этого достаточной является разность потенциалов между окислителем и восстановителем не менее 0,26 вольта. Чанс, Скулачев установили, что таких участков в дыхательной цепи три. Они соответствуют I, III и IV комплексам и названы пунктами сопряжения или фосфорилирования.
Чтобы понять связь между транспортом электронов по дыхательной цепи и синтезом АТФ, познакомимся с V комплексом внутренней мембраны митохондрий — ферментом, осуществляющим реакцию синтеза АТФ и называемым протонной АТФ-синтазой (см. рис.). Этот ферментативный комплекс состоит из двух частей: Fо
(о – олигомицин), который встроен в мембрану и пронизывает ее насквозь, и F1, Последний по форме напоминает шляпку гриба или дверную ручку и обращен в матрикс митохондрии. В изолированном виде F1 не может синтезировать АТФ, но может проводить ее гидролиз до АДФ и фосфата.
Реакция синтеза АТФ, которую проводит V комплекс, носит название окислительного фосфорилирования и описывается уравнением:
Биохимики долго искали связь — промежуточные макроэргические соединения, которые могли бы служить посредником между процессом тканевого дыхания и окислительным фосфорилированием. Английский биохимик П. Митчелл предположил, что синтез АТФ V комплексом ВММ сопряжен с особым состоянием этой мембраны, и сформулировал хемиоосмотическую теорию окислительного фосфорилирования (Нобелевская премия 1978 г.).
Основные постулаты этой теории:
- внутренняя митохондриальная мембрана (ВММ) непроницаема для ионов, в частности для Н + и ОН – ;
- за счет энергии транспорта электронов через I, III и IV комплексы дыхательной цепи из матрикса выкачиваются протоны;
- возникающий на мембране электрохимический потенциал(ЭХП) и есть промежуточная форма запасания энергии;
- возвращение (транслокация) протонов в матрикс митохондрии через протонный канал V комплекса за счет ЭХП является движущей силой синтеза АТФ.
Дальнейшие исследования (Дж. Уокер, П. Бойер, Нобелевская премия 1997 г.) подтвердили предположения Митчелла. Ими показано, что энергия движения протонов используется на изменения конформации активного центра АТФ-синтазы, что сопровождается синтезом АТФ, а затем ее высвобождением. Образовавшаяся АТФ с помощью транслоказы перемещается в цитозоль; в ответ в матрикс митохондрии поступают АДФ и фосфат. Всего на процесс синтеза, высвобождения и выброса в цитозоль расходуется 4 протона.
При окислении НАД-зависимых субстратов в ММП выбрасывается 10 протонов (см. схему комплексов дыхательной цепи). Следовательно, в таком случае может быть синтезировано 2,5 моль АТФ (10:4), т. е. коэффициент фосфорилирования Р/О = 2,5. При окислении ФАД-зависимых субстратов в ММП выбрасывается 6 протонов в III и IV пунктах сопряжения. В таком случае может быть синтезировано 1,5 моль АТФ (6:4), т. е. коэффициент фосфорилирования Р/О = 1,5.
Теперь можно вернуться к пониманию энергетической функции цикла Кребса (см. предыдущую лекцию). В ЦТК происходят 4 реакции дегидрирования, причем 3 ДГ являются НАД-зависимыми и одна — ФАД-зависимой. За счет окисления водорода 3-х молекул НАДН . Н + в дыхательной цепи синтезируется 7,5 моль АТФ , окисление водорода 1 моль ФАДН2 ведет к синтезу 1,5 моль АТФ. Помимо этого, в ЦТК имеет место одна реакция субстратного фосфорилирования. Таким образом, энергетический выход окисления ацетил-КоА в цикле Кребса равен 10 моль АТФ (7,5 + 1,5 + 1). Этой цифрой мы будем пользоваться в дальнейших расчетах.
Регулируется скорость работы дыхательной цепи энергетическим зарядом клетки,
т. е. соотношением АТФ/АДФ. АДФ является стимулятором дыхательной цепи, АТФ – аллостерическим ингибитором.
Гипоэнергетические состояния возникают в организме вследствие дефицита АТФ в клетках. Причины их следующие:
- алиментарные (голодание, гиповитаминозы РР, В2);
- гипоксические (нарушения доставки О2 в клетки);
- митохондриальные (действие ингибиторов и разобщителей).
Среди последних различают, во-первых, ингибиторы дыхательной цепи. Это яды, которые блокируют перенос электронов через I, II, III, IV комплексы. Ротенон и барбитураты блокируют I комплекс, малонат — II, антимицин А – III, цианиды, угарный газ блокируют перенос электронов на кислород, осуществляемый IV комплексом дыхательной цепи.

Во-вторых, ингибиторы окислительного фосфорилирования (олигомицин), закрывающие протонный канал V комплекса.
В-третьих, разобщители окислительного фосфорилирования. Это вещества, которые подавляют окислительное фосфорилирование, не влияя при этом на процесс переноса электронов дыхательной цепью. Механизм действия разобщителей сводится к тому, что, являясь липофильными веществами, они обладают способностью связывать протоны и переносить их в матрикс, минуя протонный канал Н + АТФ-синтазы. Выделяющаяся при переносе электронов энергия рассеивается в виде тепла. Различают:
- разобщители естественные (продукты перекисного окисления липидов, жирные кислоты с длинной цепью, белки термогенины буровой жировой ткани, большие дозы йодсодержащих гормонов щитовидной железы);
- разобщители искусственные (динитрофенол, производные витамина К, некоторые антибиотики).
Пути утилизации кислорода клеткой
Большая часть кислорода, потребляемого клеткой (около 80 %), используется, как указано, в митохондриях с участием цитохромоксидазы. Это так называемый оксидазный путь. При этом происходит полное восстановление кислорода, причем субстрат не реагирует с кислородом непосредственно. Данный путь дает клетке энергию в виде АТФ. Помимо цитохромоксидазы существуют другие оксидазы (ФМН и ФАД-зависимые), которые катализируют реакции окисления веществ с образованием перекиси водорода
Наряду с этим существует другой путь окисления – оксигеназный. Он не дает клетке энергии, кислород включается в субстрат с образованием новой гидроксильной или карбоксильной группы. Этот путь происходит в основном в мембранах эндоплазматического ретикулума (микросомах). Путем микросомного окисления осуществляется α- и ω-окисление жирных кислот, синтез ненасыщенных жирных кислот, стероидов. Таким путем обезвреживаются ксенобиотики, т. е. чужеродные для организма вещества (лекарства, ядохимикаты, косметические препараты). Ферменты, осуществляющие такое окисление, называются оксигеназами. Различают диоксигеназы, которые включают в молекулу субстрата два атома молекулы кислорода. Более распространены в клетках монооксигеназы (гидроксилазы). Они катализируют реакции, при которых в молекулу субстрата включается один атом из молекулы кислорода, второй же атом кислорода восстанавливается при этом до воды. Монооксигеназные системы представляют собой короткие цепи переноса электронов и протонов, источником которых служит чаще всего восстановленный НАДФ + , реже НАД + или аскорбиновая кислота. Активатором кислорода при этом является цитохром Р450 – одноцепочечный хромопротеин с молекулярной массой 50 кДа.
Примерная схема монооксигеназной цепи выглядит следующим образом:

Смысл такого процесса заключается в том, что ксенобиотики, которые обычно гидрофобны, гидроксилируясь, становятся более гидрофильными, что способствует их обезвреживанию и выведению из организма с желчью или мочой. С участием микросомных систем осуществляется также биосинтез стероидов, желчных кислот, витамина Д3.
С появлением в атмосфере кислорода, а он появился тогда, когда возникли фотосинтезирующие организмы, стало возможным более эффективно использовать энергию, т. е. возник механизм окислительного фосфорилирования. Но, с другой стороны, вместе с этим кислород принес и новую опасность. При неполном восстановлении молекулы кислорода образуются высокоактивные формы (свободные радикалы), которые могут повреждать белки, нуклеиновые кислоты, липиды и способны даже убить живую клетку. Активные формы кислорода или свободные радикалы образуются в качестве промежуточных продуктов в ходе микросомного окисления, при работе дыхательной цепи, при воздействии ионизирующего излучения, при самопроизвольном окислении ряда веществ (гемоглобин). Свободные радикалы — молекулы, содержащие неспаренные электроны, агрессивные молекулы, которые атакуют другие молекулы с целью отнять у них электрон. К ним относятся: супероксидный радикал (О2 – ), перекисный радикал (О2 2– ), гидроперекисный радикал (НО 2– ), пероксид водорода (Н2О2), гидроксильный радикал (НО – ).
Свободные радикалы стимулируют разрывы в молекулах нуклеиновых кислот, нарушают функции белков, ведут к деполимеризации протеогликанов соединительной ткани, повреждают ненасыщенные жирные кислоты клеточных мембран, запуская, тем самым, механизм перекисного окисления липидов (ПОЛ). Вместе с тем свободные радикалы кислорода играют и положительную роль, так как участвуют в осуществлении фагоцитами и
Т-лимфоцитами их защитной функции.
Различают неферментативную и ферментативную защиту клеток. Важнейшим компонентом неферментативной защиты является витамин Е (токоферол), витамин размножения.
Являясь жирорастворимым витамином, он всасывается вместе с липидами, поступает в лимфатическую систему и кровяное русло, а оттуда — в ткани. Токоферол защищает ненасыщенные жирные кислоты клеточных мембран от перекисного окисления, предохраняет от окисления SH-группы мембранных белков, защищает от окисления двойные связи в молекулах каротинов и витамина А. Токоферол (совместно с витамином С) способствует включению селена в состав активного центра глутатионпероксидазы — важнейшего фермента антиоксидантной защиты клеток. Он контролирует синтез гема, цитохромов, стабилизирует биологические мембраны.
Ферментативная защита клеток от свободных радикалов (антиоксидантная защита) осуществляется с помощью следующих ферментов:
Читайте также:
- Сколько дней нетрудоспособности при ковидной пневмонии
- Можно ли предсказать наследование признака контролируемого двумя аллелями
- Что положено в основу деления атмосферы по слоям
- В какую сторону округлять копейки в декларации
- Для какой модели отношений врач пациент соблюдение правила информированного соглашения не характерно

