Какая фс осуществляет фотоиндуцированное окисление воды
Обновлено: 30.06.2024
КАРТОЧКА ПРОЕКТА,
ПОДДЕРЖАННОГО РОССИЙСКИМ НАУЧНЫМ ФОНДОМ
Информация подготовлена на основании данных из Информационно-аналитической системы РНФ, содержательная часть представлена в авторской редакции. Все права принадлежат авторам, использование или перепечатка материалов допустима только с предварительного согласия авторов.
Название Разработка комбинированных окислительных методов очистки и обеззараживания природных и сточных вод с использованием солнечного излучения
Руководитель Батоев Валерий Бабудоржиевич, Доктор биологических наук
Организация финансирования, регион Федеральное государственное бюджетное учреждение науки Байкальский институт природопользования Сибирского отделения Российской академии наук, Республика Бурятия
| Года выполнения при поддержке РНФ | 2014 - 2016 |
Область знания, основной код классификатора 04 - Биология и науки о жизни, 04-301 - Охрана окружающей среды
Ключевые слова Микрополлютанты, микроорганизмы, комбинированные окислительные процессы, солнечное излучение, очистка природных и сточных вод, обеззараживание
Код ГРНТИ 34.35.00
Статус Успешно завершен
ИНФОРМАЦИЯ ИЗ ЗАЯВКИ
Ожидаемые результаты
Будут исследованы механизмы генерации окислительных агентов при использовании предлагаемых комбинированных окислительных методов и выбраны наиболее эффективные для одновременной деструкции микрополлютантов и обеззараживания природной и сточной воды под воздействием солнечного излучения. Полагаем, что уровень предлагаемых исследований будет достаточно высок и будет соответствовать мировому уровню исследований в этой области. Основанием для этого является уровень наших исследований (результаты опубликованы в международных журналах с высоким импакт-фактором, а новизна исследований подтверждена российскими патентами) и также наше сотрудничество с исследователями из Департамента водных ресурсов и питьевой воды (Руководитель проф. Урс фон Гунтен (Prof. Urs von Gunten) Швейцарского федерального института водных исследований и технологий – Eawaq, Цюрих, Швейцария. Как известно, два швейцарских исследовательских института, Федеральный политехнический институт Лозанны (Lausanne, EPFL) и Швейцарский федеральный институт водных исследований и технологий (Zurich, Eawaq), являются признанными мировыми лидерами в области исследований процессов очистки и обеззараживания сточных вод и разработки новых технологий водоочистки. Мы также сотрудничаем с Национальным институтом перспективных индустриальных наук и технологий, Цукуба, Япония (National Institute of Advanced Industrial Science and Technology (AIST), Tsukuba, Japan) и Университетом Иены имени Фридриха Шиллера, Германия (Friedrich Schiller University of Jena, Germany). Эти научные учреждения также входят в мировую элиту в области исследований процессов очистки и обеззараживания природных и сточных вод. Результаты исследований могут найти широкое применение в практике очистки природной и сточной воды и её обеззараживании. Использование энергии солнечного излучения удешевляет технологии, делает их высоко энергоэффективными. География регионов, где такие технологии могут использоваться, очень широка: Африка, Юго-Восточная Азия, Центральная Америка. Применение этих технологий позволит приблизить решение крайне важной задачи – обеспечение людей качественной водой в экологически и эпидемически неблагополучных регионах планеты. Полученные результаты будут опубликованы в высокорейтинговых российских и зарубежных журналах, не менее: 1 монографии, 10 статей, из них 5 в изданиях, индексируемых в мировых базах научных данных (Scopus, Web of Science). Будут подготовлены и защищены выпускная квалификационная работа и кандидатская диссертация.
Аннотация результатов, полученных в 2015 году
На втором этапе реализации проекта (этап 2015 г.) сконструирован и изготовлен укрупненный лабораторный стенд для деструкции микрополлютантов и инактивации патогенной микрофлоры (E. coli, B. cereus) солнечным излучением. Солнечное излучение собирается (концентрируется) параболическими отражателями и направляется на фотореактор, состоящий из последовательно соединенных кварцевых трубок. По кварцевым трубкам с помощью перистальтического насоса подается исследуемый обрабатываемый водный раствор микрополлютантов и патогенной микрофлоры. На модельных растворах установлены кинетические закономерности окисления и минерализации биорезистентных органических микрополлютантов различной химической природы (п-хлорфенола, атразина, триклозана) при воздействии солнечного излучения в присутствии окислителей. Скорость и степень конверсии микрополлютантов возрастает в ряду: Solar
1. Tsydenova O., Batoev V., Batoeva A. Solar-Enhanced Advanced Oxidation Processes for Water Treatment: Simultaneous Removal of Pathogens and Chemical Pollutants International Journal of Environmental Research and Public Health, vol. 12 (8), p. 9542-9561 (год публикации - 2015).
2. Сизых М.Р., Батоева А.А. Окислительная деструкция микрополлютантов различной химической природы персульфатами: достижения и перспективы Научное обозрение, №15, С.231-246. (год публикации - 2015).
3. Хандархаева М.С., Батоева А.А., Асеев Д.Г., Сизых М.Р. Photoactivation of the Oxidation Process of para -Chlorophenol in Aqueous Solutions Russian Journal of Applied Chemistry, 2015, Vol. 88, No. 10, pp. 1605−1611. (год публикации - 2015).
Аннотация результатов, полученных в 2016 году
В результате проведенных исследований установлены кинетические закономерности фотохимического окисления и минерализации органических микрополлютантов под действием естественного солнечного излучения. Выявлено, что конверсия микрополлютантов возрастает в ряду Solar
1. Батоев В.Б., Гаркушева Н.М., Центер И.М., Матафонова Г.Г., Цыденова О.В. Использование симулированного солнечного излучения для очистки и обеззараживания воды в железо-персульфатной системе Научное обозрение, №5, с. 193-201 (год публикации - 2016).
3. Батоева А.А., Асеев Д.Г., Хандархаева М.С., Сизых М.Р. УСТАНОВКА ДЛЯ ОЧИСТКИ СТОЧНЫХ ВОД ОТ ТРУДНООКИСЛЯЕМЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ -, Положительное решение № 2016114021 (Заявка) (год публикации - ).
4. Гаркушева Н., Матафонова Г., Центер И., Бек С., Батоев В.Б., Линден К. Simultaneous Atrazine Degradation and E. coli Inactivation by Simulated Solar Photo-Fenton-like Process Using Persulfate Journal of Environmental Science and Health Part A. Toxic/Hazardous Substances and Environmental Engineering, - (год публикации - 2017).
5. Матафонова Г.Г., Батоев В.Б., Батоева А.А., Сизых М.Р., Асеев Д.Г., Гаркушева Н.М., Центер И.М., Попова С.А., Хандархаева М.С., Цыденова О.В. ОРГАНИЧЕСКИЕ МИКРОПОЛЛЮТАНТЫ И КОМБИНИРОВАННЫЕ ОКИСЛИТЕЛЬНЫЕ МЕТОДЫ ИХ ДЕСТРУКЦИИ кол. монография / отв. ред. В. Б. Батоев. – Улан-Удэ: Изд-во БНЦ СО РАН, 2016. – 212 с., - (год публикации - 2016).
6. Хандархаева М., Батоева А., Асеев Д., Сизых М., Цыденова О. Oxidation of atrazine in aqueous media by solar- enhanced Fenton-like process involving persulfate and ferrous ion Ecotoxicology and Environmental Safety, vol. 137, pp. 35-41 (год публикации - 2017).
7. Хандархаева М.С., Асеев Д.Г., Сизых М.Р., Батоева А.А. Oxidation of Atrazine by Photoactivated Potassium Persulfate in Aqueous Solutions Russian Journal of Physical Chemistry A, No.11, Vol. 90, pp. 2177-2182 (год публикации - 2016).
8. Центер И., Матафонова Г., Батоев В. Combination of high-frequency ultrasound and UV radiation of excilamp for surface disinfection Engineering in Life Sciences, Vol. 15, Issue 8, pp. 830-834 (год публикации - 2015).
Evaluation of phenols toxicity using microalgae photosynthetic characterisyics
Плеханов С. Е.
Sergey E. Plekhanov
Московский государственный университет имени М.В. Ломоносова,
биологический факультет, кафедра гидробиологии
Нарушения в фотосинтетических процессах в клетках зеленых микроводорослей в присутствии фенолов определяются их способностью воздействовать на фотосинтетический электронный транспорт. Это отражается в разнообразных функциональных откликах, связанных с химической лабильностью фенольных соединений, их окислительно-восстановительными свойствами, что необходимо учитывать при биотестировании.
Ключевые слова : Scenedesmus quadricauda; фенолы; электронный транспорт; флуоресценция хлорофилла; фотосистема 2; токсичность.
Фенольные соединения присутствуют в сточных водах многих предприятий и являются опасными для фитопланктона – основы функционирования водных экосистем. Такие фенольные соединения как фенол (оксибензол) и гидрохинон (пара-диоксибензол), являются основой 2-х групп фенольных соединений, связанных способностью к окислительной трансфщрмации: 1. Фенол – пирокатехин (орто-диоксибензол) – орто-бензохинон – 4-фенилсульфонилпирокатехин – продукты окислительной конденсации; 2. Гидрохинон – пара-бензохинон – продукты окислительной конденсации. Эти группы встречаются в сточных водах различных предприятий. В настоящее время микроводоросли рассматривают в качестве биомаркеров токсических воздействий (Podola et al., 2004; ISO 8692, 2004), а для диагностики физиологического состояния клеток успешно используют параметры флуоресценции хлорофилла (Хл), связанные с первичными реакциями фотосинтеза (Brack, Frank, 1998; Strom et al., 2009; Маторин и др., 2010). Основная цель работы заключалась в исследовании влияния фенолов сточных вод на физиологическое состояние хлорококковых водорослей, по функциональным реакциям, связанным с продуктивностью.
Материалы и методы.
Результаты и обсуждение
Рост культур при действии фенолов. Поскольку определение действия фенолов на хлорококковые водоросли, широко используемых в качестве тест-объектов, проводили обычно по фенолу (Лукина, 1972), а в сточных водах содержатся разнообразные фенольные соединения, были использованы представители 2-х групп фенолов, указанных выше.
Фенол в концентрации 0,1 мМ вызывал некоторое удлинение лагфазы, затем число клеток после короткой фазы экспоненциального роста разко увеличивалось. Увеличение концентрации фенола до 0,5 мМ вызывала стимуляцию роста численности клеток, к концу опыта она составляла 30 млн/мл.
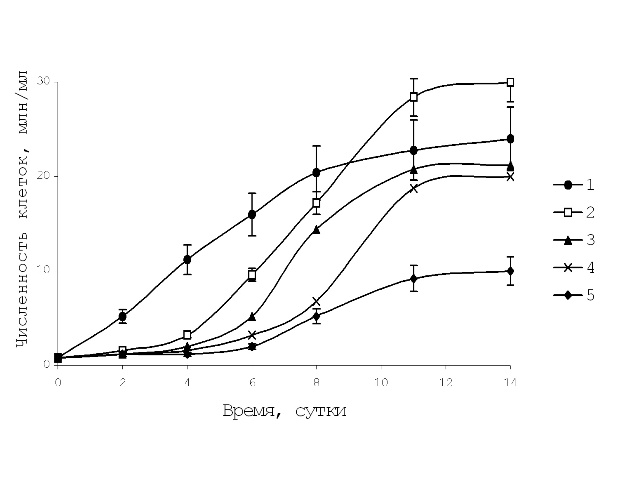
Рис. 1. Влияние гидрохинона на рост численности клеток водоросли S. quadricauda.
1 – контроль, 2, 3, 4, 5 – при добавлении (гидрохинона 0,01; 0,05; 0,1; 0,5 мМ).
Фенол в концентрации 5 мМ подавлял рост S. quadricauda на протяжении всей кривой роста культуры. Фенол в концентрациях (0,1–1 мМ) вызывал стимуляцию роста культуры а при 5 мМ подавлял его. Можно предположить, что концентрация 1 мМ является пороговой.
Гидрохинон, в отличие от фенола, только в низкой концентрации – 0,01 мМ вызывал стимуляцию роста численности, в конце опыта она составила 30 млн/мл, тогда как в контроле – 24 млн/мл. Увеличение концентрации гидрохинона до 0,05 мМ приводило к удлинению лагфазы, кривая роста проходила ниже контрольной. Гидрохинон в концентрации 0,5 мМ наиболее токсичен, численность к 14 сут. достигала лишь 10 млн/мл (рис. 1). При более высоких концентрациях культура не развивалась. Пара-бензохинон, так же как гидрохинон, в концентрации 0,01 мМ стимулировал рост числа клеток с 10 сут. В присутствии низких концентраций гидрохинона или п-бензохинона (0,01 мМ) наблюдали стимуляцию роста численности клеток. Увеличение концентрации п-бензохинона в 5 раз резко угнетало рост культуры и число клеток к 14 сут. составило 15 млн/мл, а при концентрации выше 0,5 мМ культура водоросли погибала. Пара-бензохинон является основным продуктом окисления гидрохинона и чаще всего они находятся в смеси 1 : 1, и возможно поэтому эффекты их действия были сходны. Опыты для определения влияния пирокатехина на характер кривой роста численности клеток S. quadricauda показали, что пирокатехин (0,1 мМ) подавляли рост численности клеток особенно эффективно на 2-4 сут. Пирокатехин в концентрации 0,1 мМ угнетал рост численности в той же степени, что и гидрохинон или п-бензохинон.
Эффекты стимуляции численности клеток при действии фенолов сточных вод, полученные нами на водоросли S. quadricauda можно объяснить возможным участием фенолов в регуляции ростовых процессов. Например, система, состоящая из о-дифенола и полифенолоксидазы, стимулирует синтез ауксина из триптофана. (Барабой, 1976). Ингибирующие эффекты фенолов могут быть связаны с их влиянием на энергетику клеток и воздействием хинонных форм на сульфгидрильные группы ферментов (Сиренко, Козицкая, 1988). Общим в действии исследованных фенолов является ингибирование процессов роста численности клеток водоросли в начале кривой роста (2–5 сут.) и удлинение лагфазы. Подавление роста численности S. quadricauda происходило при добавлении в среду фенольных соединений в концентрациях: фенола – 5 мМ, гидрохинона или п-бензохинона – 0,05 мМ, пирокатехина – 0,1 мМ.
Воздействие фенольных соединений на фотосинтетические характеристики микроводорослей. Ингибирование фотосинтетических процессов при действии фенолов представляется наиболее важной стороной их токсичности, так как это вызывает нарушение путей трансформации световой энергии в важнейшем звене водных экосистем. Исследование влияния фенолов сточных вод на фотосинтетическую активность S. quadricauda проводили по скорости фотоиндуцированного выделения кислорода, отражающей скорость ФЭТ в ЭТЦ от H2O к НАДФ + . Добавление в среду фенола в концентрациях 0,1–0,5 мМ приводило к увеличению СВК, которое сохранялось в период 2–6 сут., а затем снижалось ниже контроля. К 8 сут. уровень СВК становился ниже контрольного, что указывает на подавление фотосинтетической активности. Стимуляцию СВК целых клеток S. quadricauda наблюдали также при добавлении в культуральную среду гидрохинона, или пирокатехина или п-бензохинона 0,01–0,1 мМ. (рис. 2). Превышение над контрольным уровнем сохранялось до конца стационарной фазы роста культуры, в дальнейшем наблюдали снижение СВК, вплоть до конца эксперимента.
Увеличение СВК клетками водорослей противоречит подавлению роста численности клеток действием фенолов. Увеличение СВК при добавлении токсикантов в среду культуры водоросли S. quadricauda, очевидно, связано с их способностью к действию на транспорт электронов соответствующих продуктов окисления – о- и п-хинонов. Известно, что акцепция электронов из ЭТЦ на уровне акцепторов QA и QB не исключена для хинонных аналогов фенольных соединений (Vermaas, 1993). При этом функционирование ЭТЦ и фотовосстановление НАДФ + нарушается. Следовательно, ФС сточных вод могут нарушать функционирование ФЭТ вблизи ФС 2, и стимуляция СВК не связана с ускорением поступления электронов к конечным акцепторам.
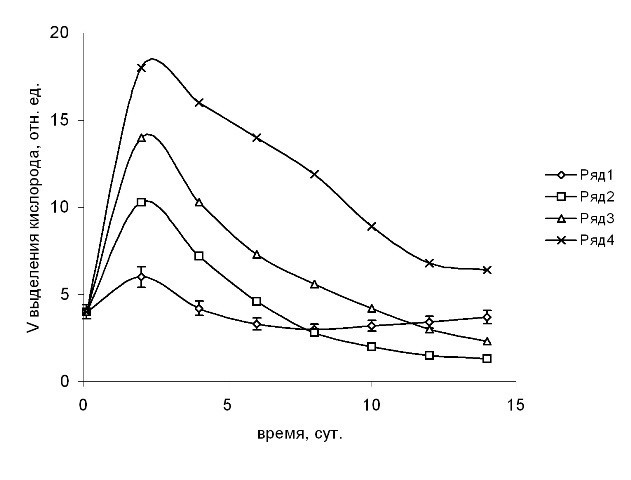
Рис. 2. Влияние п-бензохинона на СВК клетками водоросли S. quadricauda.
1 – контроль, 2, 3, 4 – в присутствии п-бензохинона в концентрациях 0,01; 0,05; 0,1 мМ соответственно. Токсикант добавляли на 2-е сут. роста
Флуоресценция Хл микроводорослей при действии фенолов. С активностью ФС 2 тесно связаны параметры ЗФ Хл, интенсивность которой зависит от интактности реакционных центров (РЦ) ФС 2. (Маторин, Венедиктов, 1990). Интенсивность стационарного уровня ЗФ клеток водоросли S. quadricauda после добавления в среду фенола возрастала с увеличением концентрации от 0,1 до 1 мМ, а при концентрации 5 мМ значительно снижалась на 2 сут. К 4-6 сут. наблюдали снижение интенсивности ЗФ суспензии водоросли с добавками фенола 0,1-1 мМ. При концентрации фенола 5 мМ первоначальное снижение интенсивности ЗФ сменялось постепенным увеличением до 50% от контрольного к 11 сут. При добавлении в культуральную среду S. quadricauda гидрохинона стимуляцию интенсивности ЗФ наблюдали лишь при концентрации 0,01 мМ на 2 сут. (рис. 3). Затем происходило снижение интенсивности ЗФ. Гидрохинон в концентрациях 0,05–0,5 мМ вызывал снижение интенсивности ЗФ клеток водоросли сразу после добавления до уровня 5–10 отн. ед. (контроль – 40 отн. ед.). Близкие к таковым для гидрохинона результаты по ЗФ водоросли S. quadricauda были получены в присутствии в среде п-бензохинона (0,01–0,5 мМ). Гидрохинон в равных с п-бензохиноном концентрациях был более эффективным по отношению к ЗФ и в концентрации 0,01 мМ вызывал стимулирующий эффект, которого не наблюдали в опытах с п-бензохиноном. Действие пирокатехина на ЗФ клеток водоросли было близким к таковому гидрохинона.
Стимуляция уровня ЗФ на 2 сут. развития культуры сразу после добавления фенола (0,1-1 мМ) может быть связана с первичной адаптивной реакцией фотосинтетического аппарата, которая выразилась в росте скорости ФЭТ. На возможность подобных адаптивных реакций фотосинтетического аппарата указывалось ранее (Trebst, Draber, 1986). Последующее снижение ЗФ, очевидно, определяется снижением скорости ЭТ и энергизации фотосинтетических мембран. Гидрохинон в равных с п-бензохиноном концентрациях был в 2 раза более эффективным по отношению к ЗФ и в концентрации 0,01 мМ вызывал первоначальный стимулирующий эффект, которого не наблюдали в опытах с п-бензохиноном. Действие пирокатехина на ЗФ клеток водоросли было близким к таковому гидрохинона. По характеру нарушения фотосинтетических процессов в зависимости от концентрации гидрохинон и пирокатехин должны быть отнесены к остротоксичным специфическим соединениям.
Таким образом, фенол, пирокатехин, гидрохинон и п-бензохинон вызывали снижение интенсивность ЗФ культуры водоросли S. quadricauda, что указывает на подавление активности ФС 2. По величине ингибирующего действия на интенсивность стационарного уровня ЗФ исследованные фенолы можно расположить в ряд по снижению эффекта: гидрохинон, п-бензохинон, пирокатехин, фенол. Действие фенолов на клетки водоросли проявляется практически немедленно после добавления в культуральную среду. После прохождения стационарной фазы роста культуры эффекты действия фенолов постепенно снижаются, очевидно в связи с разрушением фенольных соединений и уменьшением их содержания в средах.
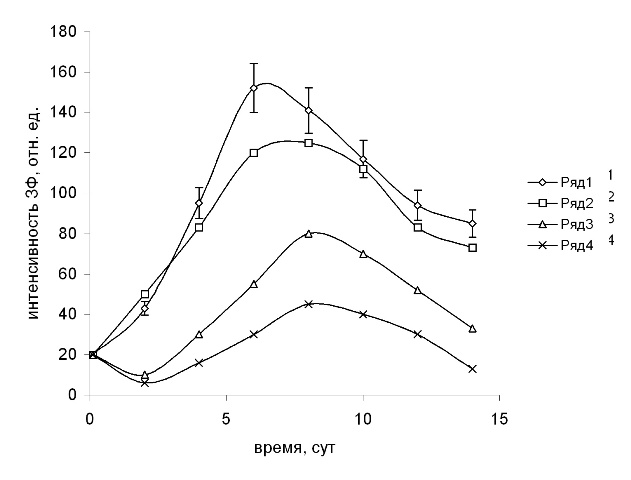
Рис. 3. Интенсивность стационарного уровня ЗФ (отн. ед.) культуры S. quadricauda в присутствии гидрохинона.
1 – контроль, 2–4 при добавлении гидрохинона в концентрациях: 0,01; 0,1; 0,2 мМ соответственно. Добавление фенолов – 2-е сут. роста.
Наблюдаемое подавление фенолами стационарного уровня ЗФ, отражающего функциональную активность ФС 2, связано со снижением вероятности накопления РЦ, способных к разделению заряда, и ингибированием ЭТ. Таким образом, судя по интенсивности стационарной ЗФ нарушения функционирования ФС 2 происходили сразу после начала контакта культуры с фенолом в концентрации 0,1 мМ, с гидрохиноном, пирокатехином и п-бензохиноном – 0,01 мМ.
Возможно, влияние легкоокисляемого гидрохинона или пирокатехина на эффективность ФС 2 определяется действием промежуточных продуктов окисления – семихинонных радикалов и хинонов. Гидрохинон, пирокатехин и п-бензохинон должны быть отнесены к остротоксичным специфическим соединениям, а фенол – к. неспецифическим. Эти соединения в разной степени и в зависимости от концентрации нарушают интактность фотосинтетического аппарата клеток S. quadricauda. Изменения начальных стадий поглощения и транспорта энергии возбуждения в световой фазе фотосинтеза имеют определяющее значение для функционального состояния и продукционных свойств водоросли. Сопоставление изменений флуоресценции Хл клеток с кривыми роста культуры S. quadricauda позволяет полагать, что независимо от того, какие участки процесса фотосинтеза повреждены действием исследованных дифенолов, наблюдаются нарушения в характере развития культуры.
Можно утверждать, что метод ЗФ является наиболее чувствительным при определении токсичности фенолов для микроводорослей. Сложный характер зависимости ЗФ от скорости ЭТ, степени энергизации тилакоидных мембран с одной стороны, затрудняет однозначную интерпретацию изменений интенсивности ЗФ, с другой – позволяет судить об интактности мембран тилакоидов и о функциональном состоянии фотосинтетического аппарата клеток. Это позволяет рекомендовать ЗФ для целей биотестирования, токсикометрии фенольных соединений.
1. Барабой В.А. Биологическое действие растительных фенольных соединений. – Киев: Наукова думка, 1976.– 260с.
2. Лукина Г.А. Детоксицирующая активность хлореллы // Инф.бюлл. Ин-та биол. внутр. вод. 1972. № 13. С. 12-15.
3. Максимов В.Н. Многофакторный эксперимент в биологии.М.: МГУ, 1980.– 279 с.
4. Маторин Д.Н., Венедиктов П.С. Люминесценция хлорофилла в культурах микроводорослей и природныз популяциях фитопланктона // Итоги науки и техники. Биофизика. – М.: ВИНИТИ, 1990 –.С.49-100.
5. Маторин Д.Н., Осипов В.А., Венедиктов П.С., Рубин А.Б. Замедленная флуоресценция растений и водорослей. Теоретические и практические аспекты. М.: Альтекс, 2011. – 202 с.
6. Сиренко Л.А., Козицкая В.Н. Биологически активные вещества водорослей и качество воды. Киев: Наукова думка, 1988. – 256 с.
7. Стом Д.И. Фитотоксичность и механизм детоксикации фенолов водными растениями: Автореф. дис. докт. биол. наук. – Киев, 1982. – 48 с.
8. Brack W., Frank H. Chlorophyll a fluorescence: a tool for the investigation of toxic effects in the photosynthetic apparatus // Ecotoxicology and Environmental Safety. 1998. V. 40, N l. P. 34-41.
9. ISO 8692. Water quality – Freshwater algal growth inhibition test with unicellular green algae. Geneva: International Organization for Standardization, 2004. – 230 p.
10. Podola B., Nowack E.C., Melkonian V. The use of multiple-strain algal sensor chips for detection and identification of volatile organic compounds // Biosens. Bioelectron. 2004. V. 15, N 19. P. 1253-1260.
11. Strom D., Ralph G. P. J., Stauber L. Development of a Toxicity Identification Evaluation Protocol Using Chlorophyll-a Fluorescence in a Marine Microalga // Arch. Environ. Contam. Toxicol. 2009 V. 56. P. 30-38.
12. Trebst A., Draber W. Inhibitors of photosystem II and the topology of the herbicide and QB binding polypeptide in the thy tilakoid membrane // Photosynthesis Res. 1986. V. 10. P. 381-392.
13. Vermaas W. Molecular-biological approaches to analyze photosystem II structure and function // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1993. V. 44. P. 457-481.
Статья поступила в редакцию 20.12.2015
Evaluation of phenols toxicity using microalgae photosynthetic characterisyics
Sergey E. Plekhanov
The disturbances in photosynthetic processes in green microalga cells in the presence of phenols determined by its capacity to influence on the electrontransport reactions. Then it reflected at different functional responses by means of its chemical lability and oxidative-reductional properties. This fact must be taking into account on biotesting.
Key words : Scenedesmus quadricauda; phenols; electron transport; fluorescence of chlorophyll; photosystem 2; toxicity.
Плеханов Сергей Елисеевич – Plekhanov Sergey Eliseevich
Корреспондентский адрес: Россия, 119991, Москва, Ленинские горы, Московский Государственный Университет им.М.В.Ломоносова, д. 1, стр. 12, Биологический ф-т, каф. гидробиологии
Читайте также:

