Как согласовать представление о высокой химической активности алюминия с наблюдаемым
Обновлено: 04.07.2024
\u0410\u043b\u044e\u043c\u0438\u043d\u0438\u0439 \u043e\u0447\u0435\u043d\u044c \u0431\u044b\u0441\u0442\u0440\u043e \u043f\u043e\u043a\u0440\u044b\u0432\u0430\u0435\u0442\u0441\u044f \u0438\u043d\u0435\u0440\u0442\u043d\u043e\u0439 \u043f\u043b\u0435\u043d\u043a\u043e\u0439 \u043a\u043e\u0440\u0443\u043d\u0434\u0430 Al2O3, \u043a\u043e\u0442\u043e\u0440\u044b\u0439,\u043a \u0442\u043e\u043c\u0443 \u0436\u0435, \u043e\u0431\u043b\u0430\u0434\u0430\u0435\u0442 \u0432\u044b\u0441\u043e\u043a\u043e\u0439 \u043f\u0440\u043e\u0447\u043d\u043e\u0441\u0442\u044c\u044e. \u041f\u043e\u044d\u0442\u043e\u043c\u0443 \u043c\u043e\u0436\u043d\u043e \u0441\u043f\u043e\u043a\u043e\u0439\u043d\u043e \u0433\u043e\u0442\u043e\u0432\u0438\u0442\u044c \u043f\u043e\u0436\u0440\u0430\u0442\u044c \u0438 \u0435\u0434\u0443. ">,
\u0430\u043b\u044e\u043c\u0438\u043d\u0438\u0439 \u0445\u0438\u043c\u0438\u0447\u0435\u0441\u043a\u0438 \u0447\u0435\u0440\u0435\u0441\u0447\u0443\u0440 \u0430\u043a\u0442\u0438\u0432\u0435\u043d. \u0414\u043b\u044f \u043d\u0430\u0447\u0430\u043b\u0430 \u043e\u043d \u0430\u043a\u0442\u0438\u0432\u043d\u043e \u0440\u0435\u0430\u0433\u0438\u0440\u0443\u0435\u0442 \u0441 \u043a\u0438\u0441\u043b\u043e\u0440\u043e\u0434\u043e\u043c \u0432\u043e\u0437\u0434\u0443\u0445\u0430. \u0415\u0433\u043e \u043f\u043e\u0432\u0435\u0440\u0445\u043d\u043e\u0441\u0442\u044c \u0431\u044b\u0441\u0442\u0440\u043e \u043f\u043e\u043a\u0440\u044b\u0432\u0430\u0435\u0442\u0441\u044f \u043f\u043b\u043e\u0442\u043d\u043e\u0439 \u043f\u043b\u0435\u043d\u043a\u043e\u0439 \u043e\u043a\u0441\u0438\u0434\u0430 Al2\u041e3, \u043a\u043e\u0442\u043e\u0440\u0430\u044f \u043f\u0440\u0435\u043f\u044f\u0442\u0441\u0442\u0432\u0443\u0435\u0442 \u0434\u0430\u043b\u044c\u043d\u0435\u0439\u0448\u0435\u043c\u0443 \u0434\u043e\u0441\u0442\u0443\u043f\u0443 \u043a\u0438\u0441\u043b\u043e\u0440\u043e\u0434\u0430 \u043a \u043c\u0435\u0442\u0430\u043b\u043b\u0443 \u0438 \u043f\u0440\u0438\u0432\u043e\u0434\u0438\u0442 \u043a \u043f\u0440\u0435\u043a\u0440\u0430\u0449\u0435\u043d\u0438\u044e \u0440\u0435\u0430\u043a\u0446\u0438\u0438. \u041a\u0441\u0442\u0430\u0442\u0438, \u0442\u0430\u043a\u0443\u044e \u0436\u0435 \u0444\u043e\u0440\u043c\u0443\u043b\u0443 \u0438\u043c\u0435\u0435\u0442 \u043a\u043e\u0440\u0443\u043d\u0434, \u0440\u0430\u0437\u043d\u043e\u0432\u0438\u0434\u043d\u043e\u0441\u0442\u044c \u043a\u043e\u0442\u043e\u0440\u043e\u0433\u043e \u2014 \u0434\u0440\u0430\u0433\u043e\u0446\u0435\u043d\u043d\u044b\u0439 \u043a\u0430\u043c\u0435\u043d\u044c \u0441\u0430\u043f\u0444\u0438\u0440. \u0412\u0438\u0434\u0438\u0442\u0435 \u2014 \u043d\u0430\u0448\u0438 \u0430\u043b\u044e\u043c\u0438\u043d\u0438\u0435\u0432\u044b\u0435 \u043a\u0430\u0441\u0442\u0440\u044e\u043b\u0438 \u0438\u043c\u0435\u044e\u0442 \u043f\u043e\u043a\u0440\u044b\u0442\u0438\u0435 \u0447\u0443\u0442\u044c \u043b\u0438 \u043d\u0435 \u0438\u0437 \u0441\u0430\u043f\u0444\u0438\u0440\u0430! \u041a\u0430\u0437\u0430\u043b\u043e\u0441\u044c \u0431\u044b, \u044d\u0442\u043e \u0445\u043e\u0440\u043e\u0448\u043e, \u043e\u043a\u0441\u0438\u0434\u043d\u0430\u044f \u043f\u043b\u0435\u043d\u043a\u0430 \u043f\u0440\u0438\u0434\u0430\u0435\u0442 \u0430\u043b\u044e\u043c\u0438\u043d\u0438\u0435\u0432\u043e\u0439 \u043f\u043e\u0441\u0443\u0434\u0435 \u0430\u043d\u0442\u0438\u043a\u043e\u0440\u0440\u043e\u0437\u0438\u0439\u043d\u044b\u0435 \u0441\u0432\u043e\u0439\u0441\u0442\u0432\u0430. \n
\u041d\u043e \u044d\u0442\u0430 \u043f\u043b\u0435\u043d\u043a\u0430 \u043e\u0447\u0435\u043d\u044c \u0442\u043e\u043d\u043a\u0430, \u0438 \u0430\u043b\u044e\u043c\u0438\u043d\u0438\u0435\u0432\u0430\u044f \u043f\u043e\u0441\u0443\u0434\u0430 \u043b\u0435\u0433\u043a\u043e \u0446\u0430\u0440\u0430\u043f\u0430\u0435\u0442\u0441\u044f.\u00a0 \u0438\u0437-\u0437\u0430 \u043d\u0435\u0435 \u0432\u043e\u0437\u043d\u0438\u043a\u0430\u044e\u0442 \u043e\u0447\u0435\u043d\u044c \u043d\u0435\u043f\u0440\u0438\u044f\u0442\u043d\u044b\u0435 \u0431\u043e\u043b\u0435\u0437\u043d\u0438. \n
\u041a\u0440\u043e\u043c\u0435 \u0442\u043e\u0433\u043e, \u0437\u0430\u0449\u0438\u0442\u043d\u0430\u044f \u043e\u043a\u0441\u0438\u0434\u043d\u0430\u044f \u043f\u043b\u0435\u043d\u043a\u0430 \u043b\u0435\u0433\u043a\u043e \u0440\u0430\u0441\u0442\u0432\u043e\u0440\u044f\u0435\u0442\u0441\u044f \u0440\u0430\u0441\u0442\u0432\u043e\u0440\u0430\u043c\u0438 \u0449\u0435\u043b\u043e\u0447\u0435\u0439. \u0410 \u043c\u043d\u043e\u0433\u0438\u0435 \u043f\u0438\u0449\u0435\u0432\u044b\u0435 \u043f\u0440\u043e\u0434\u0443\u043a\u0442\u044b \u043a\u0430\u043a \u0440\u0430\u0437 \u0438\u043c\u0435\u044e\u0442 \u0449\u0435\u043b\u043e\u0447\u043d\u0443\u044e \u0440\u0435\u0430\u043a\u0446\u0438\u044e, \u043d\u0430\u043f\u0440\u0438\u043c\u0435\u0440, \u043a\u0430\u0440\u0442\u043e\u0444\u0435\u043b\u044c, \u0437\u0435\u043b\u0435\u043d\u044b\u0435 \u0449\u0438 \u0438\u0437 \u0449\u0430\u0432\u0435\u043b\u044f, \u043c\u043d\u043e\u0433\u0438\u0435 \u0441\u0443\u043f\u044b. \u0412\u0441\u043b\u0435\u0434 \u0437\u0430 \u044d\u0442\u0438\u043c \u0432\u0441\u0442\u0443\u043f\u0430\u0435\u0442 \u0432 \u0440\u0435\u0430\u043a\u0446\u0438\u044e \u043e\u0431\u043d\u0430\u0436\u0438\u0432\u0448\u0438\u0439\u0441\u044f \u0438\u0437-\u043f\u043e\u0434 \u043e\u043a\u0441\u0438\u0434\u043d\u043e\u0439 \u043f\u043b\u0435\u043d\u043a\u0438 \u0430\u043b\u044e\u043c\u0438\u043d\u0438\u0439, \u043e\u0431\u0440\u0430\u0437\u0443\u044f \u043d\u0435\u0431\u0435\u0437\u043e\u0431\u0438\u0434\u043d\u044b\u0435 \u0434\u043b\u044f \u043d\u0430\u0448\u0435\u0433\u043e \u0437\u0434\u043e\u0440\u043e\u0432\u044c\u044f \u0441\u043e\u0435\u0434\u0438\u043d\u0435\u043d\u0438\u044f. \n">]" data-test="answer-box-list">
Сертификат и скидка на обучение каждому участнику

Выбранный для просмотра документ Рабочий лист.docx
Рабочий лист
Проблемный вопрос: № 13 Счастливый или несчастливый?!
Работа в командах (3 команды)
Выполнение упражнения с помощью ЭОР
Характеристика по положению в ПСХЭ
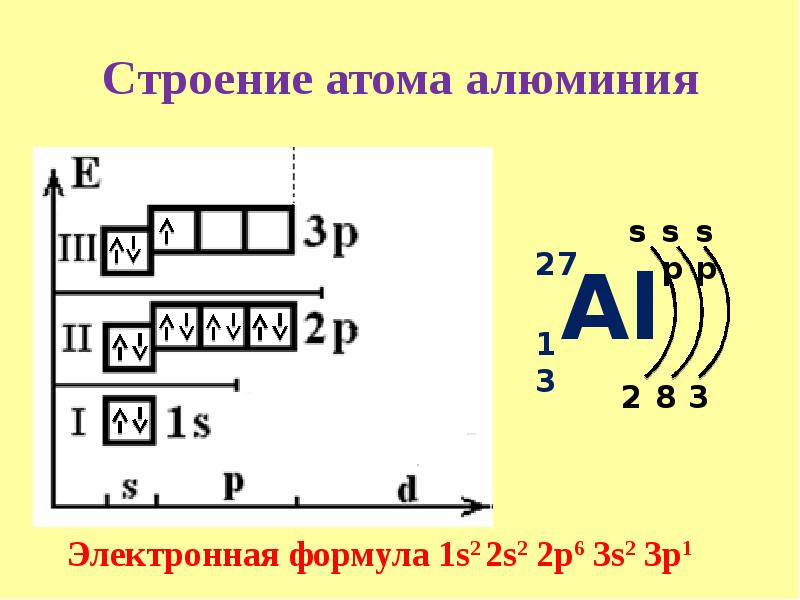
Строение атома Al
Сравнение свойств и вывод об активности алюминия
Работа в парах. Рассмотреть образцы алюминия и высказать свои предположения о возможном применении алюминия на основе его физических свойств. Использовать информацию в учебнике (с. 126)
План характеристики физических свойств металла алюминия:
1. В каком агрегатном состоянии находится алюминий при данных условиях?
2. Какого цвета? Блеск?
3. Имеет ли алюминий запах?
4. Проявляет ли данный металл пластичность, хрупкость, эластичность?
5. Растворяется ли в воде при данных условиях?
6. Какова температура плавления?
7. Какова плотность вещества?
8. Обладает ли алюминий теплопроводностью и электропроводностью?
Химические свойства алюминия:
2. Взаимодействие алюминия с ________________:
3. Взаимодействие с ____________________:
4. Взаимодействие с ____________________:
Инструкция по выполнению лабораторной работы Приложение 1
Цель: Изучить отношение алюминия к кислотам и щелочам.
Правила работы с кислотами и щелочами: Соблюдай осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промой водой! При нагревании, прогрей сначала всю пробирку, направляя отверстие в сторону от себя и соседа. Спиртовку поджигайте только при помощи спичек.
Опыт 1. В пробирку положите 1 гранулу алюминия и прилейте 3-4 мл раствора соляной кислоты. Пробирку слегка прогрейте.
Опыт 2. В пробирку положите 1 гранулу алюминия и прилейте 3-4 мл. раствора гидроксида натрия. Пробирку слегка прогрейте Запишите уравнения проведенных реакций. Сделайте выводы о реакционной способности алюминия.
Выводы:
Результаты лабораторного опыта №1
Примечание: Можно изменять падеж слов и использовать другие слова:
А) глина , полевые шпаты, земная кора;
Б)рубины, наждак, сапфиры
Вопросы –сужения: (работа в группах)
Используя информацию по применению и получению алюминия (распечатка на столах), составьте вопросы –сужения:
Почему? Как доказать? Чем объяснить? Вследствие чего? В каком случае? Каким образом?
Работа с таблицей (работа в группах) Приложение 3
Найдите в таблице клетки, соответствующие обусловленности применения алюминия его свойствам. Из букв, соответствующих правильным ответам, вы составите название одного из природных соединений алюминия. Составьте уравнения реакций, характеризующих химические свойства алюминия, перечисленные в таблице. Рассмотрите их с точки зрения окислительно-восстановительных реакций.
Подумайте, почему в некоторых клетках стоят *?
Самым распространенным в земной коре металлом является
Самым активным металлом среди перечисленных является
Амф o терные соединения образует
Сплав на основе алюминия называется
a ) бронза в) мельхиор
б) латунь г) дюралюминий
В самородном состоянии встречается в природе
Не подвержен коррозии
Алюминий входит в состав следующего природного соединения
а) сильвинит в) гипс
б) кальций г) корунд
При растворении алюминия в воде получается раствор
а) алюминия в) гидроксида алюминия
б) оксида алюминия г) гидрида алюминия
В ряду Na – М g – А l – Si
а) увеличивается число энергетических уровней в атомах
б) усиливаются металлические свойства элементов
в) уменьшается высшая степень окисления элементов
г) ослабевают металлические свойства элементов
а) взаимодействие алюминия с хлором
б) взаимодействие алюминия с водой
в) взаимодействие алюминия с кислородом
г) взаимодействие алюминия с серой
Информация о Д/З
Действия: выберите домашнее задание.
1). Если вы выполнили все учебные элементы и тест без ошибок – можете выбрать любое творческое задание.
2). Если в работе встречались трудности, есть исправления – повторите материал 42, с. 125-128, выполните задание №7,8 на с. 130
Творческие задания:
1. Составить электронные презентации о свойствах алюминия, истории открытия, получении, применении, влиянии на организм человека, перспективах применения алюминия и его соединений
3) Осуществите превращения алюминий→оксид алюминия→? →гидроксид алюминия; решите задачу 2. с. 130
Оцените свою работу на уроке:
Материал усвоен недостаточно
за 1 мин убедить, что изучаемая тема просто необходима.
Учитель инициирует рефлексию учащихся по поводу своего психо-эмоционального состояния, мотивации своей деятельности и взаимодействия с учителем и одноклассниками.
Вопрос классу: ваши личные достижения за урок?
Сегодня на уроке я узнал …
Я хотел бы узнать…
Приложение 1
Информационный лист
Биологическая роль Алюминий играет важную биологическую роль в жизни человека. Он принимает участие в построении эпителиальной и соединительной тканях. Содержание алюминия в организме человека (на 70 кг массы тела) составляет 61 мг. Находится во всех органах и тканях: больше всего в печени, легких, костях головном мозге. Основным поступлением алюминия в организм является пища – это хлебопродукты, чай (от 20 – 200мг на 100г. продукта), картофель – 4 мг на 100г. продукта, желтая репа – 46 мг на 100 г. продукта.
При приготовлении и хранении пищи в алюминиевой посуде содержание алюминия в продуктах увеличивается вдвое. Повышение содержания алюминия в крови вызывает возбуждение центральной нервной системы. При избытке алюминия в организме нарушается двигательная активность, судороги, ослабление памяти, заболевание печени и почек. Высокое содержание алюминия обнаружено в клетках головного мозга у людей, страдающих болезнью Альцгеймера (старческое слабоумие). Избыток алюминия накапливается в волосах. Его токсическая доза 5 г.
При понижении содержания алюминия происходит торможение центральной нервной системы.
Области применения алюминия весьма многочисленны. Благодаря легкости и прочности алюминий и его сплавы применяют в самолето- и ракетостроении (алюминий называют крылатым металлом), строительстве судов и автомобилей; в строительстве- для изготовления оконных рам и дверей, легкость и хорошая электрическая проводимость алюминия используется при изготовлении электрических проводов для линии электропередач. Теплопроводность и неядовитость важны при изготовлении алюминиевой посуды и фольги для хранения пищевых продуктов. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии. Способность алюминия гореть в воздухе ярким пламенем, используется при приготовлении красочных фейерверков и изготовление бенгальских огней.
Правила пользования алюминиевой посудой
• В такой посуде нельзя хранить кислую капусту или огурцы в рассоле, кислое молоко, соленую рыбу, блюда из картофеля: длительное воздействие кислот и щелочей разрушает оксидную пленку на алюминии, и металл проникает в пищу.
• Не следует варить в алюминиевой посуде неочищенный картофель, от этого посуда темнеет. При чистке алюминиевой посуды удаляется пленка оксида алюминия, которую нежелательно разрушать. Поэтому лучше пользоваться моющим средством, не содержащим абразивных частиц, например водой с мылом.
• Если на алюминиевой посуде появились пятна от пригоревшей пищи, то для их удаления рекомендуется протереть посуду только что разрезанным яблоком или вскипятить в ней воду с луком.
• Не стоит увлекаться блюдами, запеченными в фольге; не рекомендуется хранить в ней продукты.
Выбранный для просмотра документ Урок по теме Алюминий. docx
Распространенность в природе
По степени распространенности в земле алюминий занимает лидирующую позицию среди всех металлов и третью между элементами периодической таблицы. По исследованиям разных ученых его концентрация в почве колеблется от 7,4 до 8,1%. Молярная масса атома — 26,9815386 г/моль. У вещества высокая химическая активность, поэтому чаще всего оно встречается в виде соединений.
К природным минералам алюминия относятся:
- хризоберилл или александрит;
- бокситы;
- берилл, аквамарин, изумруд;
- нефелины;
- каолинит;
- алуниты;
- полевые шпаты;
- глиноземы — смесь каолинов с песком, магнезитом или известняком.
Но в специфических условиях — жерлах вулканов, например, есть незначительное количество самородного металла белого цвета. Содержат его и природные воды, но вещество приобретает вид малотоксичных соединений. Тип аниона или катиона зависит только от кислотности окружающей среды.
В составе алюминия есть радиоактивные изотопы, которые распадаются за 720 000 лет. Образуются они при расщеплении высокоэнергичными космическими лучами ядер аргона.
Строение атома
Алюминий – это 13 элемент периодической таблицы. Он находится в третьем периоде, III группе, главной подгруппе.
Свойства и применение алюминия связаны с его электронным строением. Атом алюминия имеет положительно заряженное ядро (+13) и 13 отрицательно заряженных электронов, располагающихся на трёх энергетических уровнях. Электронная конфигурация атома – 1s22s22p63s23p1.
На внешнем энергетическом уровне находится три электрона, которые определяют постоянную валентность III. В реакциях с веществами алюминий переходит в возбуждённое состояние и способен отдавать все три электрона, образуя ковалентные связи. Как и другие активные металлы, алюминий является мощным восстановителем.

Рис. 1. Строение атома алюминия.
Алюминий – амфотерный металл, образующий амфотерные оксиды и гидроксиды. В зависимости от условий соединения проявляют кислотные или основные свойства.
Месторождения и методы добычи
Главное сырье для получения алюминия – бокситы. Их залежи сосредоточены в тропиках и субтропиках.
Россия богата нефелиновыми рудами, источник которых – север страны (Кольский полуостров и Кемеровская область).
Мировые запасы сырья исчисляются миллионами тонн.
Добыча ведется открытым либо закрытым способом.
Химические свойства
Алюминий — серебристо-белый легкий металл, технический состав плавится при температуре 658 градусов, чистый — при 660, а закипает он при 2518, 8. К физическим свойствам относится и пластичность. Она у вещества очень высокая: 35% и 50% у промышленного и природного сплава соответственно. Его можно раскатать до состояния фольги или тонкого листа.
Модуль Юнга у алюминия составляет 70 ГПа, коэффициент Пуассона — 0,34. Он отлично отражает свет, проводит тепло и электричество. Вещество может взаимодействовать практически со всеми металлами, образует сплавы с кремнием, магнием, медью.
В нормальных условиях алюминий покрыт прочной тонкой оксидной пленкой, поэтому на него не действуют обычные окислители. Но он реагирует на разбавленные серные растворы.
Металлу не опасна коррозия, благодаря чему он нашел широкое применение в промышленности.
Но если пленка разрушилась — ее могут повредить соли аммония, горячие щелочи или амальгамирование, то вещество превращается в восстановитель. Галий, олово и индий не дают ей образоваться, при этом поверхность металла нужно покрыть легкоплавкими эвтектиками.
Перечень того, с чем реагирует алюминий:
- кислородом;
- галогенами;
- неметаллами;
- водой и ее парами;
- щелочами;
- соляной, азотной и серной кислотами.
При реакции с кислородом образуется оксид алюминия, его формула — 4Al + 3O2 = 2Al2O3. Фторид вещества: 2Al + 3F2 = 2AlF3. Сульфид образуется при взаимодействии с серой: 2Al + 3S = Al2S3, 2Al + N2 = 2AlN — это нитрид металла, 4Al + 3C = Al4C3 — карбид после реакции с углеродом.
Характерная степень окисления алюминия — плюс три, но его атомы могут образовывать дополнительные связи. При взаимодействии со щелочами образуется тетрагидроксоалюминат (или другие алюминаты): 2Al + 2NaOH + 6H2O = 2Na (Al (OH)4) + 3H2. Металл можно растворить в разбавленной серной кислоте: 2Al + 3H2SO4 = Al2 (SO 4)3 + 3H2.
Интересна реакция алюминия с водой. Для нее необходимо удалить защитную пленку с помощью раствора горячей щелочи или амальгамы: 2Al + 6H2O = 2Al (OH3) + 3H2. При взаимодействии с окислителями происходит разложение вещества: 2Al + 6H2SO4 = Al2 (SO4)3 + 3SO2 + 6H2O — растворимые соли, уравнение реакций. Химические свойства алюминия включают восстановление металлов из оксидов, реакцию с парами воды.
Физическое описание
- лёгкостью (плотность 2,7 г/см3);
- серебристо-серым цветом;
- высокой электропроводностью;
- ковкостью;
- пластичностью;
- температурой плавления – 658°C;
- температурой кипения – 2518,8°C.
Из металла делают жестяные ёмкости, фольгу, проволоку, сплавы. Алюминий используют при изготовлении микросхем, зеркал, композитных материалов.

Рис. 2. Жестяные ёмкости.
Алюминий – парамагнетик. Металл притягивается магнитом только в присутствии магнитного поля.
Получение
Алюминий находится на первом месте среди металлов и на третьем среди всех элементов по распространённости в земной коре. Приблизительно 8% массы земной коры составляет именно этот металл. Алюминий содержится в тканях животных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов. Каменная оболочка земли, находящаяся в основе континентов, формируется именно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в результате вулканических процессов в соответствующих условиях высоких температур. При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались разнообразные вторичные породы с более высоким содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий входит в виде гидроокисей или гидросиликатов. Однако не каждая алюминийсодержащая порода может быть сырьём для глинозёма – продукта, из которого при помощи метода электролиза получают алюминий.
Наиболее часто алюминий получают из бокситов. Залежи этого минерала распространены в странах тропического и субтропического пояса. В России также применяются нефелиновые руды, месторождения которых располагаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Затем методом электролиза глинозём превращают в алюминий. Заключительным этапом является восстановление процессом Холла-Эру. Процесс заключается в следующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия. Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под раствором криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превышает температуру плавления самого алюминия (660°С). Глубокую очистку алюминия проводят зонной плавкой или дистилляцией его через субфторид.
Применение алюминия
В настоящее время четвертая часть всего алюминия идет на нужды строительства, столько же потребляет транспортное машиностроение, примерно 17% часть расходуется на упаковочные материалы и консервные банки, 10% – в электротехнике.
Смесь порошка алюминия с оксидами металлов (термит) применяют для получения некоторых металлов и сплавов, для сварки рельсов, в зажигательных боеприпасах.

Широкое применение находят и соединения алюминия. Оксид алюминия – огнеупорный и абразивный (наждак) материал, сырье для получения керамики. Из него также делают лазерные материалы, подшипники для часов, ювелирные камни (искусственные рубины). Прокаленный оксид алюминия – адсорбент для очистки газов и жидкостей и катализатор ряда органических реакций. Безводный хлорид алюминия – катализатор в органическом синтезе (реакция Фриделя – Крафтса), исходное вещество для получения алюминия высокой чистоты. Сульфат алюминия применяют для очистки воды; реагируя с содержащимся в ней гидрокарбонатом кальция:
Al2(SO4)3 + 3Ca(HCO3)2 ® 2AlO(OH) + 3CaSO4 + 6CO2 + 2H2O, он образует хлопья оксида-гидроксида, которые, оседая, захватывают, а также сорбируют на поверхности находящиеся в воде взвешенные примеси и даже микроорганизмы. Кроме того, сульфат алюминия применяют как протраву при крашении тканей, для дубления кожи, консервирования древесины, проклеивания бумаги. Алюминат кальция – компонент вяжущих материалов, в том числе портландцемента. Иттрий-алюминиевый гранат (ИАГ) YAlO3 – лазерный материал. Нитрид алюминия – огнеупорный материал для электропечей. Синтетические цеолиты (они относятся к алюмосиликатам) – адсорбенты в хроматографии и катализаторы. Алюминийорганические соединения (например, триэтилалюминий) – компоненты катализаторов Циглера – Натты, которые используются для синтеза полимеров, в том числе синтетического каучука высокого качества.
Рассмотрим, как используют различные изделия из алюминия
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг — это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.
Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания. Больше всего металла в овсянке, горохе, пшенице, рисе. Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
Отличия алюминиевых сплавов
Сплавы АД1 представляют собой технический алюминий, содержат до 0,7% примесей, среди которых главная роль принадлежит кремнию и железу. Они стойкие к воздействиям химических веществ. Подходят в качестве материалов для резервуаров, прокладок, шайб. АД31 склонен к упрочнению при термической обработке, содержит: Al, Mg, Si. Имеет высокую пластичность, не подвержен ржавчине. Из него получаются сложные по форме полуфабрикаты. Он прост в обработке, хорошо поддается окрашиванию. Из него получают профили, емкости для перевозки азотной кислоты, продуктов питания. Также он является материалом для фляг, консервных банок, пробок бутылок.
В сплаве В95, помимо Al, присутствует цинк, магний и медь. Самый прочный среди всех разновидностей, поэтому востребован в конструкциях с высокой нагрузкой. Из него выпускают плиты, ленты, профили. Под точечной нагрузкой склонен к коррозийному разрушению.
Д16 очень распространен, представляет алюминиевый сплав с медью и магнием. Его можно деформировать в холодном и горячем состоянии. Не предназначен для сваривания. Сплав Д16т – дюралюминий, востребованный в авиа и судостроении. В три раза легче стали, не подвержен микроскопической деформации. Хорошо обрабатывается на токарных станках. Буква Т обозначает, что он искусственно состаренный. В таком состоянии он очень прочный, не подвержен коррозийному влиянию.
Под обозначением АМГ следует понимать алюминиево-магниевые сплавы. Не упрочняются термической обработкой. Незаменимы в технологиях глубокой штамповки. Морозоустойчивы, пластичны. Цифры, следующие за буквенными обозначениями, указывают на количество магния.
Сплав А5 – первичный алюминий, из которого делают проволоку, фольгу, слитки.
АМЦ содержит алюминий и марганец. Пластичный, но малопрочный. Среди достоинств таких сплавов – стойкость к коррозии, способность без труда свариваться контактной, газовой, атомно-водородной сваркой. Склонны к деформации как в холодном, так и в горячем состоянии в пределах 320-470 ° C.
Предостережение
Алюминий не заложен изначально в биологические организмы. Но человек получает его микродозы ежедневно – с пищей.
Однако его переизбыток (откладывается в костях, мозге, печени, почках) чреват тяжелыми расстройствами нервной системы.
По стандартам РФ, в литре питьевой воды не должно быть более 0,2 мг алюминия.
Элемент алюминий — это легкий металл. После кремния и кислорода это наиболее распространенное вещество на планете, а среди металлов он самый популярный. Благодаря своим химическим свойствам алюминий легко поддается литью, плавлению, механической обработке и формовке. Он не притягивается магнитом, проводит тепло и электрический ток, покрывается оксидной пленкой во избежание образования коррозии.
- История открытия
- Распространенность в природе
- Способы получения
- Химические свойства
- Производство алюминия
- Сферы применения
- Роль в биологии

История открытия
Свое название серебристо-белый металл получил от латинского языка, в переводе оно означает квасцы. В 1825 году датский физик Ганс Эрстед нагрел амальгаму калия, восстановил хлорид вещества и выделил новый металл. Затем этот эксперимент повторил и улучшил Фридрих Велер. Он применил чистый металлический калий и первый описал химические особенности алюминия.

Полупромышленный способ выделения открыл Сент-Клер Девиль в 1854 году, но он использовал безопасный натрий. Полученный алюминиевый слиток ученый представил на Парижской выставке. А затем он провел еще один эксперимент — электролиз расплава двойной соли хлорида вещества.
До развития технологий алюминий, созданный электролитическим способом из глинозема, был слишком дорогим. Его слиток стоил больше, чем аналогичный кусок золота. Именно поэтому в 1889 году британские ученые подарили Менделееву аналитические весы. Чаши в них были изготовлены из разных металлов — золота и алюминия. В то время в России последнее вещество называли серебром из глины.
Только в 1886 году отдельно друг от друга химики Эру и Холл разработали промышленный метод добычи металла. Но еще с глубокой древности использовались квасцы — двойная соль калия и алюминия.
Распространенность в природе
По степени распространенности в земле алюминий занимает лидирующую позицию среди всех металлов и третью между элементами периодической таблицы. По исследованиям разных ученых его концентрация в почве колеблется от 7,4 до 8,1%. Молярная масса атома — 26,9815386 г/моль. У вещества высокая химическая активность, поэтому чаще всего оно встречается в виде соединений.
К природным минералам алюминия относятся:

- хризоберилл или александрит;
- бокситы;
- берилл, аквамарин, изумруд;
- нефелины;
- каолинит;
- алуниты;
- полевые шпаты;
- глиноземы — смесь каолинов с песком, магнезитом или известняком.
Но в специфических условиях — жерлах вулканов, например, есть незначительное количество самородного металла белого цвета. Содержат его и природные воды, но вещество приобретает вид малотоксичных соединений. Тип аниона или катиона зависит только от кислотности окружающей среды.
В составе алюминия есть радиоактивные изотопы, которые распадаются за 720 000 лет. Образуются они при расщеплении высокоэнергичными космическими лучами ядер аргона.
Способы получения
У алюминия очень прочная химическая связь с кислородом. Из-за высокой реакционной способности восстановиться металлу из алюмосиликатов и природных оксидов сложнее, чем другим подобным веществам. На это также влияет температура плавления его руд — корунды и бокситы.

Невозможно восстановить элемент путем обжига оксида с углеродом, что помогает при работе с железом. У алюминия слишком близкое взаимодействие с кислородом, у углерода этот показатель гораздо ниже. Получение металла возможно методом неполного восстановления, в ходе которого выделяется промежуточный продукт — карбид алюминия. Затем он разлагается при температуре 1900−2000 градусов, образуя природное вещество.
Этот способ считается более выгодным, чем привычный электролитический, найденный Эру и Холлом. Он требует гораздо меньше энергетических затрат и приводит к минимальному образованию углерода.
Для производства 1 т чернового алюминия необходимо 35 кг его фторида, 65 кг криолита, 600 кг графитовых анодных электродов, 1920 кг глинозема и 61 ГДж электрической энергии. Получить металл в лабораторных условиях можно с помощью метода, найденного Фридрихом Велером. Необходимо восстановить вещество калием его безводного хлорида. Реакция протекает без участия кислорода при нагревании.
Химические свойства
Алюминий — серебристо-белый легкий металл, технический состав плавится при температуре 658 градусов, чистый — при 660, а закипает он при 2518, 8. К физическим свойствам относится и пластичность. Она у вещества очень высокая: 35% и 50% у промышленного и природного сплава соответственно. Его можно раскатать до состояния фольги или тонкого листа.

Модуль Юнга у алюминия составляет 70 ГПа, коэффициент Пуассона — 0,34. Он отлично отражает свет, проводит тепло и электричество. Вещество может взаимодействовать практически со всеми металлами, образует сплавы с кремнием, магнием, медью.
В нормальных условиях алюминий покрыт прочной тонкой оксидной пленкой, поэтому на него не действуют обычные окислители. Но он реагирует на разбавленные серные растворы.
Металлу не опасна коррозия, благодаря чему он нашел широкое применение в промышленности.
Но если пленка разрушилась — ее могут повредить соли аммония, горячие щелочи или амальгамирование, то вещество превращается в восстановитель. Галий, олово и индий не дают ей образоваться, при этом поверхность металла нужно покрыть легкоплавкими эвтектиками.
Перечень того, с чем реагирует алюминий:
- кислородом;
- галогенами;
- неметаллами;
- водой и ее парами;
- щелочами;
- соляной, азотной и серной кислотами.

При реакции с кислородом образуется оксид алюминия, его формула — 4Al + 3O2 = 2Al2O3. Фторид вещества: 2Al + 3F2 = 2AlF3. Сульфид образуется при взаимодействии с серой:2Al + 3S = Al2S3, 2Al + N2 = 2AlN — это нитрид металла, 4Al + 3C = Al4C3 — карбид после реакции с углеродом.
Характерная степень окисления алюминия — плюс три, но его атомы могут образовывать дополнительные связи. При взаимодействии со щелочами образуется тетрагидроксоалюминат (или другие алюминаты): 2Al + 2NaOH + 6H2O = 2Na (Al (OH)4) + 3H2. Металл можно растворить в разбавленной серной кислоте: 2Al + 3H2SO4 = Al2 (SO 4)3 + 3H2.
Интересна реакция алюминия с водой. Для нее необходимо удалить защитную пленку с помощью раствора горячей щелочи или амальгамы: 2Al + 6H2O = 2Al (OH3) + 3H2. При взаимодействии с окислителями происходит разложение вещества: 2Al + 6H2SO4 = Al2 (SO4)3 + 3SO2 + 6H2O — растворимые соли, уравнение реакций. Химические свойства алюминия включают восстановление металлов из оксидов, реакцию с парами воды.
Производство алюминия
До начала позапрошлого века не было достоверной информации о производстве металла. Первые несколько миллиграммов получил Ганс Эрстед в 1825. Через два года Фридрих Велер выделил крупинки, но они моментально покрывались пленкой на воздухе.

До конца XIX столетия вещество не производили в промышленных масштабах. И только в 1854 при финансировании Наполеона III, который надеялся об усилении армии с помощью металла, Сент-Клер Девиль вытеснил алюминий натрием из двойного хлорида натрия. Через год он получил первый слиток массой 6 кг, а до 1890 ученый смог создать более 200 т вещества.
В 1885 году построили первый завод в Гмелингеме, Германия. Технологию для производства разработал Николай Бекетов. Его метод мало отличался от способа Сент-Клер Девиля, но основывался на взаимодействии магния и криолита. За пять лет работы завод создал более 58 т металла, что составило четверть мирового производства.
Эру и Холл практически одновременно изобрели еще один метод — электролиз глинозема. Его растворяли в расплавленном криолите. Он и стал основой современного создания алюминия. В России первый завод появился в 1932 году, тогда промышленность СССР порадовала 47,7 млн т металла. Стимулировала производство Вторая мировая война.
А к 2016 в мире сделали около 59 млн т, лидерами стали:
Сферы применения
Благодаря основным свойствам алюминия — стойкости к коррозии, легкости, плавкости, теплопроводности и нетоксичности соединений — его применяют как конструкционное вещество.
А также металл используется во многих сферах человеческой деятельности:

- черная металлургия;
- создание сплавов;
- ювелирное дело;
- стекловарение;
- пищевая и военная промышленность;
- ракетная техника.
В черной металлургии алюминий необходим для создания стали. Он избавляет ее от пористости, делает более плотной. Сплавы металла широко применяют в разной промышленности. Наиболее востребованы соединения с магнием, марганцем, медью, кремнием. Когда алюминий был дорогим, из него делали ювелирные украшения. Обычно это были пуговицы, чаши для весов. Но когда изменились способы его изготовления, использование в этой сфере сразу прекратилось. Хотя сейчас из него делают бижутерию, а в Японии заменяют серебро.
Наполеон Третий приказывал изготавливать себе столовые приборы из белого металла. Их использовал только он и почетные гости, хотя другие предпочитали золото и серебро. Сейчас подобные изделия можно увидеть в столовых, а также в армии — из алюминия делают котелки, ложки и фляжки.
Он выступает в качестве основы обезболивающих и обволакивающих средств. Используют металл и в военном деле: его легкость полезна при создании ручного стрелкового оружия. Соединения вещества — суспензии и порошки — применяют при строительстве ракетной техники.
Роль в биологии
Хотя алюминий распространен в природе, ни один живой организм не использует его в метаболизме. Из-за этого металл называют мертвым, только химия способна превратить его в полезные вещества. У него слабое токсичное действие, но некоторые неорганические соединения сохраняются в растворах, поэтому могут оказывать негативный эффект на организм человека и теплокровных животных.

Самыми опасными считаются сульфаты, хлориды, ацетаты и нитраты. Сначала они действуют на центральную нервную систему, приводят к серьезным расстройствам здоровья. По 15 мг металла может каждый день выходить с мочой, но для людей с нарушенной работой почек даже малейшая доза может оказаться смертельно опасной. Вещество способно накапливаться в тканях головного мозга, костей, печени.
Согласно некоторым медицинским характеристикам, алюминий вызывает болезнь Альцгеймера, рак молочных желез. Но не все исследования подтверждены официально.
Ведь в организм человека молекулы металла попадают с питьевой водой практически каждый день.
Читайте также:
- Что должны обеспечить средства индивидуальной защиты от падения с высоты
- Как изменится уровень циклической безработицы на каждой фазе экономического цикла
- Ул красного текстильщика д 10 загранпаспорт как добраться
- Как проверить права гимс на подлинность по базе
- Кто вел активную борьбу с коррупцией чиновников



