Как бензол так и его гомологи можно получить осуществляет некоторые
Обновлено: 02.07.2024


1 слайд
Бензол и его гомологи

2 слайд
История открытия бензола Иоганн Глаубер впервые описал (1649 год) сырой бензол, полученный разгонкой каменноугольной смолы.

4 слайд
Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения

5 слайд

6 слайд
Если рассмотреть строение молекулы более детально, с точки зрения электронной плотности, то картина будет примерно следующая – образуется общее П-электронное облако и оно распространено по всей молекуле

7 слайд
Атомы углерода в молекуле бензола находятся во втором валентном состоянии (sp2). Каждый атом углерода образует -связи с двумя другими атомами углерода и одним атомом водорода, лежащими в одной плоскости. Валентные углы между тремя -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник

8 слайд
Гомологи бензола рассматриваются как продукты замещения одного или нескольких атомов водорода в молекуле бензола на различные углеводородные радикалы

9 слайд
Время для самоконтроля № вопроса Ответ 1 А 2 Б 3 Г 4 А 5 Б 6 А 7 А 8 А

10 слайд
Выбранный для просмотра документ Урок-конспект.docx
Пояснительная записка
Методическая разработка содержит: пояснительную записку, технологическую карту занятия, конспект учебного занятия и приложение.
Методическая разработка предназначена для преподавателей средне-профессиональных учебных заведений, и рекомендована к использованию в учебном процессе.
Технологическая карта урока 37
по дисциплине __ Органическая химия___
Бензол и его гомологи
Изучить состав, строение, свойства аренов на примере бензола и его гомологов.
Задачи урока
-Сформировать знания учащихся об ароматических углеводородах, их получении, свойствах и применении.
-Продолжить формирование умений работать с учебником, тетрадью
Развивающие
-Совершенствовать умение учащихся прогнозировать свойства вещества на основе его строения
-Научить учащихся обобщать и делать выводы
-Развивать умение сравнивать (сравнение свойств гомологов бензола).
Воспитательные
-Продолжить формирование диалектико-материалистического мировоззрения на основе представлений о применении ароматических углеводородов.
-Расширить представление учащихся о влиянии аренов на окружающую среду и здоровье человека
Формируемые компетенции (или их элементы)
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
Показатель формируемой компетенции
ОК.2: выбирает и применяет методы и способы решения профессиональных задач.
ОК.4: использует необходимые реактивы и оборудование для выполнения химического анализа .
Средства обучения, оборудование
рабочая тетрадь,и нструкционная карта , дидактические материалы, презентация MicrosoftPowerPoint, проектор, экран .
Вид учебного занятия
Применяемые технологии
Технология проблемного изучения ,информационно-коммуникационные технологии.
- проверка готовности студентов к занятию;
-создание психологического настроя на учебную деятельность;
ЭТАП 2 (длительность)
Мотивация. Целевая установка.(5 мин)
Формируют цель и задачи урока
1. Вовлечение студентов в процесс постановки целей и задач занятия.
2. Обоснование необходимости изучения данной темы для эффективного освоения дисциплины.
ЭТАП 3 (длительность)
Актуализация опорных знаний (10 мин)
Ответы на заданные вопросы
Фронтальный опрос студентов на тему строение органических веществ.
ЭТАП 4 (длительность)
Решение проблемной ситуации: либо теория строения органических веществ ошибочна, и валентность углерода не равна IV, либо существуют химические связи, не являющиеся одинарными, двойными
Преподаватель на слайдах демонстрирует новый материал.
Выяснить понимание основных вопросов темы, связанных со строением вещества, пробудить интерес к ее восприятию.
ЭТАП 5 (длительность)
Закрепление изученного материала (14 мин)
Выполнение тренировочного теста по теме
Проверяет закрепление изученного материала:
Дает указания по самопроверке тестов, оцениванию результатов.
ЭТАП 6 (длительность)
Поведение итогов (3 мин.)
Деятельность студента и преподавателя
Преподаватель вместе с обучающимися подводит итог занятия, уровня достижения цели и решения проблемного вопроса, оценивает работу студентов на занятии.
ЭТАП 7 (длительность)
Домашнее задание (1 мин)
Содержание домашнего задания
ЭТАП 8 (длительность)
Рефлексия (5 мин)
Ответы на вопросы анкеты
Дать анкету, которая позволяет осуществить самоанализ
Преподаватель М . Ф. Козлова
План– конспект учебного занятия № 37
Вид учебного занятия: комбинированное занятие
Цель занятия: Изучить состав, строение, свойства аренов на примере бензола и его гомологов.
Формируемые компетенции (или их элементы):
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их эффективность и качество.
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
Показатель формируемой компетенции:
ОК.2: выбирает и применяет методы и способы решения профессиональных задач.
ОК.4: использует необходимые реактивы и оборудование для выполнения химического анализа .
Средства обучения: рабочая тетрадь, и нструкционная карта , дидактические материалы, презентация MicrosoftPowerPoint, проектор, экран.
Используемые педагогические технологии: технологии проблемного обучения, информационно-коммуникационные технологии.
Межпредметные связи: Общая химия
Организационный момент
- проверка готовности студентов к занятию;
- создание психологического настроя на учебную деятельность;
Мотивация. Целевая установка
Сегодня на уроке мы с Вами будем говорить о бензоле и его гомологах. Бензол был открыт еще в 1649 г. Иоганном Глаубером. Однако, тогда еще ничего не было известно о его составе. Во второй раз бензол был "открыт" Майклом Фарадеем. Он выделил его из светильного газа в 1825 году и тогда же был установлен его состав - С 6 Н 6. Позже было выделено большое количество соединений содержащих бензольный цикл и большинство из них имели приятный запах, поэтому в 1860 г. А.Кекуле предложил для них название "ароматические углеводороды". Это название сохранилось до сих пор, а по систематической номенклатуре этот класс углеводородов называется арены.
- А как бы вы сформулировали цель занятия?
(Студенты формулируют цель занятия.)
Ш. Актуализация опорных знаний
Проверка усвоения знаний предыдущего материала.
В ходе урока мы должны решить проблемную ситуацию: либо теория строения органических веществ ошибочна, и валентность углерода не равна IV, либо существуют химические связи, не являющиеся одинарными, двойными. Вспомним основы строения органических веществ:
- обучающимся задаются вопросы на заданную тему
- преподаватель предлагает вопросы на тему для повторения
Бензол – первый представитель класса аренов – ароматических углеводородов.

Почему рисуют кружок в шестиугольнике? Это означает то, что все связи в молекуле одинаковые. Дело в том, что если рисовать бензол по валентностям углерода (у каждого атома должно быть 4 связи), то надо было бы нарисовать с двойными связями. Но, каждая связь – это не просто черточки на бумаге. Каждая связь имеет определенные физические характеристики. Например, длина связи. Двойная связь короче одинарной. При исследовании молекулы бензола оказалось, что все связи одинаковы (т.е. нет разделения на двойные и одинарные) и эти связи представляют собой промежуточный вариант между двойной и одинарной (длина связи составляет 0,140 нм). Поэтому рисуют кружок – обозначение одинаковых связей по все молекуле.
Если рассмотреть строение молекулы более детально, с точки зрения электронной плотности, то картина будет примерно следующая – образуется общее П-электронное облако и оно распространено по всей молекуле. Атомы углерода в молекуле бензола находятся во втором валентном состоянии (sp 2 ). Каждый атом углерода образует -связи с двумя другими атомами углерода и одним атомом водорода, лежащими в одной плоскости. Валентные углы между тремя -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник

Общая формула аренов:
Гомологи бензола рассматриваются как продукты замещения одного или нескольких атомов водорода в молекуле бензола на различные углеводородные радикалы:

V . Закрепление изученного материала
Выполнение тренировочного теста по пройденному материалу (приложение 1)
Сегодня на уроке мы изучили бензол, особенности его строения и понятие гомологов бензола.
VI . Подведение итогов (3 мин.)
Преподаватель вместе с обучающимися подводит итог занятия, обращает внимание на цель, была ли она достигнута?
Затем собираются листы самооценки, преподаватель в целом оценивает работу студентов на занятии и выставляет оценки в журнал.
VII . Домашнее задание (1 мин.)
VIII . Рефлексия (5 мин.)
в конце занятия преподаватель задает вопросы студентам, которые в свою очередь с помощью карточек, отражающие спектр эмоций и настроение, отвечают на заданные вопросы.
1.На уроке я работал
2.Своей работой на уроке я
3.Урок для меня показался
4.За урок я
5.Мое настроение
6.Материал урока мне был
7.Домашнее задание мне кажется
активно / пассивно
доволен / не доволен
коротким / длинным
не устал / устал
стало лучше / стало хуже
понятен / не понятен
полезен / бесполезен
интересен / скучен

Учи.Дома запускает бесплатный марафон в котором каждый день. В течении 5 дней утром ты будешь получать одно задание по выбранному предмету, а вечером его решение. Твоя задача, успеть выполнение задание до того как получишь ответ.
Бесплатно, онлайн, подготовка к ЕГЭ
Предварительный просмотр:
- Изобразите электронное строение молекулы бензола. Объясните механизм образования сигма- связи и 6 пи- электронной системы.
- Опишите свойства бензола, сходные с предельными углеводородами. Почему бензол легче вступает в реакции замещения?
- Опишите свойства бензола, сходные с непредельными углеводородами. Почему бензол труднее вступает в реакции присоединения?
- Осуществите цепочку превращений:
гексан- бензол- нитробензол.
- Представьте себя директором химического завода. Перед вами поставили задачу наладить производство хлорбензола. Какое сырьё вы для этого предложите? Запишите цепочку химических превращений, необходимых для получения хлорбензола. Подтвердите её уравнениями реакций. Каковы условия протекания реакций?
2. Приведите примеры уравнений реакций, доказывающие отличительные свойства бензола и толуола. В чём причина этих различий? Дайте объяснение на основе электронного строения, запишите уравнения реакций.
Дифференцированное задание: Составьте формулы химических соединений
2 этил, 4 пропилбензол;
1. Как бензол, так и толуол реагируют с
1) раствором KMnO4 (H2SO4 конц) 2) бромной водой
3) азотной кислотой (H2SO4 конц) 4) соляной кислотой
2. Толуол в одну стадию нельзя получить из
1) бензола 2) гептана 3) фенола 4) метилциклогексана
3. БЕНЗОЛ МОЖНО ПОЛУЧИТЬ ТРИМЕРИЗАЦИЕЙ
1) этилена 3) этина 2) этана 4) циклопропана
4. Как для бензола, так и для стирола характерны
1) наличие в молекуле сопряженной электронной системы
2) sp3-гибридизация атомов углерода
3) взаимодействие с водородом в присутствии катализатора
4) обесцвечивание бромной воды 5) горючесть
6) хорошая растворимость в воде
5. И толуол, и бензол реагируют с
1) бромом 2) хлорметаном 3) бромной водой 4) бромоводородом
5) азотной кислотой 6) гидроксидом меди(II)
6. Раствор перманганата калия обесцвечивают
1) пентан 2) бензол 3) бутин-1 4) толуол 5) пентен-2 6) полиэтилен
7. Бромную воду обесцвечивают
1) пентан 2) бензол 3) бутин-1 4) толуол 5) бутен-2 6) бутадиен-1,3
8. И для толуола, и для бутадиена-1,3 характерны
1) наличие в молекуле сопряжённой электронной системы
2) sp2-гибридизация всех атомов углерода 3) реакции замещения
4) обесцвечивание раствора КМnO4 5) горючесть 6) хорошая растворимость в воде
9. Толуол вступает в реакцию с
1) аммиаком 2) хлороводородом 3) хлором при освещении
4) аммиачным раствором оксида серебра 5) хлором в присутствии катализатора AICI 3
6) хлорэтаном в присутствии катализатора AICI 3
1.Химические св-ва бензола определяют его отношение к:
а)бифункциональным соединениям б)полимерам
в)непредельным углеводородам г)алкинам
2.С каким из предложенных веществ бензол не будет взаимоднйствовать:
а)с металлическим кальцием б)с кислородом
в)с водородом г). Газообразным хлором
3.Непредельность молекулы бензола нельзя определить по реакциям с:
А)с раствором перманганата калия б)с бромной водой
в)гидрированием г)с хлорной водой
4.Сколько литров кислорода потребуется для полного сгорания 1 моль бензола:
а)168л б)169л в)170л г)171л
1. Общая формула ароматических углеводородов, гомологов бензола:
А) СnH 2 n б)CnH 2 n +2 в) CnH 2n-6 г)CnH 2n-2
2. Определите вещество Х в схеме: С 2 Н 2 – Х – С 6 Н 6 Сl 6
А) С 6 Сl 6 б) С 2 Н 4 Сl 2 в) С 2 Н 2 Сl 4 г)С 6 Н 6
3. Определите вещество Х в схеме: С 2 Н 2 – Х – С 6 Н 5 Сl
А) С 2 Н 4 Сl 2 б) С2Н3Сl в) С6Н6 г) С4Н4Сl4
4. Определите вещество Х в схеме: С2Н2 – Х – С6Н5NO2
а) С2Н5 NO2 б) С6Н6 в) С2Н3 NO2 г)С3Н7 NO2
5. Определите вещество Х в схеме: С2Н2 – Х – С6Н5Br
а) С6Н6 б) С2Н3 Br в) С2Н4 Br г)С4Н4 Br 4
1.К классу аренов относится углеводород, формула которого
а) С 3 Н 6 б) С 2 Н 2 в) С 6 Н 6 г) С 5 Н 8
2.Кратные связи отсутствуют в молекуле углеводорода
а) циклопропана б) бутадиена-1,3 в) пропина г) бензола
3. Ароматическое кольцо содержится в молекуле
а) гексана б) циклогексана в) гексена г) 1,4-диметилбензола.
4. Атомы углерода в молекуле бензола находятся в состоянии гибридизации
а)sp - б) sp 3 - в) sp 2 - г) sp 4 .
5. Слабые кислотные свойства проявляют
а) алкены б) алкины в) алкадиены г) арены.
6. Реакция присоединения водорода к непредельным углеводородам называется
а) гидрирование б) галогенирование в) гидратация г) гидрогалогенирование.
I.1. Запишите уравнения реакций, при помощи которых можно осуществить превращения. Укажите условия протекания реакций. Назовите все органические вещества.
С 2 Н 2 С 6 Н 6 С 6 Н 12 С 6 Н 14
2.При нитровании 39 г бензола получили 59 г нитробензола. Какова массовая доля выхода нитробензола от теоретически возможного?
II.1. Запишите уравнения реакций, при помощи которых можно осуществить превращения. Укажите условия протекания реакций. Назовите все органические вещества.
С 2 Н 6 С 2 Н 4 С 2 Н 2 С 6 Н 6 С 6 Н 6 Cl 6
2.При сжигании 7,8 г арена получено 7,8 г углекислого газа. Относительная плотность паров углеводорода по воздуху 2,69.Выведите молекулярную формулу арена.
III.1. Осуществите цепочку превращений:
циклогексан – бензол – нитробензол
Укажите тип химических реакций, условия их проведения.
2.Из 7,8г бензола получено 8,61г нитробензола. Выход продукта реакции составил:
а) 70% б) 65% в) 80% г) 78%.
1. Общая формула аренов:
А. СnН2n+2 Б.CnH2n В.CnH2n-2 Г.CnH2n-6
2.Для бензола характерны реакции:
а) замещения б) присоединения в) полимеризации
3. Допишите уравнение реакции и определите её тип: С6Н5---СН3 + Br2
а) обмен б) присоединение в) полимеризация г) замещение
4.Бензол можно получить:
а) полимеризацией гексадиена –1,4 б) хлорированием метана
в) тримеризацией ацетилена г) полимеризацией этилена (этена)
1. Ароматический углеводород с 12 атомами водорода будет иметь формулу:
1) С 12 Н 18 ; 2)С 12 Н 20 3) С 8 Н 12 4) С 9 Н 12
2. Ароматический углеводород, имеющий 10 атомов углерода, имеет в своём составе:
1) 10 атомов Н; 2) 12 атомов Н;3) 14 атомов Н; 4) 20 атомов Н.
3..Органическое вещество, молекулярная формула которого С 7 Н 8 , относится к гомологическому ряду: 1)метана 2)этилена 3)бензола 4)ацетилена
4. Так же как и бензол, принадлежат к ароматическим углеводородам
А) фенол Б) толуол В) этилбензол Г) кумол Д) гексанол Е) циклогексанол
5.Гомологом бензола не является 1)толуол 2)кумол 3)стирол 4)этилбензол
6. Гомологом бензола является 1) ацетилен 2) толуол 3) хлорбензол 4) циклогексан
7. Толуол и бензол - это
1) гомологи 2) структурные изомеры 3) геометрические изомеры 4) одно и тоже вещество
8. Число σ - и π -связей в молекуле толуола соответственно равно
1) 15 и 6 2) 12 и 1 3) 7 и 3 4) 15 и 3
9. Тип гибридизации атомов углерода в молекуле этилбензола:
а) все sp 3 -гибридные атомы ; б) только sp 2 -гибридные;
в) 2 атома – sp 3 , 6 атомов – sp 2 ; г) 2 –sp, 6 – sp 2 –гибридные
10 . Тип гибридизации атомов углерода в молекуле 1,3 –диметилбензола:
а) все sp 3 -гибридные атомы ; б) только sp 2 -гибридные;
в) 2 атома – sp 3 , 6 атомов – sp 2 ; г) 2 –sp, 6 – sp 2 –гибридные.
11 . Тип гибридизации атомов углерода в молекуле 1-этил-3 –метилбензола:
а) все sp3-гибридные атомы ; б) только sp2-гибридные;
в) 3 атома – sp3, 6 атомов – sp2; г) 3 –sp, 6 – sp2 –гибридные.
1. Веществом Х в цепочке превращений: метан-Х- бензол является:
а) этан; б) ацетилен; в) хлорметан; г) этилен.
2. Углеводород состава С6Н6 относится к классу:
а) алканов; б) алкенов; в) алкинов; г) аренов.
3. Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме: карбид кальция – ацетилен – бензол.
1.Общая формула аренов:
А) СnH2n+2; б) СnH2n; в) СnH2n-2; г) СnH2n-6.
2. Свойство, характерное для бензола:
а) хорошая растворимость в воде; б) тяжелее воды; в) не имеет запаха; г) не обесцвечивает бромную воду.
3.Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме: ацетилен – бензол – нитробензол.
- Напишите возможные структурные формулы, соответствующие углеводороду С 6 Н 6 , и объясните, как можно обосновать истинную формулу бензола.
- Отличаются ли углеродные связи в бензоле от простых и двойных связей?
- Сколько сигма-связей образует каждый атом углерода в молекуле бензола? Сколько всего сигма-связей имеется в ней?
- Каков валентный угол в молекуле бензола?
- В чем сходство и различие в строении бензола и графита? Ответ обоснуйте.
- Напишите уравнения реакций получения из бензола цклогексана, хлорбензола, гексахлорбензола. Укажите условия протекания реакций.
- Напишите уравнения реакций этана, этилена, ацетилена и бензола с бромом и объясните, в чем заключается сходство и различие между ними.
- В чем сходство и различие реакций гидрогенизации этилена, ацетилена, бензола?
- Какие реакции лежат в основе процесса ароматизации нефти? Ответ подтвердите примерами.
- Массовая доля элементов углеводорода (плотность паров по водороду равна 39) составляет 92,31% углерода, 7,69% водорода. Найдите его молекулярную формулу.
- Какая масса бензола потребуется для получения 738 г нитробензола, если его практический выход составляет 92% от теоретического?
- Практический выход при тримеризации ацетилена составляет 28% от теоретического. Какую массу ацетилена следует взять для получения бензола: а) 1 кг; б) 1 моль?
- при сжигании 2,5 мл вещества выделилось 8,46 мг оксида углерода (IV) и 1,73 мг воды. Объем 1 л вещества имеет массу 3,5 г. Определите молекулярную и возможную структурную формулу вещества.
- Какие из приведенных формул гомологов бензола (толуол, этилбензол) могут существовать в виде изомеров? Напишите их формулы.
- Является ли стирол, формула которого С 6 Н 5 —СН==СН 2 , ароматическим углеводородом?
- Будет ли стирол гомологом бензола?
- Из какого углеводорода удобнее всего получать стирол?
- Как изменяется строение веществ в следующем превращении:
Этан → этилен → ацетилен → бензол?
Изобразите структурные формулы указанных веществ и отметьте для каждого из них: а) тип гибридизации; б) валентные углы; в) схему σ-связей; г) схему π-связей; д) схему π-электронной системы.
- Рассмотрите, в чем сходство и различие между предельными (например, этан), непредельными (например, этилен) и ароматическими углеводородами (например, бензол). Ответ подтвердите уравнениями реакций.
По теме: методические разработки, презентации и конспекты

Учебник – неизменная основа для различных вариантов урока
Чтение является одним из важнейших видов коммуникативно-познавательной деятельности учащихся. Эта деятельность направлена на извлечение информации из письменно фиксированного текста. Чтение вы.

Различные варианты Конституции Муравьева
для работы на уроке истории в 10 классе по теме "Внутренняя политика России в первой половине XIX века".

Учебник — неизменная основа для различных вариантов урока
Учебник — неизменная основа для различных вариантов урока.

Различные варианты работы с историческими источниками.
Примеры заданий с использованием исторических документов.

Учебник — неизменная основа для различных вариантов урока
Учебник — неизменная основа для различных вариантов урока.
УЧЕБНИК – НЕИЗМЕННАЯ ОСНОВА ДЛЯ РАЗЛИЧНЫХ ВАРИАНТОВ УРОКА
Задачи:- Использовать различные формы и приемы работы с учебником при обучении чтению, говорению, письму, решению примеров, задач, упражнений.- Используя материал учебника, научить учащихся рабо.

На уроке рассматривается такое свойство различных типов циклов, как их взаимозаменяемость при решении задач. Рассмотрено решение задачи с использованием всех трёх типов циклов, а также с учётом их осо.
Первым представителем ряда простейших ароматических углеводородов – аренов – является бензол. Все ароматические соединения – как гомологи бензола, так и арены более сложного строения – представляют собой его производные. Отличительный признак аренов – наличие в структуре молекулы бензольного кольца.
Строение ароматической связи

Углеродный скелет бензольного кольца имеет форму шестиугольника, в плоскости которого лежат оси соединяющих атомы -связей. Все эти связи одинаковы, угол между ними равен 120°. Поэтому негибридные p-облака, ориентированные перпендикулярно плоскости цикла, также равнозначны.
Результатом их перекрывания становится обобществление всех p-электронов в единое -электронное облако с делокализованной плотностью. Сочетание прочных -связей и -облака – ароматическая связь – образует стабильную структуру, называемую бензольным ядром.

При записи ядро условно обозначается шестиугольным циклом либо с тремя чередующимися двойными связями, либо с вписанной делокализационной окружностью, которая подчеркивает особый характер ароматической связи.

Гомологический ряд бензола
Молекула бензола состоит только из ароматического ядра. Остальные представители гомологического ряда имеют в составе молекулы алкильные радикалы, присоединенные к ядру, и называются алкилбензолами.
Состав гомологов бензола определяется общей формулой . Гомологическая разность выражается через звено углеводородной цепочки радикала.
Ряд бензола включает только арены с насыщенными радикалами и одним бензольным ядром. К числу ароматических углеводородов относятся соединения с непредельными радикалами, а также с несколькими бензольными кольцами, например:

Эти углеводороды не являются гомологами бензола, они входят в состав других рядов класса аренов.
Строение углеводородов бензольного ряда представлено в таблице:


Арильные (содержащие бензольное ядро) радикалы носят следующие названия:

Каждый гомолог бензола может быть представлен как предельный углеводород с ароматическим радикалом:
Номенклатура и изомерия алкилбензолов

Всем соединениям гомологического ряда свойственна структурная изомерия, обусловленная наличием одной или нескольких боковых цепей. Не имеют изомеров только бензол и его ближайший гомолог – толуол, обладающий единственным простейшим метильным радикалом .
Строение углеродного скелета

В зависимости от количества, состава и строения алкильных заместителей для соединений состава характерно широкое разнообразие. Число изомерных форм быстро растет с увеличением n.



При наименовании алкилбензолов соблюдаются следующие правила:



Позиции одинаковых заместителей
В полизамещенных алкилбензолах с радикалами одного типа возникает изомерия, связанная с их взаимным положением. Для позиционных изомеров в ряду бензола существуют специальные обозначения:


Физические свойства некоторых алкилбензолов
Бензол и углеводороды его ряда – бесцветные жидкости со специфическим запахом, не смешивающиеся с водой и нерастворимые в ней. Высшие гомологи представляют собой твердые вещества. Термические характеристики соединений бензольного ряда зависят от изомерии и длины боковых алкильных цепей.
Основные физические свойства бензола и наиболее близких его гомологов приведены в таблице.
Химические свойства алкилбензолов
Несмотря на то, что по составу бензол и другие представители гомологического ряда являются ненасыщенными соединениями, они склонны к типичным для алканов реакциям замещения, а ароматическое ядро чрезвычайно устойчиво. Тем не менее, алкилбензолы способны и к процессам присоединения, хотя реакции данного типа значительно затруднены по сравнению с непредельными углеводородами.
Различные заместители оказывают влияние на стабильность и реакционную способность бензольного ядра; оно, в свою очередь, воздействует на свойства радикалов. Поэтому изомерия играет важную роль в химических взаимодействиях алкилбензолов.
Замещение
Поскольку ароматическая система насыщена электронной плотностью, бензол и гомологи охотно реагируют с электрофильными соединениями по донорно-акцепторному механизму. Для бензольного кольца типичны процессы ионного замещения.
В отсутствие катализатора алкилбензолы не взаимодействуют с галогенами и их растворами (хлорной или бромной водой). На никелевом, железном или алюминиевом катализаторе, способствующем активации галогена, замещение идет по преимуществу в бензольном ядре:

В молекулах гомологов галогены замещают водород главным образом в орто-и пара-позициях к углеводородному радикалу:

Замещение может происходить и в боковой цепи. Для этого требуется воздействие яркого света либо нагревание до 300°C:

При этом галоген атакует ближайший к кольцу углеродный атом.
Для реакции необходима нитрующая смесь концентрированных азотной и серной кислот:


Замещение водорода алкильными радикалами является одним из методов получения гомологов бензола. Оно проводится несколькими путями:

Если неразветвленный галогеналкан содержит более двух углеродных атомов, происходит изомеризация продукта алкилирования:



Водород может замещаться ацильным остатком галогенангидрида или ангидрида карбоновой кислоты:
Присоединение
В специальных условиях алкилбензолы способны к реакциям присоединения с разрушением ароматической связи.

Из всех соединений гомологического ряда хлор присоединяется только к бензолу:

При воздействии галогена на любой из гомологов бензола происходит не присоединение, а замещение в алкильном радикале.
Окисление
Бензол стоек к воздействию окислителей, таких как перманганат калия, даже в присутствии кислот и щелочей. Но его гомологи в жестких условиях подвергаются окислению.
При повышенной температуре в нейтральной среде алкилбензолы окисляются до калиевой соли бензойной кислоты:


В кислой среде происходит образование бензойной кислоты:

Гомологи с длинной боковой цепью образуют две кислоты, так как при отрыве цепи от углеродного атома, соединенного с бензольным циклом, образуется остаток, содержащий более одного атома:

Если в реакции участвует полизамещенный алкилбензол, продуктом его окисления становится многоосновная ароматическая кислота:

Углеводороды ряда бензола горят с интенсивным выделением теплоты. Продукты горения зависят от количества вступающего в реакцию кислорода:


Взаимодействие радикалов с бензольным ядром
Заместители в зависимости от своей электрической природы по-разному влияют на распределение электронной плотности в ароматической системе. Соответственно изменяется и реакционная активность бензольного ядра в процессах замещения.
Заключение
Особенности электронного строения алкилбензолов не только оказывают влияние на их структуру и обусловливают многообразие изомерных форм. Они также непосредственно воздействуют на реакционную активность, определяя направление химических процессов с участием бензола и его гомологов. Это свойство алкилбензолов делает их ценным химическим продуктом, благодаря чему они находят широкое применение в промышленности и науке.
Как вы уже знаете, в молекуле бензола имеется устойчивая сопряжённая система π-связей. Поэтому для бензола характерны реакции замещения, так как в этих реакциях сопряжённая система сохраняется. Наоборот, реакции присоединения для бензола малохарактерны. Так, бензол не обесцвечивает бромную воду, но в присутствии катализатора он вступает с бромом в реакцию замещения.
1. Галогенирование
Для осуществления этой реакции бензол смешивают с бромом в колбе и добавляют катализатор FeBr3. При этом протекает реакция замещения одного атома водорода на бром:
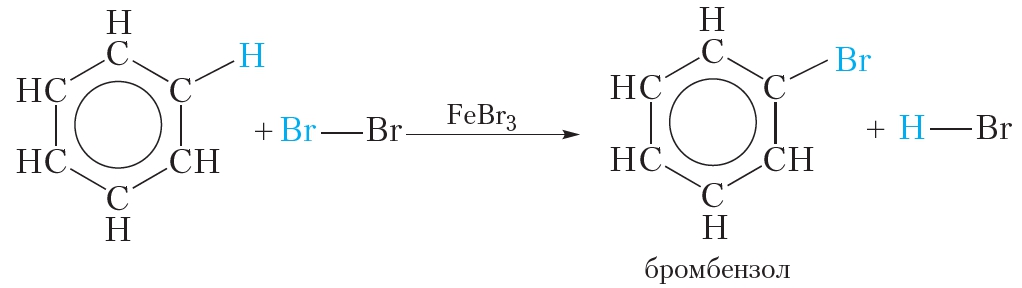
О протекании реакции можно судить по выделению бромоводорода, изменяющего цвет влажной индикаторной бумажки, помещённой в верхнюю часть колбы. Продукт бромирования бензола называется бромбензол.
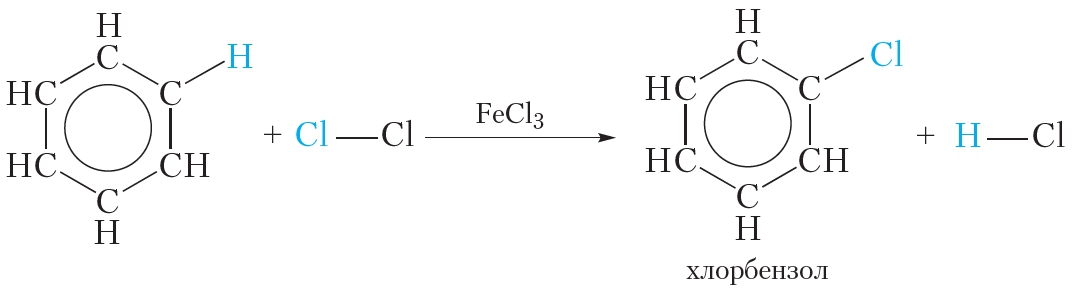
Как видно, в этой реакции единая система π-электронов сохраняется. Подобным образом проводят и хлорирование бензола:
2. Нитрование
Так называются реакции, в результате которых в молекулу органического соединения вводится группа — NO2, называемая нитрогруппой.
Если к смеси концентрированных азотной и серной кислот прибавить бензол, происходит реакция нитрования бензола, в результате которой образуется тяжёлая желтоватая жидкость с запахом горького миндаля — нитробензол:
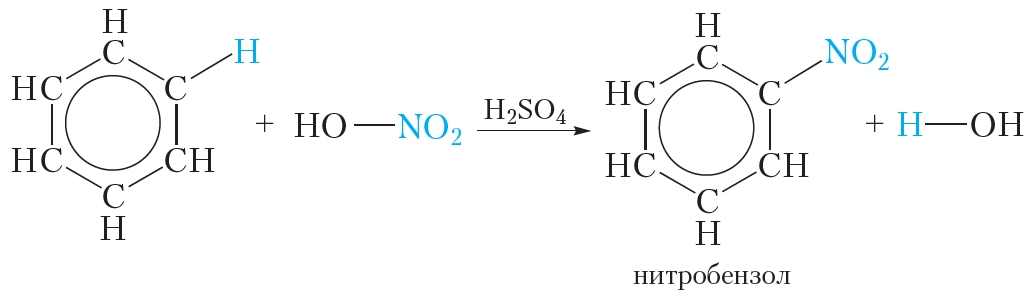

Данная реакция так же, как и галогенирование, относится к реакциям замещения — один атом водорода в молекуле бензола замещается на группу — NO2.
Смесь концентрированных азотной и серной кислот называется нитрующей смесью. В нитрующей смеси азотная кислота выполняет роль нитрующего реагента, а серная кислота является катализатором.
С нитрованием гомолога бензола — толуола, продуктом которого является взрывчатое вещество, вы можете познакомиться, перейдя по ссылке в QR-коде.
3. Гидрирование
В жёстких условиях бензол может вступать в реакции присоединения. Примером реакции присоединения с участием бензола является его гидрирование, которое протекает при температуре около 200 °С под давлением в присутствии катализаторов гидрирования (никель или платина). При этом одна молекула бензола присоединяет сразу три молекулы водорода и превращается в циклогексан:
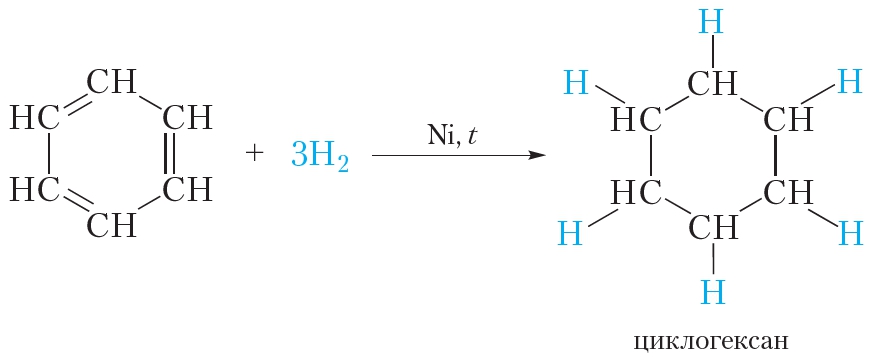

Реакция гидрирования бензола протекает в более жёстких условиях, чем гидрирование алкенов, так как в молекуле бензола в ходе гидрирования разрушается устойчивая сопряжённая система π-связей.
С реакцией присоединения хлора к бензолу вы можете познакомиться, перейдя по ссылке в QR-коде.
4. Горение
Подобно всем углеводородам, бензол горит. Уравнение реакции горения бензола:

Получение бензола
Из природных источников
Благодаря высокой устойчивости сопряжённой системы p-связей, ароматические фрагменты встречаются в составе каменного угля. Поэтому одним из способов получения бензола является переработка каменного угля. При сильном нагревании без доступа воздуха каменный уголь подвергается сложным химическим превращениям. В результате образуется много летучих продуктов, из которых, наряду с другими веществами, извлекают бензол.
Бензол получают также в результате переработки нефти. Эти процессы будут рассмотрены в следующем параграфе.
Из ацетилена
Бензол можно получить из ацетилена:
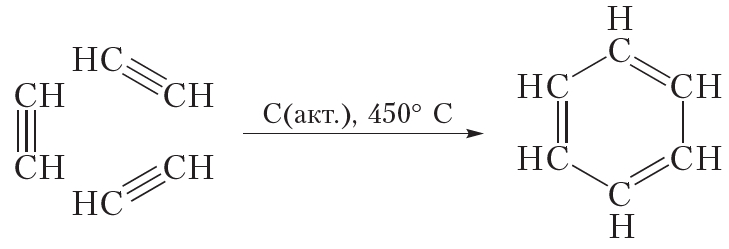
В данной реакции из трёх молекул ацетилена образуется одна циклическая молекула бензола, поэтому эта реакция называется реакцией циклотримеризации. Данная реакция протекает при пропускании ацетилена над нагретым активированным углём.
Применение бензола
Значительная часть бензола используется для синтеза других веществ. Так, нитрованием бензола получают нитробензол, который является исходным веществом для синтеза анилина (§ 45). Хлорированием бензола получают хлорбензол, который применяется для получения фенола (§ 27), пестицидов и т. д. Из бензола получают этилбензол. Дегидрированием этилбензола синтезируют винилбензол (стирол), который является сырьём для производства полимеров.
Бензол и некоторые его гомологи применяются в качестве растворителей органических веществ, однако из-за высокой токсичности бензола его применение в этом качестве ограниченно.
Для бензола характерны реакции замещения, в которых сопряжённая система π-связей сохраняется.
Бензол не обесцвечивает бромную воду, но в присутствии катализатора вступает с бромом в реакцию замещения с образованием бромбензола.
В жёстких условиях бензол вступает в реакцию присоединения с водородом. В результате образуется циклогексан.
Бензол получают в результате переработки нефти и каменного угля. Кроме того, бензол может быть получен по реакции циклотримеризации ацетилена.
*Нитрование толуола
Нитрование толуола
Примером нитросоединения с несколькими нитрогруппами в молекуле является продукт нитрования ближайшего гомолога бензола — толуола. При этом три атома водорода бензольного кольца замещаются на нитрогруппы:
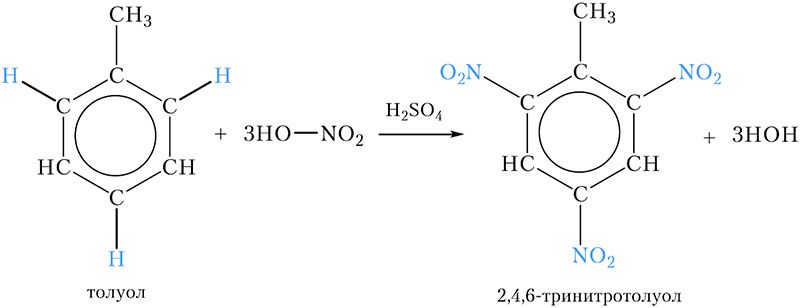
Название продукта — 2,4,6-тринитротолуол , его часто называют просто тринитротолуолом, ТНТ или тротилом. Тринитротолуол является взрывчатым веществом, которое используется в промышленности и военном деле.
*Хлорирование бензола
Хлорирование бензола
Молекула бензола может присоединить три молекулы хлора. Реакция протекает при нагревании и облучении ультрафиолетовым светом:
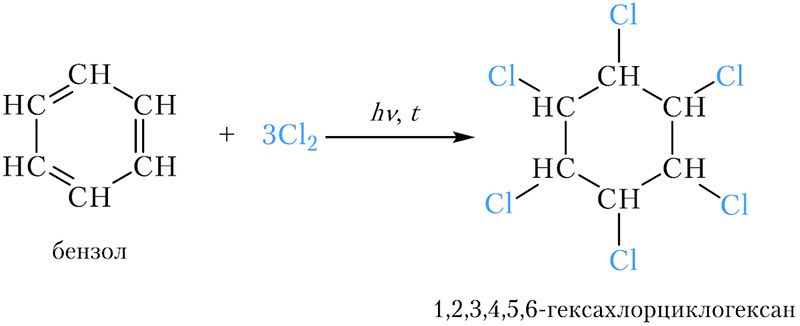
Образуется 1,2,3,4,5,6-гексахлорциклогексан , или гексахлоран. Это вещество долгое время использовалось в качестве инсектицида. Сейчас оно не применяется ввиду высокой токсичности.
Реакции гомологов бензола с участием боковой цепи
Гомологи бензола могут вступать в реакции замещения атомов водорода боковой цепи другими атомами. Используя это свойство, можно легко различить бензол и толуол. Для этого в две пробирки наливают по 2–3 см 3 бензола и толуола соответственно, затем по 2–3 см 3 бромной воды. Пробирки закрывают пробками и встряхивают. При этом бром из водной фазы за счёт лучшей растворимости в углеводородах переходит в органический слой, который находится сверху. При этом органический слой окрашивается в оранжевый цвет. Пробирки некоторое время интенсивно освещают. Через несколько минут можно наблюдать, что в одной из пробирок оранжевая окраска органического слоя сохранилась, тогда как во второй пробирке органический слой обесцветился. Обесцвечивание произошло в пробирке с толуолом за счёт протекания реакции замещения атома водорода метильной группы на атом брома:
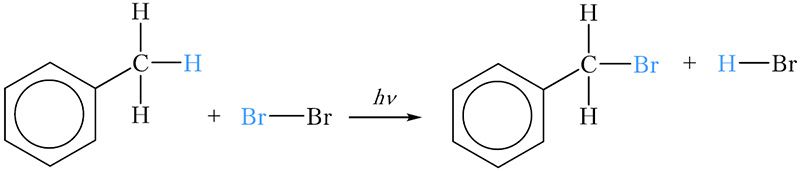
Образовавшееся бромпроизводное толуола не имеет окраски.
Эта реакция напоминает реакцию замещения атомов водорода в молекулах алканов атомами галогенов. Реакция протекает при освещении, это свидетельствует о радикальном механизме реакции замещения, инициируемой светом (§ 10).
Атом углерода метильной группы в молекуле толуола легко окисляется, при этом образуется бензойная кислота. В качестве окислителя обычно используют раствор перманганата калия, подкисленный серной кислотой, либо хромовую смесь (раствор дихромата калия K2Cr2O7, подкисленный H2SO4). Схема реакции окисления толуола:
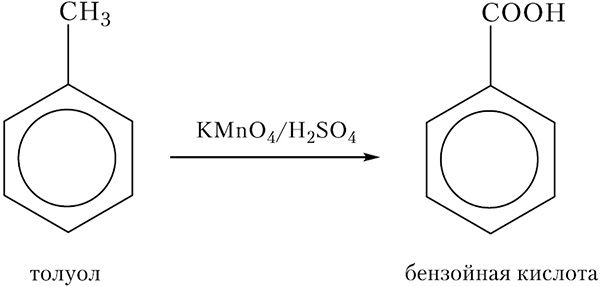
Вопросы и задания
1. Как распознать на основании химических свойств три жидкости: бензол, гексан и гексен-1? Приведите уравнения соответствующих реакций. Укажите условия их протекания. Опишите наблюдаемые явления.
2. Напишите уравнения реакций взаимодействия метана и бензола с хлором. Укажите условия их протекания. Почему обе реакции называются реакциями замещения?
3. Известно, что в присутствии платины этилен присоединяет водород даже при комнатной температуре. Бензол в этих условиях водород не присоединяет. Реакция присоединения водорода к бензолу протекает в жёстких условиях — при температуре 200 о С под давлением и в присутствии никеля в качестве катализатора. Объясните, с чем связано такое различие в реакционной способности этилена и бензола.
4. Приведите уравнение реакции циклотримеризации ацетилена в присутствии активированного угля. Какие продукты могут образоваться при циклотримеризации пропина в подобных условиях? Приведите их структурные формулы и дайте им названия.
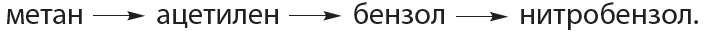
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
6*. Напишите уравнение реакции нитрования толуола. Назовите продукт реакции. Где он используется?
7*. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
гептен-1 гептан толуол 2,4,6-тринитротолуол .
8*. Напишите структурные формулы всех гомологов бензола состава С9Н12. Назовите их.
9*. Каково строение углеводорода состава С8Н8, обесцвечивающего бромную воду, легко полимеризующегося, а при окислении дающего бензойную кислоту? Напишите уравнения описанных реакций.
(Ответ: стирол.)
10*. Установите строение ароматического углеводорода состава С9Н12, при моногалогенировании которого в присутствии катализатора получается только одно галогенпроизводное.
(Ответ: 1,3,5-триметилбензол. )
Читайте также:

