Где липаза осуществляет каталитические свойства
Обновлено: 16.05.2024

Липаза — гидролаза эфиров глицерина, липолитический фермент (КФ 3.1.1.3), эстераза. Основная функция липазы в пищеварительном процессе — расщепление поступающих с пищей жиров. Второе название — стеапсин.
Содержание
Панкреатическая липаза
Панкреатическая липаза синтезируется в поджелудочной железе и в составе панкреатического сока попадает в двенадцатиперстную кишку.
На рисунке сверху-справа: панкреатическая липаза человека (вторичной структуры выделены цветами: альфа-спирали показаны в красный цвет, бета-листы — в желтый, случайная спираль — в зеленый) в комплексе с свиной колипазой (синего цвета) и небольшой молекулой ингибитора (вверху слева).
Липаза имеет гидрофильную и гидрофобную части и действует только на поверхности раздела вода-жир. Панкреатическая липаза катализирует в полости тонкой кишки разложение жиров пищи (триглицеридов) на глицерин и высшие жирные кислоты, образуя сначала 1.2 и 2.3-диглицериды, а затем 2-моноглицериды. На одну молекулу триглицерида освобождается две молекулы жирных кислот. Этот процесс происходит в полости тонкой кишки посредством полостного пищеварения. Гидролиз 2-моноглицерида идет очень медленно под воздействием моноглицеридлипазы. При этом образуются глицерин и жирная кислота.
Панкреатическая липаза может быть адсорбированной в гликокаликсе. Липаза осуществляет гидролитическое расщепление триглицеридов, взаимодействуя с другим панкреатическим ферментом — колипазой, небольшого протеина с молекулярной массой менее 11 000 дальтон. Желчные кислоты при высоких концентрациях ингибируют активность липазы в отсутствие колипазы, препятствуя ее контакту с триглицеридами. Если липаза ассоциирована с колипазой, то они могут адсорбироваться на поверхности вода — триглицерид, и осуществлять свое ферментативное действие. Кроме того, к водно-жировой поверхности или на неё с помощью комплекса липаза — колипаза транспортируются фосфолипиды и холестерин желчи.

Панкреатическая липаза имеет молекулярную массу 48 000 единиц и оптимум каталитической активности рН 8–9. В каталитическом центре панкреатическая липаза содержит остаток гистидина и серина. Каталитическую активность панкреатической липазы значительно увеличивает колипаза, также имеющаяся в панкреатическом соке.
Липаза в ферментных препаратах
Липазу является активным компонентам во многих ферментных препаратах, применяемых для коррекции нарушений процесса пищеварения, а также для регуляции функций поджелудочной железы. Чаще всего это комплексные препараты, содержащие основные ферменты поджелудочной железы домашних животных. Такие лекарства способствуют купированию клинических признаков внешнесекреторной недостаточности поджелудочной железы, к которым относят снижение аппетита, тошноту, урчание в животе, метеоризм, стеаторею, креаторею и амилорею. Самым популярным лекарством, содержащим комплекс панкреатических ферментов, включающим липазу, является панкреатин. Кроме него, имеется множество других препаратов, содержащих липолитические ферменты, в т.ч. липазу, часть из них приведена в таблице (Саблин О.А., Бутенко Е.В., формуляры препаратов):
Лингвальная липаза
Лингвальная липаза — пищеварительный фермент, липаза, вырабатываемый расположенными во рту железами. Функция лингвальной липазы заключается в расщеплении жиров молока, в основном триацилглицеролов, у детей грудного возраста.
Железы, продуцирующие лингвальную липазу, расположены в слизистой оболочке корня языка и примыкающей к нему области глотки грудного ребёнка. Их стимуляция происходит при раздражении механорецепторов во время сосательных и глотательных движений при естественном кормлении грудью. Молоко проглатывается быстро и лингвальная липаза, перемешанная с молоком, начинает действовать только в желудке. Оптимальной кислотностью для лингвальной липазы является 4–5 рН, равная кислотности желудочного сока грудных детей.
С переменой характера питания необходимость в лингвальной липазе уменьшается, железы полости рта снижают количество продуцируемой лингвальной липазы и её значимость в переваривании жиров уменьшается. У взрослых секреция лингвальной липазы невелика.
Анализ крови на липазу
При болезнях поджелудочной железы активность липазы значительно повышается и липаза в большом количестве начинает выделяться в кровь. При воспалении поджелудочной железы ее количество в крови заметно увеличивается. После острого приступа панкреатита уровень липазы в сыворотке крови возрастает через 4–8 часов до 200 раз, достигая пика через 24 часа, и снижается через 8–14 дней. Определение липазы при панкреатитах имеет высокую клиническую чувствительность и специфичность. Одновременное определение липазы и амилазы позволяет диагностировать поражение поджелудочной железы с точностью до 98%. Норма липазы для взрослых — до 190 ед/мл, у детей от до 18 лет — до 130 ед/мл (при исследовании по турбидиметрическому методу).
- новообразования поджелудочной железы
- хронические болезни желчного пузыря, желчная колика
- инфаркт или непроходимость кишечника
- костные переломы, ранения мягких тканей
- рак молочной железы
- почечная недостаточность
- заболевания, сопровождающиеся нарушением обмена веществ, а особенно липидов — ожирение, сахарный диабет, подагра
- эпидемический паротит при одновременном поражении поджелудочной железы.
- онкологических заболеваниях, кроме рака поджелудочной железы
- рационе питания, включающим чрезмерное количество жиров
Липаза — пищевая добавка
Получен очищенный препарат рекомбинантной липазы Thermosyntrophalipolytica с величиной гидролитической активности 280000 Ед/г, степень очистки белка 85 %. Изучены физико-химические свойства рекомбинантного белка. Установлено, что значение изоэлектрической точки для рекомбинантной липазы находится в интервале pI 3,7 ± 0,1 ед. Молекулярная масса фермента, определенная гель-фильтрацией на сефадексе G-150, составляет 14520 ± 20 Да. По результатам электрофореза получена величина молекулярной массы 14500 ± 10 Да. Определены оптимальные условия функционирования рекомбинантного фермента: рН 8,0 и температура 80 °С. Показана высокая термостабильность рекомбинантной липазы: при температуре 70 °С фермент сохраняет 100 % активности в течение 180 мин. При температуре 80 °С наблюдается сохранение 53,5 % гидролитической активности липазы в течение 120 мин, при 90 °С теряется 64 % активности фермента в течение 60 мин.

1. Бабич О.О. Особенности биотрансформациифенилаланина в технологии продуктов питания для больных фенилкетонурией / О.О. Бабич, И.С. Разумникова, Л.С. Солдатова // Техника и технология пищевых производств. – 2011. – № 2. – С. 103–109.
3. Long K. Substrate preference of mycelium-bound lipase from strain of Aspergillusflavus/ K. Long, H.M. Ghazali, A. Arif, M.Y. Che, C. Bucke // Biotechnol. Lett.– 1998.– № 4.– C. 369–372.
4. Madzak C. Heterologous protein expression and secretion in the nonconventional yeast Yarrowialipolytica: a review / C. Madzak, C. Gaillardin, J.M. Beckerich // Journal of Biotechnology. – 2004. – № 109. – Р. 63–81.
5. Schink B. Energetics of syntrophic cooperation in methanogenic degradation // Microbiol. Mol. Biol. Rev. – 1997. – Vol. 61. – P. 262–280.
6. Salameh M.A. Purification and characterization of two highly thermophilic alkaline lipases from Thermosyntrophalipolytica / M.A. Salameh, J. Wiegel // Appl. Environ. Microbiol. – 2007. – Vol. 73(23). – P. 7725–7731.
В последние годы значительно возрос удельный вес пищевых продуктов, вырабатываемых с добавлением ферментов или ферментных препаратов. Использование ферментов в технологии продуктов питания способствует повышению их качества, сокращает сроки производства, в ряде случаев повышает выход готовой продукции и облегчает контроль желаемых биохимических процессов [1]. Наряду с прочно вошедшими в практику микробными, растительными и животным протеазами, амилазами, пектиназами широкое применение находят ферменты липолитического действия [2].
В частности, в последнее время возрос интерес к одному из важнейших гидролитических ферментов – липазе. Перспективы практического применения липаз делают целесообразным исследование таких свойств липазы, как субстратная специфичность, оптимальные условия действия, стабильность при изменении кислотности среды и температуры. Многочисленные исследования посвящены изучению оптимальных условий действия липаз микроорганизмов, а также свойствам липазы как ферментного белка [2].
Фермент липаза-триглицеридгидролаза (КФ 3.1.1.3) широко распространен среди грибных микроорганизмов. Известно значительное количество продуцентов липазы, относящихся к родам Aspergillus, Penicillium, Rhisopus, Mucor, Candida, Yarrowia и др., изученных в различной степени [3].
В последние годы в качестве одного из наиболее перспективных микробных продуцентов липазы рассматривают дрожжи Yarrowialipolytica, у которых выявлено несколько внутриклеточных и секретируемых липаз. Повышенный интерес к созданию высокоэффективных продуцентов липаз на основе Yarrowialipolytica связан также с достаточно хорошей генетической изученностью этого объекта и тем, что данный вид дрожжей удобен для промышленной ферментации.
Известен дикий штамм Yarrowialipolytica W29 (АТСС 20460), на основе которого получен ряд штаммов реципиентов, в том числе Yarrowialipolytica Pold (CLIB 139) и Yarrowialipolytica Polf (АТСС MYA-2613), широко используемых для конструирования продуцентов секретируемых белков [4].
В патенте РФ № 2355754 описан рекомбинантный штамм дрожжей Yarrowialipolytica ВКПМY-3260 – продуцент липазы, сконструированный путем трансформации штамма Yarrowialipolytica Polf (АТСС MYA-2613) интегративной плазмидой pZ-ura3d4-hp4d-LIP2.
Однако описанные штаммы Yarrowialipolytica W29, Pold, Polf и ВКПМY-3260 имеют низкий уровень продукции липазы.
Перспективным штаммом-продуцентом ферментов липолитического действия является термоалкалофильная анаэробная бактерия Thermosyntrophalipolytica. Особенностью T. lypolitica является способность расщеплять триглицериды и утилизировать жирные кислоты при росте в синтрофном симбиотическом сообществе с метаногенной археей (род Methanobacterium). В природе синтрофный метаболизм является важной промежуточной стадией в анаэробной конверсии биополимеров, таких как полисахариды, белки и липиды до углекислого газа и метана [5]. Синтрофный рост на липидах обеспечивается за счет липаз, секретируемых из клетки в окружающую среду [6]. При росте в отсутствии синтрофного партнера липазы также синтезируются и секретируются из клетки, однако в этих условиях T. lipolytica не способна использовать жирные кислоты и, следовательно, расти на липидах.
В работе [7] показано, что геном термоалкалофильной бактерии T. lipolytica кодирует набор гидролитических ферментов, которые могут секретироваться из клетки в окружающую среду. Идентифицированные протеазы различных типов и липазы обеспечивают использование T. lipolytica белковых субстратов и липидов соответственно.
В РФ применение липаз в пищевой промышленности сдерживается отсутствием достаточного количества эффективных продуцентов, поскольку для каждого технологического процесса необходимо иметь липазы с определенными свойствами.
Цель работы – выделение, очистка и изучение свойств рекомбинантной липазы Thermosyntrophalipolytica, экспрессированной в клетках Escherichiacoli.
Материалы и методы исследований
Объектом исследования являлась рекомбинантная липаза, продуцированная клетками Escherichiacoli. На предварительном этапе исследования проводили выделение гена липазы из штамма Thermosyntrophalipolytica, клонирование гена, кодирующего липазу, создание системы устойчивой экспрессии гена в Escherichiacoli, наработку биомассы.
Для выделения фермента использовали метод осаждения сернокислым аммонием: раствор после добавления соли выдерживали в течение 16 ч при 4 °С. Сформировавшийся осадок отделяли сепарированием, растворяли в минимальном объеме 0,005 М фосфатного буфера.
Очистку фермента осуществляли хроматографическим методом. Для этого фракцию, полученную после осаждения сульфатом аммония, пропускали через колонку с сефадексом G-150, уравновешенную фосфатно-цитратным буфером (рН 7,5) со скоростьюэлюции 10 мл/ч по 1 мл.
Для определения изоэлектрической точки рекомбинантной липазы методом изоэлектрического фокусирования использовали очищенный препарат, исследование проводили при градиенте рН от 4,0 до 8,0, создаваемого амфолитом с пределом рН в указанном диапазоне.
Молекулярную массу рекомбинантной липазы определяли методом электрофореза в полиакриламидном геле по Лэммли и с применением гель-хроматографического метода на сефадексе G-150.
Гидролитическую активность рекомбинантной липазы определяли модифицированным методом Yamada и Machida, в котором в качестве субстрата использовали эмульсию оливкового масла. Реакционная смесь состояла из 5 мл эмульсии оливкового масла в 2 %-м растворе поливинилового спирта и 4 мл фосфатно-цитратного буфера (рН 7,0) и 1 мл раствора фермента. Липолиз проводили в стационарных условиях в течение часа при оптимальной температуре. Реакцию останавливали добавлением 30 мл этанола, продукты гидролиза титровали 0,05 М раствором NaOH в присутствии 1 %-го спиртового раствора фенолфталеина. За единицу липазной активности принимали такое количество фермента, которое отщепляет 1 мкмоль олеиновой кислоты от 40 %-й эмульсии оливкового масла за 1 час при оптимальной температуре. Содержание белка определяли по методу Лоури.
Для выяснения оптимального значения рН субстрата, при котором гидролиз происходит наиболее активно, проверяли диапазон рН от 4,0 до 9,0 на субстрате – эмульсии оливкового масла с поливиниловым спиртом. Величину рН субстрата устанавливали фосфатно-цитратным буфером. Гидролиз проводился на протяжении 30 мин.
При исследовании температурного оптимума липазы исследовали ее термостабильность. Для этого раствор фермента (1:1000) выдерживали при различных температурах в диапазоне от 60 до 100 °С в течение 30–180 мин, после чего определяли активность липазы.
Результаты исследования и их обсуждение
В ходе хроматографической очистки получен препарат рекомбинатной липазы с гидролитической активностью 280000 Ед/г, массовая доля белка равна 32,0 %. Степень очистки ферментного препарата составила 85 %.
Изучали такие физико-химические свойства рекомбинантной липазы, как изоэлектрическая точка, молекулярная масса, влияние рН и температуры на стабильность фермента, термостабильность.
Результаты определения изоэлектрической точки фермента представлены на рис. 1, из которого следует, что значение изоэлектрической точки для рекомбинантной липазы находится в интервале pI 3,7 ± 0,1 ед. Следует отметить, что пик активности фермента фактически совпадает с пиком выхода белка, иными словами, наблюдается один белковый пик в широком интервале рН, что является признаком высокой степени чистоты исследуемого препарата.
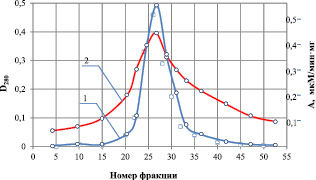
Рис. 1. Определение изоэлектрической точки липазы в градиенте рН от 4,0 до 8,0: 1 – удельная активность, мкМ/мин·мг; 2 – оптическая плотность при 280 нм, D280
Молекулярная масса рекомбинантной липазы, определенная гель-фильтрацией на сефадексе G-150, находится в пределах 14520 ± 20Да (рис. 2). Исследования молекулярной массы методом электрофореза в полиакриламидном геле показали, что она равна 14500 ± 10 Да (рис. 3).
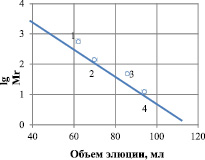
Рис. 2. Определение молекулярной массы липазы гель-хроматографическим методом на сефадексе G-150. Маркерные белки: 1 – ферритин (450 кДа); 2 – альдолаза (160 кДа); 3 – яичный альбумин (45 кДа); 4 – цитохром С (12,5 кДа)
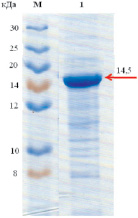
Рис. 3. Определение молекулярной массы липазы методом электрофореза в полиакриламидном геле: М – маркер PageRuler (Bio-Rad, США), диапазон молекулярных масс от 8 до 30 кДа; 1 – рекомбинантная липаза
Наибольший интерес представляет изучение таких свойств рекомбинантного фермента, как оптимальные условия функционирования: температура и рН. Для определения рН-оптимума липазы проводили гидролиз эмульсии триглицеридов оливкового масла в интервале рН от 4,0 до 9,0.
На рис. 4 представлены результаты исследования зависимости величины активности липазыот концентрации ионов водорода.
Из рис. 4 следует, что рН-оптимум исследуемой липазы лежит в пределах 7,5–8,5. Следует отметить, что ветви полученной кривой несимметричны: нисходящая ветвь характеризуется более крутым наклоном.
Как известно, зависимость активности фермента от температуры объясняется тем, что, с одной стороны, данный фактор влияет на белковую часть фермента, приводя к его денатурации и снижению уровня каталитической активности, с другой стороны, при повышении температуры возрастает скорость реакции образования фермент-субстратного комплекса.
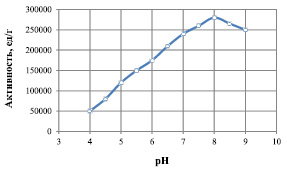
Рис. 4. Зависимости активности липазы от величины рН
На рис. 5 представлена зависимость величины активности липазы от температуры. Данные получены при оптимальном значении рН 8,0 и в температурном интервале от 60 до 100 °С. Из представленного графика видно, что зависимость активности липазы от температуры описывается колоколообразной кривой. При низкой температуре снижение активности связано с уменьшением доли активных молекул фермента, а при высокой – существенными конформационными изменениями в молекуле липазы. Наибольшая активность фермента наблюдается при температуре от 75 до 85 °С и составляет 280000 ед./г белка. Оптимальной температурой функционирования рекомбинантной липазы является 80 °С.
В таблице представлены данные, характеризующие влияние температуры и времени экспозиции на стабильность рекомбинантной липазы.
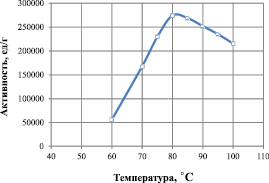
Рис. 5. Влияние температуры на активность липазы при оптимальной величине рН
Читайте также:

