Диастолическая дисфункция левого желудочка 1 типа берут ли в армию
Обновлено: 02.07.2024
На сегодняшний день диагноз застойной сердечной недостаточности (ЗСН) установлен у трех млн. американцев, при этом ежегодно диагностируется еще 500 000 новых случаев. Данное состояние является наиболее частым диагнозом при выписке из стационаров пациентов старше 65 лет и самым дорогостоящим заболеванием для системы государственного страхования Medicare. ЗСН может развиваться вследствие как систолической, так и диастолической дисфункции. У всех пациентов с систолической дисфункцией имеет место сопутствующая диастолическая дисфункция; таким образом, у пациента не существует систолической сердечной недостаточности в чистом виде. И наоборот, определенные сердечно-сосудистые заболевания, такие как гипертензия, могут приводить к диастолической дисфункции без сопутствующей систолической дисфункции. Хотя диастолическая сердечная недостаточность диагностируется приблизительно в 40–60% случаев застойной сердечной недостаточности, у таких больных прогноз лучше, нежели у пациентов с систолической сердечной недостаточностью.
Определение и диагностические критерии
Под диастолической сердечной недостаточностью подразумевается состояние, вызванное повышением резистентности к наполнению одного или обоих желудочков; это приводит к застою в результате патологического смещения кривой диастолическое давление–объем вверх. Хотя данное определение отражает принципиальный патофизиологический механизм диастолической сердечной недостаточности, его клиническое использование невозможно. Более практичное определение, которое можно применять в клинике, следующее: состояние, при котором отмечаются классические симптомы ЗСН, но при наличии патологической диастолической, однако нормальной систолической функции в покое. Группой исследования диастолической дисфункции предложено, чтобы врачи учитывали и клинические, и эхокардиографические данные с целью выделения группы пациентов с диастолической сердечной недостаточностью согласно степени диагностической точности.
Распространенность и этиология
В среднем у 40% пациентов с сердечной недостаточностью систолическая функция сохранена. Частота диастолической сердечной недостаточности повышается с возрастом, она чаще встречается у пожилых женщин. Наиболее распространенными причинами диастолической сердечной недостаточности являются гипертензия и ишемия миокарда (табл. 1). Провоцирующими факторами зачастую являются перегрузка объемом, тахикардия, физическая нагрузка, гипертензия, ишемия, системные стрессоры (например анемия, лихорадка, инфекция, тиреотоксикоз), аритмия (например фибрилляция предсердий, атриовентрикулярная узловая блокада), повышенное употребление в пищу поваренной соли, а также прием нестероидных противовоспалительных средств.
Таблица 1. Причины диастолической дисфункции и сердечной недостаточности
- Распространенные причины
- Ишемия миокарда
- Гипертензия
- Пожилой возраст
- Ожирение
- Аортальный стеноз
- Поражение миокарда
- Инфильтративное (при амилоидозе, саркоидозе, жировой инфильтрации)
- Неинфильтративное (идиопатическая и гипертрофическая кардиомиопатия)
- Заболевания эндокарда
- Гиперэозинофильный синдром
- Болезни накопления
- Болезнь накопления гликогена
- Гемохроматоз
- Заболевания перикарда
- Констриктивный перикардит
- Выпотной констриктивный перикардит
- Перикардиальный выпот
Диастола — это процесс, во время которого сердце возвращается к своему расслабленному состоянию. На протяжении данного периода происходит перфузия сердечной мышцы. Общепринято диастолу делить на четыре фазы: изоволюметрическая релаксация, начинающаяся с момента закрытия аортального клапана и до открытия митрального клапана; раннего быстрого наполнения желудочков, начинающегося после открытия митрального клапана; диастаз — период низкого кровотока в середине диастолы; и позднее быстрое наполнение во время сокращения предсердий. В соответствии с широким определением, изолированная диастолическая дисфункция — это нарушение изоволюметрической релаксации желудочков и снижение эластичности левого желудочка. При наличии диастолической дисфункции сердце способно обеспечивать метаболические потребности организма как в покое, так и во время физической нагрузки, но за счет возрастания давления наполнения левого желудочка. Передача высокого конечно-диастолического давления к легочному руслу может вызывать застой в легких, что приводит к одышке и, в конце концов, к правосторонней сердечной недостаточности. При умеренной диастолической дисфункции удлиняется поздняя фаза диастолического наполнения, пока конечно-диастолический объем левого желудочка не возвращается к норме. При тяжелой диастолической дисфункции желудочек становится настолько ригидным, что миокард предсердия не способен компенсировать нарушения наполнения и конечно-диастолический объем не может нормализоваться за счет повышения давления наполнения. Как следствие, снижается ударный объем и сердечный выброс и ухудшается толерантность к физической нагрузке. На рисунке представлен патофизиологический механизм диастолической сердечной недостаточности.
Сердечная недостаточность может проявляться утомляемостью, одышкой при физической нагрузке, пароксизмальной ночной одышкой, ортопноэ, расширением яремных вен, влажными хрипами в легких, тахикардией, патологическими третьим или четвертым тонами сердца, гепатомегалией и отеками. Кардиомегалия и венозный застой в легких часто обнаруживаются при рентгенографии ОГК. Однако данные находки неспецифичны и часто имеют место при несердечных состояниях, таких как заболевания легких, анемия, гипотиреоз и ожирение. Кроме того, на основании только лишь физикальных данных сложно отличить диастолическую сердечную недостаточность от систолической.
Определение уровня мозгового натрийуретического пептида (МНП) в сыворотке позволяет точно отдифференцировать сердечную недостаточность от несердечных состояний у пациентов с одышкой, но данная проба не дает возможности отличить диастолическую сердечную недостаточность от систолической.
Двухмерная эхокардиография с допплерографией используется не только для получения основной информации относительно размеров камер сердца, толщины стенок, сегментарной сократимости и суммарной систолической функции, структуры клапанов и перикарда, а также для оценки показателей диастолического трансмитрального кровотока и легочного венозного кровотока. При допплерографии пиковая скорость кровотока через митральный клапан во время раннего диастолического наполнения соответствует волне Е, тогда как скорость кровотока во время сокращения предсердий соответствует волне А. Из полученных данных рассчитывается соотношение Е/А. В норме амплитуда волны Е выше амплитуды волны А, а соотношение Е/А составляет приблизительно 1,5.
На ранних стадиях диастолической дисфункции нарушается процесс релаксации и за счет энергичного сокращения предсердий соотношение Е/А снижается и не превышает 1,0. При прогрессировании заболевания снижается эластичность левого желудочка, в результате чего возрастает давление в левом предсердии и, в свою очередь, это увеличивает раннее наполнение левого желудочка, несмотря на нарушение его релаксации. Такая парадоксальная нормализация соотношения Е/А называется псевдонормализацией. У пациентов с тяжелой диастолической дисфункцией наполнение левого желудочка происходит преимущественно в раннюю диастолу, в результате чего соотношение Е/А превышает 2,0. На скорости Е и А влияют объем циркулирующей крови, анатомия и функция митрального клапана и наличие фибрилляции предсердий, что снижает надежность допплеровской оценки трансмитрального кровотока. В таких случаях допплеровская визуализация является информативным методом оценки движения митрального кольца (показатель трансмитрального кровотока, не зависящий от упомянутых факторов).
Катетеризация сердца остается важным методом диагностики диастолической дисфункции. Однако в рутинной клинической практике двухмерная эхокардиография с допплерографией является оптимальным неинвазивным методом подтверждения диагноза. В немногих случаях, когда эхокардиографию выполнить технически сложно, можно использовать радионуклидную ангиографию.
Первичная профилактика диастолической дисфункции включает отказ от курения и жесткий контроль гипертензии, гиперхолестеринемии и ИБС. Аналогично эффективной в профилактике диастолической и систолической сердечной недостаточности является модификация образа жизни, а именно снижение массы тела, отказ от курения, коррекция питания, ограничение употребления алкоголя и регулярные физические нагрузки. Диастолическая дисфункция может присутствовать на протяжении нескольким лет до того, как она станет клинически явной. Ранняя диагностика и лечение крайне важны, поскольку позволяют предотвратить необратимые структурные изменения и развитие систолической дисфункции. Однако ни один препарат в качестве монотерапии не проявляет чистых люзитропных свойств (то есть селективного улучшения релаксации миокарда без угнетения сократимости левого желудочка). Поэтому медикаментозная терапия диастолической дисфункции и диастолической сердечной недостаточности часто эмпирическая и не определена настолько четко, как методы лечения систолической сердечной недостаточности. С первого взгляда кажется, что медикаментозное лечение диастолической и систолической сердечной недостаточности существенно не отличается, однако терапия диастолической сердечной недостаточности ограничена отсутствием крупномасштабных и убедительных рандомизированных клинических исследований. Кроме того, оптимальное лечение систолической сердечной недостаточности может усугублять диастолическую сердечную недостаточность. До настоящего времени большинство клинических исследований фокусировалось исключительно на пациентах с систолической сердечной недостаточностью, только недавно начали появляться исследования диастолической сердечной недостаточности.
Несмотря на отсутствие окончательных данных, касающихся специфических методов лечения диастолической сердечной недостаточности, в объединенных рекомендациях Американской коллегии кардиологии и Американской сердечной ассоциации подчеркивается, чтобы при лечении диастолической сердечной недостаточности врачи делали акцент на контроле артериального давления, частоты сердечных сокращений, снижении объема циркулирующей крови и уменьшении ишемии миокарда. Данные рекомендации направлены на причины диастолической дисфункции и, вероятно, позволят улучшить функцию левого желудочка и оптимизировать гемодинамику. В таблице 2 перечислены цели лечения диастолической сердечной недостаточности.
Таблица 2. Цели лечения диастолической сердечной недостаточности
- Устраняйте провоцирующие факторы и основные заболевания сердца
- Профилактика и лечение гипертензии и ИБС
- Хирургическое удаление патологического перикарда
- Улучшение релаксации левого желудочка
- Ингибиторы АПФ
- Блокаторы кальциевых каналов
- Ингибиторы АПФ и БРА
- Антагонисты альдостерона
- Бета-блокаторы
- Блокатор кальциевых каналов
- Бета-блокатор (преимущественно)
- Блокаторы кальциевых каналов (препараты второй линии)
- Дигоксин (спорный вопрос)
- Абляция атриовентрикулярного узла (в редких случаях)
- Ингибиторы АПФ
- Антагонисты альдостерона (теоретическая польза)
- Ограничение употребления соли и воды
- Диурез, диализ или плазмаферез
- Бета-блокаторы
- Ингибиторы АПФ
- Контроль артериального давления
- Советы, касающиеся диеты (ограничение натрия)
- Контроль объема жидкости в организме (ежедневное взвешивание и коррекция дозы диуретиков)
- Программа физических нагрузок
АПФ — ангиотензинпревращающий фермент; БРА — блокаторы рецепторов ангиотензина.
Улучшение функции левого желудочка
При лечении пациента с диастолической дисфункцией важно контролировать частоту сердечных сокращений и предотвращать эпизоды тахикардии с целью максимального удлинения периода диастолического наполнения. Для достижения этой цели особенно полезными являются бета-блокаторы, однако они не влияют непосредственно на релаксацию миокарда. Помимо замедления ЧСС, для бета-блокаторов доказана способность эффективно снижать артериальное давление, уменьшать ишемию миокарда, способствовать регрессу гипертрофии левого желудочка и противодействовать избыточной адренергической стимуляции, возникающей при сердечной недостаточности. Для бета-блокаторов было доказано, что они независимо ассоциируются с улучшением выживаемости пациентов с диастолической сердечной недостаточностью. Данный класс препаратов должен использоваться для лечения диастолической сердечной недостаточности, особенно при наличии гипертензии, ИБС или аритмии.
Оптимизация гемодинамики достигается прежде всего путем снижения сердечной преднагрузки и постнагрузки. Ингибиторы АПФ и блокаторы рецепторов ангиотензина ІІ (БРА) непосредственно влияют на релаксацию миокарда и его эластичность путем ингибирования продукции ангиотензина ІІ или блокаду рецепторов ангиотензина ІІ, вследствие чего уменьшается отложение коллагена в интерстиции и фиброз миокарда. Опосредствованные положительные эффекты оптимизации гемодинамики включают улучшение наполнения левого желудочка и снижение артериального давления. Что более важно, отмечается улучшение толерантности к физической нагрузке и качество жизни. В одном ретроспективном исследовании было засвидетельствовано, что применение ингибиторов АПФ у пациентов с диастолической сердечной недостаточностью ассоциировалось с продлением выживаемости. В одной из ветвей исследования CHARM (Candesartan in Heart Failure Assessment Reduction in Morbidity and Mortality), в котором изучались эффекты кандесартана у пациентов с нормальной фракцией выброса левого желудочка (продолжительность наблюдения 36,6 месяца), не удалось засвидетельствовать существенного благоприятного влияния на смертность. Однако лечение кандесартаном сопровождалось снижением частоты госпитализаций по поводу декомпенсации ЗСН.
Патологическая релаксация и повышенная ригидность ассоциируются с нарушениями диастолического наполнения и нормальной толерантностью к физической нагрузке на ранних стадиях диастолической дисфункции. При прогрессировании заболевания во время физической нагрузки давление в легочной артерии патологически возрастает, в результате чего снижается толерантность к физической нагрузке. Если давление наполнения левого желудочка повышается и далее, возрастает давление в левом предсердии и увеличиваются его размеры, значительно снижается толерантность к физическим нагрузкам и появляются клинические признаки застойной сердечной недостаточности.
Диуретики эффективно уменьшают внутрисосудистый объем жидкости, ослабляют одышку и предотвращают декомпенсацию сердечной недостаточности у пациентов с диастолической дисфункцией. Несмотря на то, что диуретики помогают контролировать артериальное давление, способствуют регрессу гипертрофии левого желудочка и уменьшают плотность левого желудочка, некоторые пациенты с диастолической сердечной недостаточностью чувствительны к уменьшению преднагрузки и у них имеется риск развития гипотензии или тяжелой преренальной азотемии. Внутривенные диуретики должны применяться только для облегчения острых симптомов.
Гормон альдостерон способствует процессам фиброза в сердце и, как следствие, диастолической ригидности. Антагонист альдостерона спиронолактон изучался в крупномасштабном клиническом исследовании систолической сердечной недостаточности, где было засвидетельствовано снижение смертности, связанной с сердечной недостаточностью. Однако специфические эффекты спиронолактона при диастолической дисфункции неизвестны.
Было засвидетельствовано, что блокаторы кальциевых каналов непосредственно улучшают диастолическую функцию и способствуют релаксации миокарда благодаря снижению концентрации кальция в цитоплазме или опосредствовано путем снижения артериального давления, уменьшения или предотвращения ишемии миокарда, обеспечивая регресс гипертрофии левого желудочка и замедление ЧСС. Однако недигидропиридиновые блокаторы кальциевых каналов (верапамил и дилтиазем) не должны использоваться у пациентов с нарушениями систолической функции левого желудочка. Дигидропиридиновые блокаторы кальциевых каналов длительного действия (например амлодипин), должны использоваться для контроля артериального давления и стенокардии в случаях, если бета-блокаторы противопоказаны или неэффективны. И наконец, большие рандомизированные клинические исследования не засвидетельствовали снижения смертности у пациентов с изолированной диастолической дисфункцией при приеме блокаторов кальциевых каналов.
Вазодилятаторы (например нитраты) могут быть полезными, поскольку они снижают преднагрузку и обладают противоишемическим эффектом, особенно при невозможности использования ингибиторов АПФ. Однако в исследовании Vasodilator Heart Failure Trial не было засвидетельствовано существенного положительного влияния на выживаемость пациентов с диастолической сердечной недостаточностью. Вазодилятаторы следует использовать с осторожностью, поскольку снижение преднагрузки может неблагоприятно влиять на сердечный выброс. В отличие от других препаратов, использующихся при диастолической сердечной недостаточности, вазодилятаторы не влияют на регресс гипертрофии левого желудочка.
Точная роль дигоксина при лечении пациентов с диастолической сердечной недостаточностью не определена. Дигоксин может оказывать вредное влияние у пожилых пациентов с гипертрофией левого желудочка и при гипертрофической обструктивной кардиомиопатии, поэтому дигоксин целесообразно назначать только пациентам с диастолической сердечной недостаточностью и сопутствующей фибрилляцией предсердий.
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период тол
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период только в англоязычных изданиях опубликованы более 1000 крупных научных работ. ГКМП — одна из основных и, вероятно, наиболее распространенных форм кардиомиопатий, заболеваний миокарда, сопровождающихся его дисфункцией (Report of the 1995 WHO/ISFC Task Force on the Definition and Classification of Cardiomyopathy) [1].
Определение заболевания носит описательный характер. Так, по современным представлениям, ГКМП является преимущественно генетически обусловленным заболеванием мышцы сердца, характеризующимся комплексом специфических морфофункциональных изменений и неуклонно прогрессирующим течением с высокой угрозой развития тяжелых, жизнеугрожающих аритмий и внезапной смерти (ВС). ГКМП характеризуется массивной гипертрофией миокарда левого и/или реже правого желудочка, чаще асимметричного характера за счет утолщения межжелудочковой перегородки (МЖП), нередко с развитием обструкции (систолического градиента давления) выходного тракта ЛЖ при отсутствии видимых причин (артериальная гипертония, пороки и специфические заболевания сердца). Основным методом диагностики остается эхокардиографическое исследование. В зависимости от наличия или отсутствия градиента систолического давления в полости ЛЖ, ГКМП разделяют на обструктивную и необструктивную, что имеет важное практическое значение при выборе тактики лечения. При этом различают 3 гемодинамических варианта обструктивной ГКМП: с субаортальной обструкцией в покое (так называемой базальной обструкцией); с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины; с латентной обструкцией, которая вызывается только при нагрузке и провокационных фармакологических пробах (в частности, вдыханием амилнитрита, при приеме нитратов или внутривенном введении изопротеренола).
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов [3, 4].
Cимптомы болезни разнообразны и малоспецифичны, связаны с гемодинамическими нарушениями (диастолическая дисфункция, динамическая обструкция путей оттока, митральная регургитация), ишемией миокарда, патологией вегетативной регуляции кровообращения и нарушением электрофизиологических процессов в сердце [5, 6, 7]. Диапазон клинических проявлений крайне велик: от бессимптомных до неуклонно прогрессирующих и трудно поддающихся медикаментозному лечению форм, сопровождающихся тяжелой симптоматикой. При этом первым и единственным проявлением заболевания может стать внезапная смерть.
ГКМП — это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата [2, 22]. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений. При этом отчетливо выделяются 5 основных вариантов течения заболевания и исходов:
Вариабельность прогноза определяет необходимость детальной стратификации риска фатальных осложнений заболевания, поиск доступных прогностических предикторов и критериев оценки проводимого лечения.
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза (рис.).
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск ВС (в частности, скрытых прогностически значимых аритмий).
К общим мероприятиям относятся ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска ВС. Для предупреждения инфекционного эндокардита в ситуациях, связанных с развитием бактериемии, при обструктивных формах ГКМП рекомендуется антибиотикопрофилактика, аналогичная таковой у больных с пороками сердца.
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью ВС. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции [28, 29]. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики [30, 31]. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов (верапамил). Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид и амиодарон.
β-адреноблокаторы стали первой и остаются и по сей день наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП [32, 33, 34], что обусловлено, в основном, способностью этих препаратов уменьшать потребность миокарда в кислороде. Благодаря отрицательному инотропному действию и уменьшению активации симпатоадреналовой системы при физическом и эмоциональном напряжении, β-блокаторы предотвращают возникновение или повышение субаортального градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно показана способность β-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения [35]. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно — за счет уменьшения частоты сердечных сокращений и предупреждения ишемии сердечной мышцы [36]. В литературе имеются данные, подтверждающие способность β-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда [37, 38]. Однако другие авторы подчеркивают, что вызываемое β-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных [39]. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считают целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями внезапной смерти семейным анамнезом [40].
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения нового поколения кардиоселективных β-блокаторов пролонгированного действия, в частности атенолола, конкора и др. При этом существует мнение о том, что кардиоселективные β-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, так как в больших дозах, к достижению которых следует стремиться, селективность практически утрачивается. Следует отметить, что рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных β-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при ГКМП основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Среди блокаторов кальциевых каналов препаратом выбора, благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимальному профилю фармакологических свойств, является верапамил (изоптин, финоптин). Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению β-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую, и улучшать его диастолическое расслабление и податливость ЛЖ [41, 42, 43]. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с β-блокаторами способности к уменьшению внутрижелудочковой обструкции в случаях физического и эмоционального напряжения и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия [44]. И хотя этот эффект чаще всего нивелируется непосредственным положительным влиянием на диастолическую функцию ЛЖ, у отдельных больных с базальной внутрижелудочковой обструкцией в сочетании с повышенным конечно-диастолическим давлением ЛЖ и склонностью к системной артериальной гипотензии при уменьшении постнагрузки внутрижелудочковый градиент давления может резко возрастать. Это способно приводить к развитию отека легких, кардиогенного шока и даже внезапной смерти [45]. Подобные грозные осложнения фармакотерапии верапамилом описаны также у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Очевидно, как важно соблюдать осторожность при начале лечения верапамилом этой категории больных. Прием препарата следует начинать в условиях стационара с малых доз — 20–40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения частоты сердечных сокращений в покое до 50–60 уд/мин. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки; более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, а также доказанной способности увеличивать выживаемость больных ГКМП по сравнению с плацебо [46], целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных [47].
В нашей клинике продолжается проспективное наблюдение (от 1 до 5 лет) более 100 больных ГКМП. Больные были рандомизированы на 3 сопоставимые по количеству, полу, возрасту и тяжести клинических проявлений группы. Пациентам произвольно назначались атенолол или изоптин-ретард; в третьей группе преобладали лица с тяжелыми желудочковыми нарушениями ритма, и им был рекомендован прием соталола. Оценка эффективности различных вариантов медикаментозного лечения проводилась в условиях длительного (не менее 1 года) применения препаратов. Суточные дозы при двухкратном режиме приема титровались индивидуально и составили в среднем 85, 187, 273 мг для атенолола, изоптина и соталола соответственно. Длительная терапия привела к улучшению клинического состояния соответственно у 77, 72 и 83% пациентов каждой группы, что выражалось в достоверном уменьшении основных симптомов, проявлений сердечной недостаточности (СН), увеличении мощности и времени выполненной нагрузки и улучшении показателей качества жизни (на 25, 32 и 34% соответственно). При этом выявлены достоверное (p
С. А. Габрусенко, кандидат медицинских наук
Ю. В. Сафрыгина
В. Г. Наумов, доктор медицинских наук, профессор
Ю. Н. Беленков, доктор медицинских наук, профессор
НИИ кардиологии им. А. Л. Мясникова РК НПК МЗ РФ, МоскваЧто такое дилатационная кардиомиопатия (ДКМП), как она проявляется и поддается ли лечению? Данной патологии характерна дилатация полостей желудочков (растяжение, истончение) и систолическая дисфункция (снижение сократительной способности миокарда). При расширении камер объем миокарда остается неизменным. Длительное время патология может протекать незаметно для пациента или проявляться неспецифичными симптомами, которые часто списывают на общее недомогание. Тем временем болезнь прогрессирует и угнетает кардиальную деятельность. В итоге пациент рискует столкнуться с серьезными осложнениями: сердечная недостаточность, отеки, аритмия, эмболия тромбами, внезапная смерть.
Механизм развития патологии
Под воздействием определенных факторов снижается количество функционирующих кардиомиоцитов. Это приводит к растягиванию камер сердца, ухудшению насосной функции сердечной мышцы.
В процессе развития патологии в кардиальных структурах наблюдается скопление крови, — она полностью не выбрасывается из-за растяжения стенок и снижения сократительной способности сердца. Возникают застойные процессы, что в дальнейшем провоцируют тромбоэмболический синдром. Сердце увеличивается в размерах, слой функционирующих клеток становится тоньше и мышечная ткань растягивается, снижается сердечный выброс. Это отражается на функционировании всех систем организма. Развивается сердечная недостаточность, ишемия, дистрофия тканей и другие осложнения. Без лечения патология заканчивается внезапным летальным исходом.
Заметьте, что с момента развития первых клинических проявлений до необратимых последствий проходит 5-15 лет.Причины расширения камер
Дилатационная кардиомиопатия это многофакторное заболевание. Считается, что повлиять на развитие данной патологии может отягощенная наследственность. Примерно в 25 % случаев болезнь является следствием генетических отклонений или врожденных пороков сердца (первичная кардиомиопатия дилатационная).
Вторичная дилатационная кардиомиопатия развивается на фоне других патологий: приобретенные пороки сердца (спровоцированные вредными привычками, перенесенными заболеваниями) сосудистые болезни, токсическое воздействие (медикаменты, наркотики, алкоголь), расстройства метаболизма (вследствие голодания, анорексии, плохого питания), аутоиммунные патологии, инфекционные поражения организма.
Симптомы
Кардиомиопатия дилатационная развивается медленно, симптоматика может не беспокоить годами. Реже патология манифестирует подостро, например, после перенесенных инфекций. Патогномоничными симптомами заболевания являются сердечная недостаточность, аритмия, нарушение проводимости, закупорка сосудов тромбами.
Нарушение работы левого желудочка провоцирует одышку при небольшой нагрузке, усталость из-за повышенного диастолического давления в нем и пониженного сердечного выброса. Дисфункция правого желудочка становится причиной отечности тканей и набухания шейных вен.
Также клиника включает:
- приступы стенокардии;
- цианоз носогубного треугольника, общую бледность лица;
- усиленную потливость;
- синкопальные состояния;
- головную боль;
- эмоциональную лабильность.
Диагностика
Чтобы поставить ДКМП диагноз (дилатационная кардиомиопатия), врачам могут понадобиться результаты следующих исследований:
- Аускультативные данные (выявляется учащенное сердцебиение, ритм галопа, шумы трикуспидальной, митральной недостаточности, учащенное дыхание, хрипы в легких).
- ЭКГ (диагноз ДКМП сопровождается симптомами перегрузки и увеличения объема левого желудочка и предсердия, нарушениями проводимости, мерцательной аритмией, БЛНГ, атриовентрикулярной блокадой).
- Холтер-мониторинг (выявляются аритмии, проводится оценка динамику процессов реполяризации).
- ЭхоКГ (помогает исключить некоторые потенциальные причины сердечной недостаточности).
- Рентген (есть симптомы легочной гипертензии, увеличение размеров сердца, перикардит.
Лечение
Если патология является вторичной, то требуется этиотропное лечение, т. е. устранение первопричины заболевания. Также терапия должна быть направлена на остановку прогрессирования патологического процесса. Необходима коррекция проявлений сердечной недостаточности, аритмии, повышенной свертываемости крови.
Лечение дилатационной кардиомиопатии зачастую консервативное и включает:
- Антиаритмические средства.
- Препараты, снижающие АД (мочегонные, ингибиторы АПФ, бета-блокаторы).
- Венозные вазодилататоры (для уменьшения притока крови к правым отделам сердца).
- Противотромбические средства для нормализации показателей текучести крови и профилактики тромообразования.
- Статины (для понижения холестерина и профилактики атеросклероза).
- Поливитамины.
- Кардиопротекторы.
Шансы и осложнения
Прогноз дилатационной кардиомиопатии зависит от своевременности диагностики и адекватности терапии. При выявлении патологии на ранней стадии шансы на продолжительную полноценную жизнь высокие. Если же игнорировать выраженные проявления болезни, то прогноз неблагоприятный. Без медицинской помощи риск летального исхода в ближайшие пару лет возрастает до 70 %.
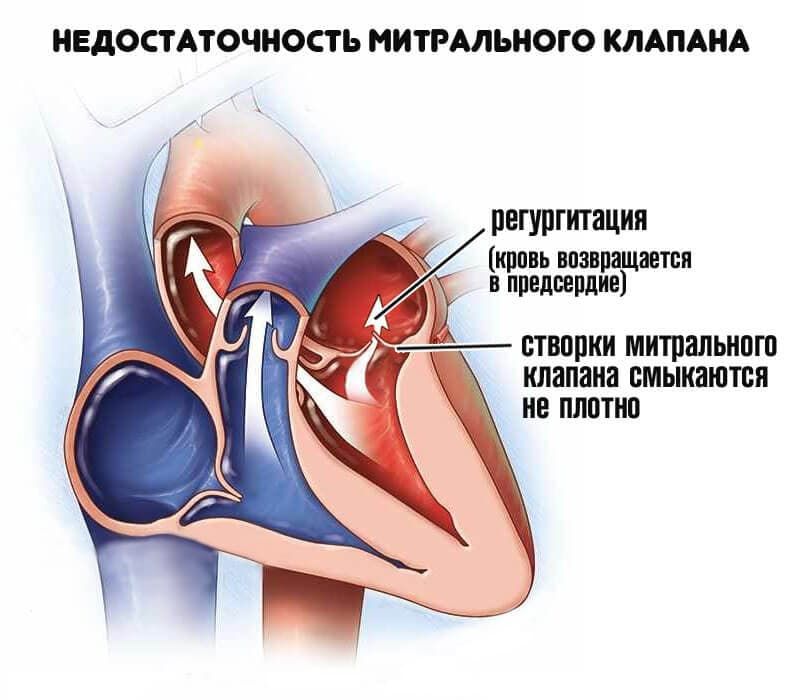
Митральная недостаточность - несостоятельность клапана, при которой возникает обратное движение крови из левого желудочка в левое предсердие во время сокращения желудочков сердца вследствие неполного смыкания створок клапана.
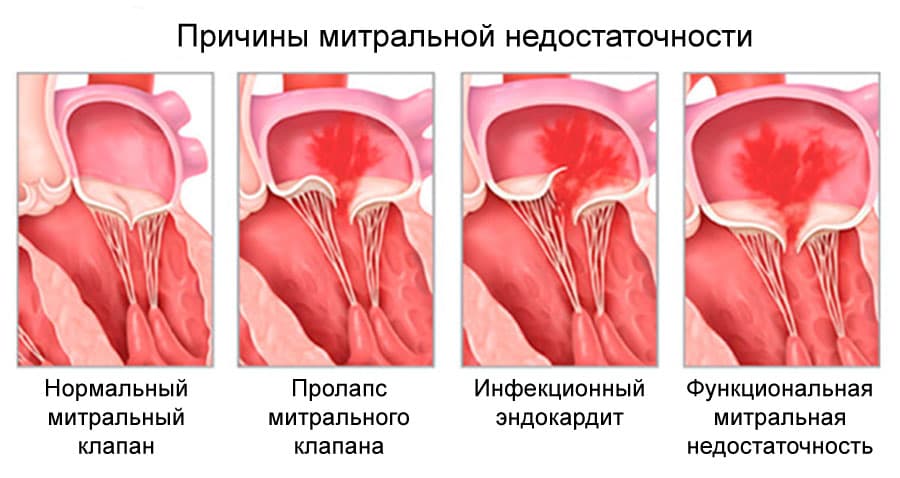
Этиология митральной недостаточности:
- Врожденная патология: расщепление клапана, пролапс и другое.
- Ишемическая дисфункция митрального клапана при ИБС.
- Дегенеративные процессы: миксоматозная дегенерация, синдромы Марфана и Элерса - Данло, кальциноз митрального кольца.
- Воспалительные поражения: ревматизм, системная красная волчанка, системная склеродермия, аортоартериит.
- Инфекция: инфекционный эндокардит.
- Травма.
![Митральная недостаточность 2.jpg]()
По течению митральная недостаточность подразделяется на хроническую и острую и соответственно требует разного подхода при определении показаний срочности оперативного вмешательства. Коррекцию хронической митральной недостаточности необходимо провести прежде, чем разовьется декомпенсация левого желудочка, с учетом ЭХОКГ критериев для оценки тяжести митральной регургитации.
Развитие острой митральной недостаточности, рефрактерной к медикаментозной терапии, является показанием к экстренному хирургическому вмешательству.
Проявления клинических симптомов митральной недостаточности обусловлено тяжестью недостаточности митрального клапана и функционального состояния левого желудочка.
Симптомы
Наиболее типичная жалоба – это одышка, которая возникает при умеренной и тяжелой хронической митральной недостаточности и клиника острой левожелудочковой недостаточности при острой митральной недостаточности. Наличие фибрилляции предсердий до операции является независимым предиктором снижения отдаленной выживаемости после операции на митральном клапане по поводу хронической митральной недостаточности.
![Митральная недостаточность.jpg]()
Диагностика митральной недостаточности
Эхокардиография (ЭХОКГ) занимает ведущее место в диагностике недостаточности митрального клапана и определения показаний по тактике ведения больного. При недостаточной информативности трансторакальной ЭХОКГ и уточнения возможности реконструктивной операции на митральном клапане должна быть выполнена чрезпищеводная ЭХОКГ.
ЭХОКГ позволяет определить этиологию митральной недостаточности, ее тяжесть –компенсаторные возможности левого желудочка, наличие осложнений (левожелудочковая недостаточность, легочная гипертензия, правожелудочковая недостаточность), выявить другие пороки сердца.
ЭХОКГ исследование позволяет оценить степень недостаточности митрального клапана по отношению площади потока регургитации к площади левого предсердия:
- Незначительная недостаточность митрального клапана менее 20%
- Умеренная недостаточность 20-40%
- Тяжелая недостаточность 40%
Если ИБС не является причиной митральной недостаточности и нет данных за сопутствующую ИБС показания к операции могут быть определены без катетеризации сердца.
Применение инвазивных методов обследования показано пациентам с ишемической дисфункцией митрального клапана:
Коронароангиография позволяет уточнить наличие стенозирующего поражения коронарных артерий и определить показания к реваскуляризации миокарда в сочетании с хирургической коррекцией митральной недостаточности.
Показания к оперативному лечению митральной недостаточности
Классификация рекомендаций и уровни достоверности в формате АКК/ААС:
- Класс I: Состояния, при которых есть доказательства и/или общее согласие, что процедура или метод лечения является благоприятным, полезным и эффективным.
- Класс II: Состояния, при которых есть противоречивые доказательства и/или расхождение во мнениях о полезности/эффективности процедуры или метода лечения.
- Класс IIА: Вес достоверность/мнение в пользу полезности/эффективности.
- Класс IIБ: Польза/эффективность менее хорошо установлены достоверностью/мнением.
- Класс III: Состояния, при которых есть доказательства и/или общее мнение, что процедура/метод лечения не полезны, не эффективны, а в некоторых случаях могут быть вредны.
Кроме того, уровни достоверности в поддержку рекомендаций изложены следующим образом:
- Уровень достоверности А: Данные получены из многочисленных рандомизированных клинических испытаний.
- Уровень достоверности В: Данные получены из единичных рандомизированных исследований или нерандомизированных испытаний.
- Уровень достоверности С: Только единодушное согласие экспертов, отдельные исследования случаев и стандарты лечения.
Хирургическое лечение недостаточности митрального клапана
1. Пациенты с острой тяжелой митральной недостаточностью (Уровень достоверности: B)
2. Пациенты с хронической тяжелой недостаточностью митрального клапана и СН II, III, IV ФК по NYHA, при отсутствии тяжелой дисфункции ЛЖ (тяжелая дисфункция ЛЖ определяется как фракция выброса меньше 30%) и/или КСР больше 55 мм. (Уровень достоверности: B)
3. Асимптомные пациенты с хронической тяжелой митральной недостаточностью и легкой, умеренной дисфункцией ЛЖ, фракция выброса 30-60% и/или КСР больше или равно 40 мм. (Уровень достоверности: B)
4. Более показана пластика, чем протезирование митрального клапана у большинства пациентов с тяжелой хронической митральной недостаточностью, которым необходима операция, и пациенты должны быть направлены в хирургические центры с большим опытом по восстановлению МК. (Уровень достоверности: C)
КЛАСС IIА
1. Показана пластика МК у асимптомных пациентов с тяжелой хронической митральной недостаточностью и нормальной функцией ЛЖ (фракция выброса больше 60% и КСР меньше 40 мм), у которых вероятность хороших результатов пластики клапана больше 90 %. (Уровень достоверности: B)
2. Показано вмешательство на МК у асимптомных пациентов с тяжелой хронической митральной недостаточностью с нормальной функцией ЛЖ и пароксизмом фибрилляции предсердий. (Уровень достоверности: C)
3. Показано вмешательство на МК у асимптомных пациентов с тяжелой хронической митральной недостаточностью с сохраненной функцией ЛЖ и легочной гипертензией (систолическое давление ЛА больше 50 мм рт.ст. в покое или больше 60 мм рт.ст. при нагрузке). (Уровень достоверности: C)
4. Показано вмешательство на МК у пациентов с тяжелой хронической МР*, развившейся в результате первичной патологии митральных структур, симптомами III-IV ФК по NYHA и тяжелой дисфункцией ЛЖ (фракция выброса мене 30% или КСР больше 55 мм), которым больше подходит восстановление МК. (Уровень достоверности: C)
КЛАСС IIБ
- Возможна пластика митрального клапана у пациентов с хронической тяжелой недостаточностью митрального клапана, вследствие тяжелой дисфункции ЛЖ (фракция выброса менее 30%), у кого, несмотря на оптимальную терапию СН, включая бивентрикулярный кардиостимулятор, присутствуют симптомы III-IV ФК по NYHA. (Уровень достоверности: C)
КЛАСС III
1. Вмешательство на митральный клапан не показано асимптомным пациентам с митральной недостаточностью и нормальной функцией ЛЖ (фракция выброса более 60% и КСР менее 40 мм), у которых есть существенные сомнения о возможности пластики МК. (Уровень достоверности: C)
2. Изолированная операция МК не показана пациентам с легкой или умеренной митральной недостаточностью. (Уровень достоверности: C)
![Лечение митральной недостаточности (4).jpg]()
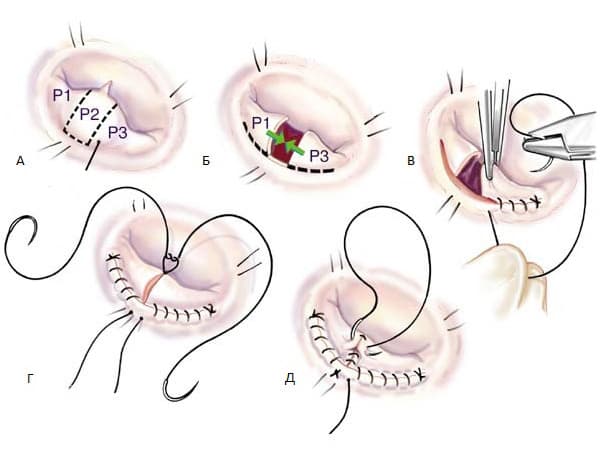
Во многих случаях, тип операции - пластика или протезирование МК важна в выборе времени операции. Хотя тип оперативного вмешательства до операции фактически никогда не определяется, во многих случаях выбор оперативного вмешательства может быть определен заранее. Летальность при плановых операциях по поводу митральной недостаточности после протезирования митрального клапана составляет 2 – 7%, после пластики митрального клапана 1 – 4%. В настоящее время используют три основных метода коррекции митральной недостаточности: пластика клапана, протезирование митрального клапана с частичным или полным сохранением хордального аппарата и протезирование митрального клапана без сохранения хордального аппарата. В большинстве случаев пластика клапана является операцией выбора и должна выполняться всегда, когда это возможно.
![Лечение митральной недостаточности (3).jpg]()
Своевременность оперативного вмешательства позволяет добиться хороших результатов хирургической коррекции пороков сердца, уменьшает степень оперативного риска и улучшает отдаленные результаты хирургического лечения.
Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Читайте также:
- Какие системы организма непосредственно осуществляют соматизацию переживания
- Как открыть свою букмекерскую контору нелегально
- В каком слове правильно выделена буква обозначающая ударный гласный звук форзац наврала ходатайство
- Если гражданин россии привит от коронавируса за границей
- Почему полиции нужна помощь граждан