Химические источники тока на воздушных судах применяются как
Обновлено: 18.05.2024
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. Автономные (переносные) химические источники тока подразделяются на первичные (гальванические элементы) и вторичные (аккумуляторы). Первичные источники после их истощения не заряжаются, а выбрасываются. Не удивительно, что их стоимость значительно ниже, чем у аккумуляторов, которые служат, например, в мобильных телефонах. Однако принцип действия у них один – окислительно-восстановительная химическая реакция, при которой электроны, переходящие от восстановителя к окислителю, и есть электрический ток.
Однако в некоторых опытах лягушачьи мышцы сокращались без всяких видимых причин: ни грозы, ни электрической машины поблизости не было. Оказалось, что это происходит в тех случаях, когда мышца и нерв соединены металлической проволокой, и особенно сильно – если эта проволока составлена из двух разных металлов; сильнее других действовала пара железо-серебро.
Раскрыть природу открытого Гальвани явления удалось итальянскому физику Алессандро Вольта. Вначале он вообще не поверил Гальвани, но, повторив его опыты, убедился в том, что явление действительно существует. Однако опыты с проволокой он объяснил совершенно иначе: электричество возникает при контакте разных металлов, а лягушка – это просто очень чувствительный прибор для измерения и к образованию электричества как такового отношения не имеет. Опытным путем Вольта расположил металлы в ряд таким образом, что чем дальше друг от друга отстоят они в этом ряду, тем более сильный эффект производят. Химики с удивлением обнаружили, что в таком же порядке изменяется и химическая активность металлов. В настоящее время этот ряд называется рядом напряжений или, точнее, рядом электродных потенциалов. В основных чертах он имеет вид Li. Mg. Zn. Fe. Sn. H. Cu. Ag. Au
Введение в электрическую цепь растворов (Вольта назвал их проводниками второго рода в отличие от металлов – проводников первого рода) оказалось решающим в изобретении Вольта. В память о Гальвани, умершем в 1798, Вольта назвал свои элементы гальваническими. Вскоре английский хирург и химик Энтони Карлейль изготовил вольтов столб из 36 последовательно соединенных цинковых кружков и монет в полкроны (а Англии их чеканили тогда из серебра 925 пробы). В первых же опытах с батареей наблюдалось разложение воды с образованием газов.
Знаменитый английский химик Гемфри Дэви изготовил вольтов столб из медных и цинковых пластинок, разделенных водным раствором аммиака. Первая его батарея состояла из 60 таких элементов, а через несколько лет довел их число до тысячи. С помощью этой батареи он провел знаменитые опыты по выделению новых элементов – щелочных и щелочноземельных металлов.
В течение XIX в. трудами физиков и химиков была заложена теория работы гальванических элементов; основная заслуга в этом принадлежит немецкому физикохимику Вальтеру Нернсту. Конструкция элементов также была значительно усовершенствована. Главный итог работы теоретиков таков: в гальваническом элементе происходит прямое превращение химической энергии в электрическую. Для этого в элементе должна протекать окислительно-восстановительная реакция, например, растворение цинка в кислой среде: Zn + 2H + = Zn 2+ + H2. Атомы цинка (восстановители) отдают электроны: Zn – 2e ® Zn 2+ , а ионы водорода (окислители) их принимают: 2H + + 2e ® H2. В гальваническом элементе процессы окисления и восстановления пространственно разделены: водород должен выделяться не на цинке, а на меди. Тогда электроны от цинка к меди будут переходить не непосредственно в растворе (в этом случае они теряются без пользы), а через внешнюю цепь, где могут совершать полезную работу. Именно так работает элемент Вольта.
Ток в элементе снимается с помощью двух электродов. В соответствии с принятой номенклатурой, на одном из них – аноде протекает процесс окисления, а на катоде идет восстановление. Поэтому цинковый электрод гальванического элемента – это анод, а медный – катод (при электролизе солей цинка он выделяется на катоде, так как при этом цинк не окисляется, а восстанавливается: Zn 2+ + 2e ® Zn; аналогично при электролизе с медным анодом медь окисляется: Cu – 2e ® Cu 2+ , так что определение катода и анода остается в силе)
Способность металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла характеризуется его стандартным электродным потенциалом. Ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов (при стандартных условиях концентрации всех ионов равны 1 моль/л, давление всех газов составляет 1 атм.
Чтобы определить стандартный электродный потенциал металла, измеряют ЭДС гальванического элемента, один из электродов которого – исследуемый металл, погруженный в раствор его соли (при концентрации 1 моль/л), а второй электрод – эталонный (его еще называют водородным). Он изготовлен из очень пористой губчатой платины и опущен в раствор кислоты (концентрация ионов H + 1 моль/л); платиновый электрод непрерывно омывает газообразный водород (под давлением 1 атм), который частично растворяется в платине. Таким образом, все электродные потенциалы – не абсолютные, а относительные, измеренные для гальванической пары металл – водород (потенциал стандартного водородного электрода принимают равным нулю). Измеренные в таких условиях потенциалы различных металлов всегда будут постоянными, они занесены во все справочники и приводятся обычно для температуры 25 о С). Электродные потенциалы самых активных металлов, реагирующих с водой, получены косвенным путем.
Электродные потенциалы записывают как потенциалы восстановления ионов металлов. Самый отрицательный потенциал (–3,04 В) – у реакции Li + + e ® Li; один из самых положительных (+1,68 В) – у реакции Au + + e ® Au. Это значит, что ЭДС гальванической пары литий-золото (если бы такая пара могла работать в водной среде) была бы равна 4,72 В; для распространенной пары медь-цинк ЭДС значительно меньше и равна 1,10 В (соответствующие потенциалы металлов равны –0,76 и +0,34 В). Для неводных электролитов можно использовать и щелочные металлы; так устроены, например, литиевые элементы (их применяют, в частности, для питания стимуляторов сердца) – они дают ЭДС до 3,5 В. Конечно, потенциалы для неводных растворов другие.
При работе гальванического элемента, когда через него и через внешнюю цепь идет ток, напряжение на электродах снижается; это снижение по закону Ома зависит от внутреннего сопротивления элемента (обычно оно составляет от 1 до 20 Ом) и от силы тока. Для некоторых элементов это снижение невелико и не превышает 0,1 В, для других может быть значительно большим. Применительно к источникам тока снижение напряжения на электродах при работе элемента называется поляризацией. Она зависит от химической природы и конструкции электродов, от состава и концентрации электролита, плотности тока, температуры. Так называемая химическая поляризация часто наблюдается при выделении на электродах водорода и кислорода. Величина такой поляризации в очень сильной степени зависит от материала электрода. Например, если в элементе Вольта заменить медный электрод на платиновый, то напряжение элемента возрастет почти на 0,5 В. Если же вместо медного электрода взять свинцовый, то напряжение, наоборот, упадет примерно на 0,6 В. Разность между экспериментальным и теоретическим потенциалом электрода для данной концентрации ионов водорода и плотности тока называется перенапряжением водорода на этом электроде. Поляризация играет роль и в процессах электролиза: если бы ее вовсе не было, разряд ионов водорода шел бы уже при очень малом напряжении на электродах, чего не наблюдается.
В элементе Вольта даже при незамкнутой внешней цепи все-таки идет окислительно-восстановительная реакция на границе цинк-кислота (катодами служат примеси в цинке). Поэтому этот источник тока на практике не применяется. Кроме того, выделяющиеся на медном электроде и прилипающие к нему пузырьки водорода сильно мешают работе элемента. На это обстоятельство в 1836 обратил внимание Джон Фредерик Даниель – британский химик и метеоролог (он изобрел также измеритель влажности – гигрометр). В его конструкции цинковый электрод погружен в раствор цинкового купороса (сульфата цинка), а медный – в раствор медного купороса (сульфата меди). В результате на медном электроде водород не выделяется, а идет реакция восстановления ионов меди: Cu 2+ + 2e ® Cu. Чтобы оба электролита не смешивались, Даниель разделил их пористой перегородкой из необожженной глины. Такое устройство впервые обеспечило длительное и равномерное действие гальванического элемента, а его ЭДС (электродвижущая сила) близка к теоретической и равна 1,09 В. За это изобретение Даниель был удостоен высшей награды Королевского общества – золотой медали Копли. Независимо аналогичный элемент был разработан российским ученым Б.С.Якоби. Этот элемент при сравнительной простой конструкции обладал значительной емкостью и в течение нескольких десятилетий применялся как источник питания на телеграфе. И в настоящее время работу химических источников тока объясняют на примере элемента Даниеля.
Иначе решили проблему поляризации катода Грене, Бунзен и Гроув. Грене заменил медный электрод угольным, а к раствору серной кислоты добавил дихромат калия. Дихроматы в кислой среде – очень сильные окислители, поэтому водород на катоде просто окислялся до воды. В элементе Бунзена угольный катод был погружен в концентрированную азотную кислоту, которая находилась в пористом керамическом сосуде, а снаружи был цинковый анод в разбавленной серной кислоте. Именно элементы Бунзена послужили Ч.М.Холлу, впервые получившему алюминий методом электролиза. У Гроува вместо угольного электрода был платиновый, а цинк Гроув амальгамировал. Чтобы цинк не растворялся в кислоте в то время, когда такими элементами не пользуются, цинковый электрод делали подъемным.
Если химический источник тока сделан качественно и не совершает работы (не включен ни в какую электрическую цепь), то напряжение на нем может не меняться буквально веками. Так, электрический звонок, хранящийся в музее физических приборов Кларендонской физической лаборатории в Оксфорде, без всякой подзарядки или смены батареи, исправно (и непрерывно) работает от батареи гальванических элементов уже свыше полутора веков!
Аккумуляторы дают примерно такое же напряжение, как и гальванические элементы. Так, самый распространенный кислотный свинцовый аккумулятор дает около 2 В, щелочной никель-кадмиевый – около 1,3 вольт, а никель-железный – около 1,4 вольт. Такого напряжения вполне достаточно для работы кварцевых часов, но уже лампочка для карманного фонаря гореть от одного аккумулятора не будет. Поэтому, как и гальванические элементы, аккумуляторы для повышения напряжения соединяют в батареи. Для питания диктофона, плейера или фотоаппарата достаточно двух соединенных последовательно аккумуляторов. На автомобилях соединяют последовательно уже шесть свинцовых аккумуляторов; они способны кратковременно давать очень большой ток, необходимый для запуска двигателя. Гальванические элементы и батареи больших токов давать не могут. Аккумуляторы работают также на космических кораблях, в электромобилях и электрокарах, их используют для аварийного освещения.
В 1970 были начаты исследования нового типа аккумуляторов – никель-гидридных, а в 80-е годы появились первые рабочие образцы, в которых ток генерировался в результате реакции 2NiOOH + H2 ® 2Ni(OH)2. При заряде водород снова выделялся. Так как водород для таких аккумуляторов находится под большим давлением, блок с электродами помещают в стальной цилиндр. Эти аккумуляторы запасали на 40% больше энергии (на единицу массы), чем никель-кадмиевые. Из-за высокой стоимости (тысячи долларов каждый) эти аккумуляторы применяли прежде всего там, где особенно важна экономия веса, т.е. в космической технике. В последние годы разработаны миниатюрные металл-гидридные аккумуляторы; в них при заряде катионы водорода в электролите восстанавливаются, атомы водорода диффундируют в металл (обычно используются интерметаллические составы) и образует гидрид. При разряде процесс идет в обратном направлении. Преимущество таких аккумуляторов может оценить каждый владелец мобильного телефона.
О потенциальных возможностях аккумуляторов говорит такой факт. В Западном Берлине, опасаясь отключения электроэнергии властями ГДР (в 1961 году уже была предпринята попытка задушить город блокадой), соорудили огромную аккумуляторную батарею. Эта батарея массой 630 тонн при мощности 17 мегаватт могла в случае необходимости в течение часа, до запуска аварийных электростанций, снабжать многомиллионный город электроэнергией.
В последние десятилетия интенсивные работы ведутся по созданию и усовершенствованию топливных элементов – устройств, вырабатывающих электроэнергию за счет химической реакции между веществами, которые непрерывно подаются к электродам извне. Окислителем чаще всего служит кислород, а топливом может быть, например, водород. На базе таких элементов уже работают опытные электростанции.
Бортовая система электроснабжения летательных аппаратов (бортовая СЭС ЛА) — система электроснабжения, предназначенная для обеспечения бортового электрооборудования летательного аппарата электроэнергией требуемого качества. Системой электроснабжения принято называть совокупность устройств для производства и распределения электроэнергии. Начиная с 20-х годов прошлого века, на самолётах стали использоваться генераторы постоянного тока на 8, затем — на 12, и, наконец, на 27 вольт.
Для питания бортового оборудования и систем ЛА в настоящее время применяется электроэнергия постоянного тока напряжением 27 вольт, переменного однофазного или трёхфазного с нейтралью тока с напряжением 208/115 вольт, частотой 400 Гц, переменного трёхфазного без нейтрали тока напряжением 36 вольт 400 гц. Суммарная мощность генераторов на борту может составлять от 20 кВт для небольших самолётов или вертолётов до 600 и более кВт для тяжёлых ЛА.
В состав бортовой СЭС входят источники тока, аппаратура регулирования, управления и защиты, собственно бортовая сеть с распределительными устройствами, устройствами защиты цепей потребителей, а также устройствами защиты от радиопомех, статического электричества и электромагнитных излучений. Различают первичные и вторичные источники электроэнергии. К первичным источникам относят бортовые электрогенераторы и аккумуляторные батареи. Ко вторичным источникам относят трансформаторы и преобразователи.
Надёжность системы электроснабжения ЛА является одним из основополагающих факторов безопасности полёта. Поэтому предусматривается комплекс мер для надёжности функционирования и повышения живучести бортовой СЭС ЛА. Как правило, применяют основные, резервные и аварийные источники электроэнергии. Основные источники обеспечивают потребности в электроэнергии в нормальных условиях полёта. Резервные источники питают потребители при нехватке мощности основных источников, вызванной отказами в СЭС. Аварийные источники питают только жизненно важные системы ЛА (потребители первой категории), без которых невозможно безопасное завершение полёта.
На электрооборудование летательных аппаратов действует ряд неблагоприятных факторов - вибрации, ускорения, большие перепады температуры и давления, ударные нагрузки, агрессивные среды паров топлива, масел и спецжидкостей, иногда очень едких и токсичных. Конструктивными особенностями агрегатов электрооборудования летательных аппаратов является очень высокое качество изготовления, высокая механическая и электрическая прочность при минимальном весе и габаритах, пожаровзрывобезопасность, относительная простота в эксплуатации, полная взаимозаменяемость однотипных изделий и т. д.
Содержание
Генераторы


По принципу действия авиационные генераторы не отличаются от аналогичных наземных генераторов, но обладают рядом особенностей: малый вес и габариты, большая плотность тока якоря, принудительное воздушное, испарительное или жидкостное охлаждение, высокая частота вращения ротора, применение высококачественных конструкционных материалов. В качестве источников постоянного тока обычно применяют бесконтактные синхронные генераторы и бесколлекторные генераторы различных типов и синхронные генераторы переменного тока. Генераторы устанавливаются на двигателях и вспомогательных силовых установках (ВСУ), при этом частота вращения турбовинтовых двигателей самолётов и вертолётов стабилизирована изменением шага винта, а вот на турбореактивных двигателях частота вращения ротора может меняться в широких пределах и при жёстком механическом приводе на генератор переменного тока частота также существенно изменяется, что часто недопустимо по ТУ потребителей.
Поэтому электрические сети строят по разным принципиальным схемам. Построение сети зависит от назначения ЛА, его конструктивных особенностей и применяемого оборудования. Например, на самолёте Ту-134 в качестве основных источников электроэнергии применяются генераторы постоянного тока на двигателях, а для питания переменным током стабильной частоты 208/115 вольт 400 гц применяются электромашинные преобразователи.
Преобразователи тока

На летательных аппаратах в качестве вторичных источников тока применяются электромашинные преобразователи и статические полупроводниковые преобразователи (инверторы). Электромашинный преобразователь представляет собой агрегат, состоящий из электродвигателя постоянного тока и генератора переменного тока (иногда - двух), механически закреплёнными на одном валу. Принцип действия такого преобразователя основан на двукратном преобразовании электрической энергии в электрических машинах - двигателе и генераторе. Схема стабилизации оборотов (частоты вращения) обычно расположена в коробке управления. Наиболее широко распространены преобразователи серии ПО (однофазные на 115 вольт), ПТ (трёхфазные на 200/115 вольт или 36 вольт) и ПТО (комбинированные). При КПД в пределах 50-60% мощность преобразователя может быть от 125 вА (ПТ-125Ц) до 6 КвА (ПО-6000). Статические преобразователи преобразуют постоянных ток в переменный с помощью управляемых полупроводниковых приборов - транзисторов или тиристоров. Такой преобразователь представляет электронный блок в унифицированной легкосъёмной кассете. Их КПД может достигать 85%.
Привод постоянных оборотов
В качестве основных источников электроэнергии могут применяться и генераторы переменного тока, в этом случае сеть 200/115 в является первичной. Генераторы подключаются к редуктору через привод постоянных оборотов. Различают разные схемы подключения - гидравлические, пневматические, механические. Применение нашла гидростатическая схема дифференциального типа (гидронасос-гидромотор), в которой механическая энергия вращения, отбираемая от вала авиадвигателя, преобразуется в энергию давления рабочего тела - масла. Регулирование частоты вращения осуществляется гидравлическим центробежным автоматом, управляющим производительностью гидронасоса. В случае с турбовинтовыми авиадвигателями и ВСУ генераторы переменного тока работают на постоянной частоте вращения, обусловленной стабильностью оборотов двигателя. Первичная (основная) система переменного тока стабильной частоты применяется, например, на лайнере Ту-154 или вертолёте Ка-27. На этих машинах для получения постоянного тока используются полупроводниковые выпрямительные устройства (ВУ).
Выпрямительные устройства
Выпрямительное устройство представляет собой агрегат, состоящий из трёхфазного понижающего трансформатора, полупроводникового трёхфазного выпрямителя и тиристорной схемы стабилизации при изменении нагрузки. Мощность различных типов ВУ может быть в пределах от 3 до 12 кВт. Для принудительного охлаждения схемы выпрямительное устройство имеет встроенный вентилятор.


Авиационная бортовая никель-кадмиевая аккумуляторная батарея 20НКБН-25-У3. Краской от руки написан номер борта - "45"
Турбогенератор
На летательных аппаратах может применяться смешанная схема электроснабжения, из сетей постоянного тока и сетей переменного тока стабильной или нестабильной частоты, а также дополнительные сети для питания различной сложной аппаратуры (автономные системы электроснабжения). К примеру, генератор переменного тока может работать от пневматической турбины, которая, в свою очередь, работает на отбираемом от компрессора авиадвигателя сжатом воздухе. Такой агрегат называется турбогенератором и применяется, в частности, на самолёте Ан-22.
Бортовые аккумуляторные батареи
На современных ЛА аккумуляторные батареи применяются в качестве аварийных источников электроэнергии, для питания потребителей первой категории, без которых невозможно нормальное завершение полёта. В свою очередь, аккумуляторы могут питать аварийные преобразователи тока (обычно небольшие электромашинные или статические) для потребителей первой категории, требующих питания переменным током. В течение всего полёта аккумуляторы работают в буфере с генераторами постоянного тока (где это предусмотрено). Используют свинцовые (12САМ-28, 12САМ-23, 12САМ-55), серебряно-цинковые (15СЦС-45) и никель-кадмиевые (20НКБН-25, 20НКБН-40, 20НКБН-28, 20KSX-27) аккумуляторные батареи. Продолжительность полёта при питании БЭС только от АКБ может сильно варьироваться на разных типах авиатехники: от нескольких часов (например, Ту-16, от АКБ летит до полутора часов) до нескольких минут (Ту-22М3, не более 12-15 минут).
Наземные источники электроэнергии


В настоящее время применяются при подготовках, различных профилактических и ремонтных работах наземные источники электроэнергии - аэродромные подвижные агрегаты (на автомобильном шасси) типа АПА-4, АПА-5Д, АПА-50М, АПА-80; аэродромные электромашинные генераторы-преобразователи АЭМГ-50М и АЭМГ-60/30М. В меньшей степени для электропитания применяются универсальные спецавтомобили типа ЭГУ-3, ЭГУ-50/210-131, УПГ-300. На кораблях применяются статические полупроводниковые преобразователи-выпрямители.
Для подключения наземных источников к бортсети ЛА предусмотрены унифицированные разъёмы в нижней части фюзеляжа - по постоянному току типа ШРАП-500, по переменному току ШРАП-200 или ШРАП-400-3Ф, соответствующие международным стандартам.
Распределительные сети



Бортовая электрическая сеть (БЭС) представляет собой сложную систему каналов передачи электроэнергии от источников к приёмникам и состоит из шин, электропроводки, распределительных устройств, коммутационной и защитной аппаратуры. Сети условно делятся на централизованные, децентрализованные и смешанные. В централизованной сети электроэнергия подводится вначале к шинам центральных распределительных устройств (ЦРУ), а затем к периферийным распределительным устройствам (РУ) — распределительным панелям (РП), распределительным коробкам (РК) и распределительным щиткам (РЩ), для питания всего бортового оборудования ЛА. В децентрализованной БЭС ЦРУ отсутствуют в принципе и распределение электроэнергии производится сразу по РК и РП потребителей. Также существует БЭС смешанного типа, имеющая признаки централизованной и децентрализованной сети. Для повышения надёжности применяется деление бортсети на, например, сеть постоянного тока левая и правая, или сеть первого, второго или третьего генераторов.
Сети могут питаться от параллельно (на общую нагрузку) работающих генераторов, при этом отказ одного, к примеру, генератора не приводит к обесточиванию сети. Применяется также перекрёстное питание — сеть №1 питается от генератора №1 (левый двигатель) и №3 (правый двигатель). В свою очередь, сеть №2 питается от генератора №2 (левый двигатель) и №4 (правый двигатель). Если принять, что мощности одного генератора достаточно для питания всех потребителей этой сети, тогда получается, что в случае отказа одного двигателя (любого) и, соответственно, остановки двух генераторов — это никак не отразится на электроснабжении самолётных систем.
В случае отказа генератора (генераторов) сеть автоматически (или вручную) подключится к соседней исправной сети. В случае неисправности в самой сети, например, коротком замыкании, сеть остаётся обесточенной, но часть потребителей этой сети (при условии их исправности) могут быть переключены на питание от другой сети (переключаемые шины). Небольшая часть БЭС, к которой подключены потребители первой категории, питается от аккумуляторной шины напрямую в течение всего полёта. Часть оборудования подключается к шинам двойного питания, которые в нормальном режиме работают от генераторов, но в случае аварии автоматически подключаются к аккумуляторной шине. Такая сложная система коммутации сетей преследует только одну цель — максимальное повышение живучести электропитания ЛА при разнообразных отказах и повреждениях. На более современных летательных аппаратах применяется автоматический контроль параметров работы генераторов и элементов бортсети цифровыми устройствами.
На больших самолётах количество РК, РП и РУ может достигать нескольких десятков (более сотни), а общая длина проводки — сотен (и даже тысяч) километров. При этом все без исключения потребители имеют защиту от токовых перегрузок и КЗ — автоматы защиты сети (АЗС, АЗР), плавкие предохранители различных типов и силы тока — от 0,5 до 900 ампер. Как правило, вся коммутационная и защитная аппаратура компактно сосредотачивается в распределительных устройствах, для удобства обслуживания и монтажа.
Обслуживание
Электрооборудование ЛА обслуживают специалисты АО (в гражданской авиации специальности АО и РЭО совмещены). На тяжёлых машинах, в связи с большим объёмом работ, по АО проводится разделение на электрооборудование (ЭО) и остальные специальности.
Химические источники тока — это устройства и приборы которые в процессе химической окислительно-восстановительной реакции выделяют напряжение. Также они называются электрохимическими, гальваническими элементами. Основной принцип действия их основан на взаимодействии химических реагентов которые вступая, в реакцию друг с другом вырабатывают электроэнергию, в виде постоянного тока. Этот процесс происходит без механического или теплового воздействия, что является основными факторами играющими превосходящую роль среди других генераторов постоянного напряжения. Химические источники тока, сокращённо ХИТ, уже давно нашли применение не только в быту, но и на производстве.
Немного истории создания ХИТ
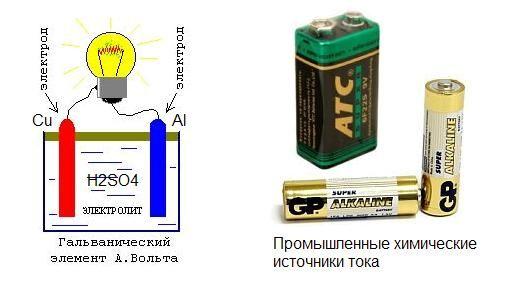
Ещё в восемнадцатом веке итальянский учёный Луиджи Гальвани придумал простейший элемент который химическим способом выделял электрический ток. Однако он был не только учёным, но и физиком, врачом, физиологом. Он интересовался и проводил опыты которые были направлены на изучение реакции животных на внешние раздражители. Как и всё гениальное первый химический источник энергии был получен Луиджи абсолютно случайно, во время многочисленных экспериментов над лягушками. После присоединения двух пластин из металла к лягушачьей мышце на лапке, было замечено мускульное сокращение. Гальвани посчитал это нервной реакцией на внешний раздражитель и изложил это в результатах своих исследований, попавших в руки другого великого учёного Алессандро Вольта. Он и выложил свою теорию о возникновении напряжения в результате химической реакции, возникшей между двумя металлическими пластинами в среде мускульной ткани лягушки.
Первый химический источник электрического тока представлял собой емкость с соляным составом, в который было погружено две пластины из разных материалов. Одна из меди, другая из цинка. Именно это устройство в будущем, а конкретнее во второй половине девятнадцатого века, было применено при изобретении и создании марганцево-цинкового элемента внутри которого был тот же солевой электролит.
Принцип действия
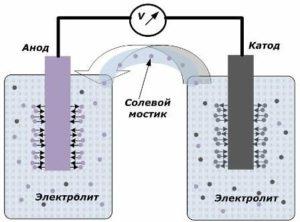
Устройства вырабатывающее электрический ток содержит два электрода, которые помещаются между электролитом. Именно на их границе соприкосновения и появляется небольшой потенциал. Один из них называют катодом, а другой анодом. Все эти элементы вместе образуют электрохимическую систему.
Во время возникновения окислительно-восстановительной реакции между электродами один элемент отдаёт мельчайшие частицы электроны другому. Поэтому она и не может происходить вечно, а со временем просто теряются свойства каждого элемента этой цепи.
Электроды могут быть представлены в виде пластин или решёток из металла. После погружения их в среду с электролитом меду их выводами возникает разность потенциалов, которая именуется напряжением разомкнутой цепи. Даже при удалении хотя бы одного из электродов с электролита процесс генерации напряжения прекращается.
Состав электрохимических систем
В качестве электролита используются следующие химические вещества:
- Водные растворы на основе щелочей, кислот, солей и т. д.;
- Растворы с ионной проводимостью на неводной основе, которые получены при растворении солей в неорганических или органических растворителях;
- Твердые соединения, содержащие ионную решетку, где один из ионов является подвижным;
- Матричные электролиты. Это особый вид жидких растворов и расплавов, которые находятся в порах твёрдого непроводящего элемента — электроносителя;
- Расплавы солей;
- Ионообменные электролиты с униполярной системой проводимости. Твёрдые тела с фиксированной ионогенной группой одного знака.
Классификация гальванических элементов и их подбор
Генераторы электрического тока получающегося во время химической реакции разделяются по:
- Размерам;
- Конструктивным особенностям;
- Способу и реагенту, за счёт которого, и получается электроэнергия.
Все элементы вырабатывающее ток во время химической реакции делятся на:
- Заряжаемые, которые в процессе эксплуатации могут неоднократно заряжаться от источника постоянного тока, они называются аккумуляторами;
- Не заряжаемые, то есть источники одноразового использования которые после завершения химической реакции просто приходят в негодность и должны быть утилизированы. Попросту это гальванический элемент или батарейка.
Для того чтобы подобрать источник электроэнергии, основанный на химической реакции, нужно понимать его характеристики, к которым относятся:
- Напряжение между анодом и катодом при разомкнутой цепи. Этот показатель чаще всего зависит от выбранной электрохимической системы, а также концентрации и вылечены всех составляющих;
- Мощность источника;
- Показатель силы тока;
- Емкость;
- Электротехнические показатели, то есть количество циклов заряда и разряда;
- Диапазон рабочих температур;
- Срок хранения между тем временем как элемент был создан и до начала его эксплуатации;
- Полный срок службы;
- Прочность, то есть защита корпуса от различных механических повреждений и влияний, а также вибраций;
- Положение работы, некоторые из них работают только в горизонтальных положениях;
- Надёжность;
- Простота в эксплуатации и обслуживании. В идеале отсутствие необходимости малейшего вмешательства в работу в течение всего срока эксплуатации.
При выборе нужной батареи или аккумулятора обязательно нужно учесть его электрические номиналы такие как напряжение и ток, а также ёмкость. Именно она является ключевой для сохранения работоспособности, подключаемого к источнику прибора.
Современные химические источники тока и их применение

Современный быт человека тяжело приставить без этих мобильных генераторов энергии, с которыми он сталкивается в течение всей жизни, начиная с детских игрушек и заканчивая, допустим, автомобилем.
Сферы применения различных батареек и аккумуляторов настолько разнообразны что перечислить их очень сложно. Работа любого мобильного телефона, компьютера, ноутбука, часов, пульта дистанционного управления была бы невозможна без этого переносного и очень компактного устройства для создания стабильного электрического заряда.
В медицине широко используются источники химической энергии при создании любого аппарата, помогающего человеку полноценно жить. Например, для слуховых аппаратов и электрокардиостимуляторов которые могут работать только от переносных источников напряжения, чтобы не сковывать человека проводами.
В производстве применяются целые системы аккумуляторных батарей для обеспечения напряжением цепей отключения и защит в случае пропадания входящего высокого напряжения на подстанциях. И также широко применяется это питание во всех транспортных средствах, военной и космической технике.
Одним из видов распространённых батарей являются литиевые источники электрического тока, так как именно этот элемент обладает высоким показателем удельной энергии. Дело в том что только этот химический элемент, оказывается, обладает сильным отрицательным потенциалом среди всех известных и изученных человеком веществ. Литий-ионные батареи выделяются среди всех остальных элементов питания по величине вырабатываемой энергии и низким габаритам, что позволяет применять их в самых компактных и мелких электронных устройствах.
Способы утилизации химических источников энергии

Проблема утилизации разных по габаритах химических источников напряжения является экологической проблемой всей планеты. Современные источники содержат в себе до тридцати химических элементов которые могут нанесите ощутимый вред природным ресурсам, поэтому для их утилизации разработаны целые программы и построены специализированные цеха по переработке. Некоторые методы позволяют не только качественно перерабатывать эти вредные вещества, но и возвращать в производство, тем самым защитив окружающую среду. В целях извлечения цветных металлов из батарей и аккумуляторов в настоящий момент разработаны и применены в цивилизованных странах, следящих и заботящихся об окружающей среде, целые пирометаллургические и гидрометаллургические комплексы. Самый же распространённый способ утилизации отработанных химических источников тока является метод, работающий на соединении этих процессов. Главным его достоинством считается высокая степень извлечения с минимальным количеством отходов.
Этот метод пирометаллургической, гидрометаллургической и механической переработки включает в себя восемь основных стадий:
- Измельчение;
- Магнитная сепарация;
- Обжиг;
- Дополнительное измельчение;
- Выделение крупных и мелких элементов с помощью грохочения;
- Водное очищение и выщелачивание;
- Сернокислотное выщелачивание;
- Электролиз.
Организация правильного сбора и утилизации ХИТ позволяет максимально уменьшить негативное влияние как на окружающую природу, так и на здоровье самого человека.
Химические источники тока сегодня актуальны, хотя и были изобретены более 2 веков назад. В настоящее время более современные варианты устройств практически вытеснили свинцовые аккумуляторы. Наука пытается создать менее опасные типы химических источников тока для окружающей среды, но с большей эффективностью работы, которая будет еще и долгосрочной. Ведется поиск путей достижения данной цели, которые еще и будут менее затратными, чтобы сделать устройство максимально доступным.
Что такое химические источники тока
Химический источник электрического тока — это устройство, благодаря конструкции которого в результате протекания окислительно-восстановительной реакции происходят выработка и подача постоянного электрического тока.

Литий-ионные источники тока — прогресс современности среди химических источников тока
К сведению! Чисто внешне устройства могут быть разными. Первые представляли собой две емкости, между которыми формировали металлический мостик. Теперь это достаточно портативные конструкции, которые могут иметь самые маленькие размеры и формы.
Зачем нужны
Химические источники электрической энергии нужны, чтобы приводить в действие портативные приборы, которые могут работать не от сети. Некоторые типы источников могут длительное время подпитывать весь механизм, приводя его в действие.
Благодаря открытию данных элементов стало возможным развитие таких отраслей, как автомобилестроение, космонавтика, а также сферы приборов бытового использования. Возможности человечества значительно расширились. Теперь не обязательно подключаться к электросети при необходимости использования некоторого устройства, которое требует наличия электрического тока.
Любой ученый знает, что химические источники тока очень важны для человечества. Но и простой пользователь сразу же оценит важность таких приспособлений, если лишится возможности пользоваться, например, телефоном, плеером. Кроме этого, такие варианты относительно портативные и могут обеспечить небольшой объект электрическим током.
Классификация
Самые распространенные виды — гальванические элементы и аккумуляторы. С ними знаком практически каждый. Но классификация таких приспособлений более широкая и предполагает еще и существование топливных элементов.
Гальванические элементы
Гальванический элемент получил свое название в честь ученого Гальвано, который и открыл чудесную возможность получения электрического тока посредством создания простой конструкции из электролита и электродов. Они считаются первыми прототипами современных устройств для получения электроэнергии благодаря химическим реакциям.
Обратите внимание! В настоящее время это приспособление имеет более компактный и безопасный для использования вид, это обычная батарейка. Особенность работы такого устройства заключается в том, что использование его одноразовое. После окончательного разложения электролита на вещества, повторно зарядить их для следующих реакций невозможно.
Электрические аккумуляторы
Электрический аккумулятор — это более универсальный вариант устройства, который можно заряжать несколько раз после потери заряда электролита. Такая особенность объясняется регенерацией веществ, которые образуют электролит.

Устройство аккумулятора
В данном случае зарядка производится от постороннего (внешнего) источника тока. Часто с такой потребностью в восстановлении реагента в аккумуляторах сталкиваются автомобилисты, производя зарядку аккумулятора.
Топливные элементы
Электрохимический топливный элемент является перспективным источником, который достаточно важен для создания комфортных и в некоторых ситуациях жизненно необходимых условий существования.

Тепловой химический источник
Особенность работы такого элемента заключается в следующем. К электродам каждый раз поступает определенная порция электролита, которая после разрядки выводится из конструкции. Например, резервный генератор тока благодаря такому принципу работы может производить электроэнергию в течение 10-15 лет.
Обратите внимание! После истечения срока эксплуатацию можно продлить, если восстановить питание.
Принцип работы
Химический источник, который вырабатывает постоянный ток, имеет определенный принцип работы. Алгоритм выработки электроэнергии посредством протекания химических реакций между некоторыми веществами достаточно прост для понимания, разобраться с этим сможет человек, далекий от химии или физики.
Важно! Из-за использования достаточно агрессивных типов веществ, которые входят в состав таких источников, самостоятельно вскрывать конструкции запрещено. Это может нанести вред здоровью и жизни. Дополнительно требуется определенная утилизация.
Между окислителем и восстановителем (электролитом) протекает окислительно-восстановительная реакция. В результате выделяются электроны, которые начинают последовательно двигаться в определенном направлении. Именно благодаря выделенной в результате химреакции энергии и происходит движение элементарных заряженных частиц.
Так и получается электрический ток, который нужно уметь еще и добыть. Если не создать нужные условия для выхода электронов на внешнюю цепь, то вещество будет выделять только тепло. Чтобы это сделать, нужно подготовить два электрода: анод (где происходит окисление) и катод (восстанавливает вещество).
Величина электроэнергии, которая получается в результате протекания окислительно-восстановительной реакции, зависит от таких факторов:
- объем и концентрация электролита;
- материал, из которого изготовлены электроды;
- конструкция внешней электрической цепи.
Есть несколько вариантов наиболее эффективных и применяемых электролитов с определенной концентрацией и массой.
Где применяются
Кажется, что вырабатываемый ток в результате химической энергии имеет минимальные показатели и может применяться только для изготовления обычных батареек в плеер или часы. Но это не так. Электроэнергия, полученная таким образом, используется в таких сферах:
Благодаря своей конструкции и принципу работы подобные устройства являются универсальными и могут применяться во многих сферах и отраслях.
Обратите внимание! Самой популярной в настоящее время является химическая батарея, которая используется в быту и производствах, подпитывая разнообразные приборы и устройства. Также в повседневной жизни используются аккумуляторы для электроники и автомобилей.
Электроэнергия — это жизненно необходимый ресурс для современного человечества. Получить электричество можно благодаря определенным источникам тока, но самыми популярными и удобными являются именно химические. Дополнительно они считаются весьма безопасными в экологическом плане для использования, если правильно их утилизировать.
Читайте также:
- Дисциплинарное взыскание увольнение решение суда
- Как дозвониться в люберецкий городской суд
- Как получить исполнительный лист по решению суда по гражданскому делу в электронном виде
- По ходатайству родителей усыновителей попечителя суд может ограничить или лишить несовершеннолетнего
- Какие предложения концепции по переустройству судебной системы оказались не реализованы



