Протокол получения образцов буккального эпителия образец
Обновлено: 15.05.2024
Стандартный анализ проводится с помощью стерильных зондов с обратной внутренней поверхности щеки (защечные мазки). Стандартный способ собирает наиболее достаточный биологический материал для проведения анализа ДНК. Процедура совершенно безболезненна и занимает всего несколько минут. Наиболее информативным является анализ ДНК из стандартного мазка (защечный или буккальный мазок). Современные достижения науки позволили сделать максимально простым и комфортным получения биологического материала для ДНК исследований. Нестандартными образцами ДНК являются: слюна, волосы, ногти, окурки сигарет, зубные щетки и т.д., с которыми контактировал испытуемый.
ПРАВИЛА СБОРА И ХРАНЕНИЯ НЕСТАНДАРТНЫХ ОБРАЗЦОВ:
ЖЕВАТЕЛЬНАЯ РЕЗИНКА
Для получения образца человек должен жевать резинку не менее 10 минут, после чего резинку нужно сплюнуть в бумажный конверт. Внимание! Не допускается касаться образца руками, а также использовать полиэтиленовые пакеты для хранения! Конверт с образцом необходимо хранить в морозильной камере при температуре -18 градусов. В любом случае желательно обеспечить доставку образца в лабораторию в кратчайшие сроки. Транспортировка образцов буккального эпителия на жевательной резинке осуществляется в бумажном конверте при температуре окружающей среды.
ОБРАЗЦЫ НОГТЕЙ
Для взятия образцов данного вида нужно состричь ногти. Рекомендуемое количество для исследования 5-6 шт. От новорожденного ребёнка собираются ногти со всех ручек и ножек. Предварительно следует тщательно вымыть пальцы с применением щетки для полного удаления возможных под ногтевых загрязнений. Хранить и транспортировать образцы ногтей следует в бумажных конвертах.
ЗУБНАЯ ЩЁТКА
Зубная щетка должна использоваться продолжительное время одним человеков. Перед отправкой щетки в лабораторию — не мойте ее под горячей водой и какими-либо моющими средствами. Просушите в течение 1,5 часов, избегая прямых солнечных лучей и держите образец вдали от любых нагревательных приборов. Хранить и транспортировать щетку следует в бумажном конверте.
УШНАЯ СЕРА
Ушную серу необходимо собрать косметической ватной палочкой из новой упаковки. Минимум необходимо 2-3 ватные палочки. ВАЖНО! Для сбора ушной серы используйте только 1 конец ватной палочки, второй ватный конец отрежьте. Хранить и транспортировать образец следует в бумажном конверте.
ОКУРОК
Для исследования рекомендуется предоставить 1-2 окурка. Важно! Собирать образцы необходимо пинцетом, либо в перчатках. Хранить и транспортировать образец следует в бумажном конверте.
СУХИЕ ПЯТНА КРОВИ НА БУМАЖНОМ ФИЛЬТРЕ ИЛИ МАРЛЕ
Для получения данных образцов проводится забор крови (венозной или капиллярной) на бумажный фильтр или марлевую салфетку. Диаметр каждого пятна крови должен составлять не менее 1 см. Далее проводится высушивание полученных образцов в условиях комнатной температуры. Использование при высушивании нагревательных приборов и яркого света недопустимо. Хранить и транспортировать полученные образцы следует строго в бумажных конвертах (для предотвращения загнивания) при комнатной температуре в условиях пониженной влажности. Для предотвращения возможного взаимного загрязнения образцов каждый образец следует хранить и транспортировать в отдельном конверте. При соблюдении условий хранения образцы сухой крови остаются пригодными для проведения исследования на протяжении нескольких лет.
СЛЕДЫ СПЕРМЫ
В качестве образцов для анализа могут быть использованы сухие следы спермы на одежде, марле с размером пятна не менее 1 см в диаметре или сперма в медицинском контейнеры. Крайне желательно, чтобы предоставленный образец содержал только биологический материал мужчины, а не смесь мужских и женских клеток. В любом случае образцы должны быть доставлены в лабораторию в кратчайший срок. Возможно предоставление спермы на зонды для забора буккального эпителия, с предварительной сушкой без воздействия света и нагревательных приборов. Каждый зонд упаковывается в отдельный чистый и сухой конверт из бумаги.
ОБРАЗЦЫ ВОЛОС
Для отцовства и других видов родства необходимо предоставить волосы с луковицами. В любом случае необходимо не менее 10 волос от каждого исследуемого лица. Лаборатория не гарантирует получение результата при предоставлении окрашенных/осветленных волос или волос после химической завивки. Срезанные волосы для исследования не подходят!
Введение. В связи с возрастающими объёмами поступающих в окружающую среду токсичных веществ, в том числе генотоксикантов, возникает необходимость проведения исследований по оценке их воздействия на людей, проживающих на территориях с высокими уровнями загрязнителей, а также лиц, работающих во вредных условиях. Для определения реального генетического риска проводят эпидемиологические исследования, в ходе которых оценивают повреждения наследственных структур в клетках человека в основном в лимфоцитах периферической крови и буккальных эпителиоцитах.
Материал и методы. Материалом являлись образцы буккального эпителия. В исследовании принимали участие 69 человек: 28 – в контрольной группе и 41 – в группе лиц, контактирующих с пестицидами. При цитоморфологическом анализе учитывали показатели: цитогенетические, пролиферации клеток, ранней и поздней деструкции ядер.
Результаты. Частота встречаемости клеток с микроядрами и протрузиями у лиц, контактирующих с пестицидами при осуществлении их профессиональной деятельности, была повышена в 2,2 раза, частота клеток с атипичными ядрами – в 2,5 раза (различия в цитогенетических показателях между группами были статистически незначимы). Выявлены достоверные изменения показателя пролиферации – частоты клеток с двумя ядрами (1,6 раза), а также показателей деструкции – кариорексиса (в 4,5 раза чаще у некурящих лиц и в 8,2 раза у курящих, работающих с пестицидами) и кариолизиса (в 3,4 раза была повышена частота клеток с начальным кариолизисом и в 3,2 раза с полным кариолизисом). Показано превышение индекса накопления цитогенетических повреждений в 4 раза.
Заключение. Полученные данные свидетельствуют о повышенном риске возникновения повреждений генетического аппарата клеток у лиц, профессиональная деятельность которых связана с тестированием и применением пестицидов.
Ключевые слова
Об авторах
Scopus Author ID: 6603049459
Scopus Author ID: 57191422037
Scopus Author ID: 6505801582
Scopus Author ID: 6602245454
Список литературы
1. Юрченко В.В., Подольная М.А., Ингель Ф.И., Кривцова Е.К., Беляева Н.Н., Недачин А.Е. и др. Микроядерный тест на буккальных эпителиоцитах: монография. В кн. Ю.А. Рахманин, Л.П. Сычева, ред. Полиорганный микроядерный тест в эколого-гигиенических исследованиях. М.: Гениус; 2007: 220-67.
2. Сычева Л. П. Биологическое значение, критерии определения и пределы варьирования полного спектра кариологических показателей при оценке цитогенетического статуса человека. Медицинская генетика. 2007; 6(11): 3-11.
3. Мейер А.В., Дружинин В.Г., Ларионов А.В., Толочко Т.А. Генотоксические и цитотоксические эффекты в буккальных эпителиоцитах детей, проживающих в экологически различающихся районах Кузбасса. Цитология. 2010; 52(4): 305-9.
5. Корсаков А.В., Трошин В.П., Михалев В.П., Жилин А.В., Жилина О.В., Воробьёва Д.А. и др. Влияние комплекса техногенных факторов среды обитания на частоту цитогенетических нарушений в буккальном эпителии детей младшего школьного возраста. Вестник Московского университета. Серия 23. Антропология. 2012; 1: 110-8.
6. Волкова А.Т., Целоусова О.С., Потапова И.А. Цитогенетический мониторинг риска воздействия окружающей среды на здоровье жителей Республики Башкортостан. Анализ риска здоровью. 2014; 3: 56-60.
7. Ингель Ф.И., Юрченко В.В., Кривцова Е.К., Юрцева Н.А., Легостаева Т.Б. Цитомный анализ эпителия слизистой оболочки щеки в комплексном генетико-гигиеническом обследовании детей в промышленном городе. Гигиена и санитария. 2016; 95(10): 969-73.
8. Castañeda-Yslas D.J., Arellano-García M.E., García-Zarate M.A., Ruíz-Ruíz B., Zavala-Cerna M.G., Torres-Bugarí O. Biomonitoring with micronuclei test in buccal cells of female farmers and children exposed to pesticides of Maneadero Agricultural Valley, Baja California, Mexico. J Toxicol. 2016; Article ID 7934257
10. Remor A.P., Totti C.C., Moreira D.A., Dutra G.P., Heuser V.D., Boeira J.M. Occupational exposure of farm workers to pesticides: biochemical parameters and evaluation of genotoxicity. Environ. Int. 2009; 35(2): 273-8.
11. Perumalla Venkata R., Rahman M.F., Mahboob M., Indu Kumari S., Chinde S., Bhanuramya M. et al. Assessment of genotoxicity in female agricultural workers exposed to pesticides. Biomarkers. 2017; 22(5): 446-54.
12. Hazarika R., Deka P. Assessment of DNA damage in agricultural workers exposed to mixture of pesticides in Assam (India). Nat Environ Poll Technology. 2017; 16(4): 1081-6.
13. Ali T., Ismail M., Asad F., Ashraf A., Waheed U., Khan Q.M. Pesticide genotoxicity in cotton picking women in Pakistan evaluated using comet assay. Drug Chem Toxicol. 2018; 41(2): 213-20.
14. Kahl V., Dhillon V., Fenech M., de Souza M., da Silva F., Marroni N. et al. Occupational exposure to pesticides in tobacco fields: the integrated evaluation of nutritional intake and susceptibility on genomic and epigenetic instability. Oxid Med Cell Longev. 2018; 2018: 1-13.
15. Ahmadi N., Mandegary A., Jamshidzadeh A., Mohammadi-Sardoo M., Mohammadi-Sardo M., Salari E. et al. Hematological abnormality, oxidative stress, and genotoxicity induction in the greenhouse pesticide sprayers; investigating the role of NQO1 gene polymorphism. Toxics. 2018; 6(1): 1-15.
16. Юрченко В.В., Кривцова Е.К., Подольная М.А., Ревазова Ю.А., Зыкова И.Е. Использование микроядерного теста на эпителии слизистой оболочки щеки человека. Гигиена и санитария. 2008; 6: 53-6.
17. Майрапетян А.Х., Залинян Г.Г., Татевосян Н.С., Геворкян А.Л., Парсаданян Г.Г. Микроядерный тест как индикатор эффекта действия хлорорганических пестицидов. Ученые записки ЕГУ. 2008; 2(2)16: 153- 5.
18. Cobanoglu H., Coskun M., Coskun M., Çayir A. Results of buccal micronucleus cytome assay in pesticide-exposed and non-exposed group. Environ Sci Pollut Res Int. 2019; 26(19): 19676-83
Для цитирования:
For citation:
Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Генетическая предрасположенность к онкологическим заболеваниям показывает риски возникновения злокачественных образований. При должной профилактике и лечении возможно предотвратить развитие рака.
Синдром Ли-Фраумени (Li-Fraumeni syndrome) или LFS — это генетическая наследственная патология. Характеризуется наличием мутаций в гене TP53. Передается в следующее поколение по аутосомно-доминантному механизму.
У людей с данным синдромом резко увеличивается вероятность развития различных видов рака в возрасте до 30 лет. Если при наличии нормальной формы гена TP53 шанс онкологии у людей до 30 лет около 1%, то при Ли-Фраумени шанс возрастает до 50%.
По статистике, после постановки синдрома, в течение 30 лет у 57% пациентов развивается злокачественная опухоль. Процессам онкогенеза могут быть подвержены любые органы.
ВЫ НЕ ХОТИТЕ ЕХАТЬ В ОФИС? ЭТО ВОЗМОЖНО!
ВЫЗОВИТЕ КУРЬЕРА, КОТОРЫЙ ЗАБЕРЕТ ВАШИ ОБРАЗЦЫ ДНК.
Симптоматика может проявляться по-разному в зависимости от вида первичной злокачественной опухоли, вызванной синдромом Ли-Фраумени. То есть от органа, который поражен раком. Поэтому только ДНК тест сможет точно диагностировать наличие врожденной или приобретенной патологии.
Главным симптомом считается развитие онкологии в молодом возрасте до 30 лет.
Исследуемые гены

В панель данного исследования включено определение всех патологических форм гена TP53. TP53 является одним из основных генов — супрессоров опухолевого роста. Он предотвращает появление в организме раковых клеток.
Ген кодирует антионкобелок p53, который участвует в крайне важных процессах:
- контроль клеточного цикла — всего периода жизни клетки от момента образования до гибели;
- апоптоз — контролируемая гибель клетки. Основная цель не дать развиться воспалительным реакциям и очистка организма от дефективных клеток;
- репарация ДНК — процесс восстановления поврежденных участков днк. Предотвращает накопление ошибок, приводящих к мутациям генов.
- ангиогенез — процесс реорганизации первичной капиллярной сети. При онкологических заболеваниях ангиогенез протекает интенсивно и бесконтрольно, что приводит к быстрому росту опухоли и распространению метастаз.
Таким образом ген TP53 участвует в контроле клеточной ДНК и обеспечении стабильности генома. Мутированные формы TP53 приводят к образованию патологических белков p53, которые перестают выполнять свои функции. Это приводить к быстрому разрастанию злокачественной опухолевой ткани.
Патология может возникнуть на ранних стадиях эмбриогенеза, сперматогенеза и овогенеза. Но более чем 80% случаев Ли-Фраумени является наследственным заболеванием. Существуют критерии при которых рекомендуется проведение генетического исследования:
- образование саркомы, остеосаркомы, опухоли ЦНС, рака груди, надпочечников в возрасте до 46 лет;
- наличие саркомы остеосаркомы, опухоли ЦНС, рака груди, надпочечников у близких родственников в возрасте до 46 лет;
- появление множественных опухолей, две из которых относятся к данному синдрому. Первая из опухолей образовалась до 46 лет;
- рак груди в возрасте до 36 лет.
Если в семье было диагностировано данное генетическое заболевание, необходимо срочно пройти анализ ДНК.
Лицензии и сертификаты ДНК лаборатории
Как сделать тест ДНК на синдром Ли — Фраумени?
Для генетического анализа необходимы образцы буккального эпителия (ротовой мазок) или венозной крови в количестве 5-10 мл.
Венозная кровь
Для сбора крови необходима вакуумная пробирка с фиолетовой крышкой. Пробирка должна содержать Этилендиаминтетрауксусную кислоту (ЭДТА) типа К1, К2 или К3. Объем крови от 2 мл до 6 мл. Допустимо использование двух пробирок.
Сбор производится у пациента в положении сидя. Ток крови должен осуществляться непосредственно в саму пробирку. После процедуру встряхнуть пробирку 5-6 раз, чтобы кровь перемешалась с ЭДТА.
Буккальный эпителий
Для сдачи защечного эпителия можно воспользоваться услугами специалистов и явиться лично в пункт приема биоматериала. Или осуществить забор в домашних условиях. Для этого нужно:
- ватный зонд — минимум 2 шт., лучше 4 шт.;
- чистый бумажный конверт — 1 шт.;
- пара стерильных одноразовых перчаток — 1 шт.
Можно воспользоваться бесплатным набором, в котором уже есть все необходимое. Закажите его в нашем ДНК центре по телефону. Воспользуйтесь нашей подробной инструкцией или посмотрите видео ролик на сайте (ссылка на страницу как взять образец).
Срок выполнения

Срок выполнения исследования составляет 5 рабочих дней с момента попадания в лабораторию.
День доставки образцов в лабораторию не учитывается, т.к. образцы сначала проходят процедуру регистрации и только потом попадают к генетикам.
Как получить заключение
Результаты анализа ДНК можно получить любым удобным способом:
- в электронном виде на электронную почту;
- лично в руки в пункте сдачи биологического материала;
- доставка через Почту России;
- доставка до двери курьером;
- результат может быть сообщен по телефону при наличии уникального номера заказа. Телефон должен быть авторизован на получение устного результата.
Выбрать способ получения результата можно при оформлении заказа на исследование.
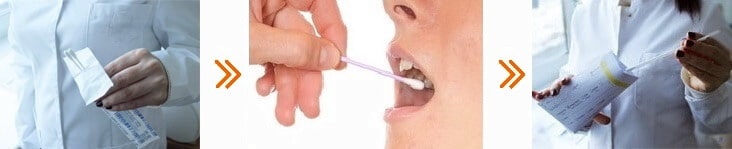
Где сдать сдать ДНК тест на Синдром Ли-Фраумени
Сдать ДНК тест на Синдром Ли-Фраумени
Почему ДНК центр "ДТЛ" лучший в Москве
Как оплатить ДНК тест на Синдром Ли-Фраумени
Для удобства существует несколько вариантов наличной и безналичной оплаты ДНК теста:
- В наших ДНК центрах за наличный расчет или банковской карточкой.
- On-line оплата на сайте нашего ДНК центра.
- В офисах Сбербанка России или любого другого Банка по квитанции (скачать).
- По расчетному счету (для юридических лиц).
При заполнении заявки на проведение ДНК анализа Вы самостоятельно выбираете способ получения результатов генетического теста:
Каждому заказу присваивается уникальный индивидуальный номер. Лаборатория обеспечивает 100% сохранность и конфиденциальность всех полученных от Вас данных.
Что делать, если анализ положительный?
Положительный анализ означает наличие у человека патологической формы гена, который увеличивает риск развития злокачественной опухоли. Не стоит воспринимать это как приговор. Тест ДНК делается для того, чтобы заранее знать о возможности возникновения рака.
Однако, есть вероятность, что рак уже начал развиваться. В этом случае ДНК будет служить одним из методов диагностики на самых ранних стадиях развития заболевания.
Если анализ оказался положительным, необходимо:
- обратиться к врачу-онкологу вместе с результатами ДНК тестирования;
- пройти дополнительные методы диагностики: рентгенография, цитологические исследования, лапароскопия и торакоскопия, биопсия опухолевых тканей.
С помощью этих исследований врач сможет достоверно оценить стадию рака и наличие метастаз. Совместив полученные данные с семейным анамнезом и результатами ДНК анализа, онколог назначить соответствующее лечение.
Обычно используется комплексный подход, совмещающий хирургическое вмешательство с химиотерапией или лучевой терапией. Порядок действий и виды терапии определяет только лечащий врач.
1.Алещенко А.В., Алчинова И.Б. и др. Использование цитогенетического метода исследования буккального эпителия и метода лазерной корреляционной спектрометрии для мониторинга нарушений в организме детей // Цитология. – 2006. – Т.48.№2. – С.170-171.
2. Годовалов А.П., Быкова Л.П., Шипилина Е.Д. Некоторые особенности лабораторной диагностики дисбиотических состояний полости рта // В мире научных открытий. – 2010. – № 4-14. – С. 7-8.
3. Годовалов А.П., Лебединская О.В., Комарова Ю.Р. Роль эпителиоцитов в защите слизистых оболочек дыхательных путей // В мире научных открытий. – 2010. – № 4-14. – С. 9-10.
4. Комарова Ю.Р., Годовалов А.П., Лебединская О.В. Участие эпителиоцитов в местной защите при воспалительных заболеваниях дыхательных путей // Успехи современного естествознания. – 2010. – № 7. – С. 50-51.
5.Магда И.Ю., Темченко В.А., Колий С.Н., Шкорбатов Ю.Г. Клеточный ответ на физические нагрузки во время выполнения спортивных тренировок // Вiсник проблем бiологiЇ i медицини. – 2014 – Вип.1(106). – С.312-315.
6.Хусаинова И.С., Варвулева И.Ю., Кожина Н.А. Оценка цитологических показателей буккального эпителия для диагностики функционального состояния человека // Клиническая лабораторная диагностика. – 1997. – №3. – С.10-11.
7.Чемикосова Т.С., Камалова О.А., Ибрагимова З.Н. Состояние слизистой оболочки рта у лиц, профессионально контактирующих с хлорфеноксигербицидами // Стоматология. – 2004. – №6. – С. 15-16.
8.Шкорбатов Ю. г. Изменение состояния ядра и хроматина человеческих клеток под влиянием гормональных факторов in vitro / Ю. Г. Шкорбатов, В. Г. Шахбазов, О. В. Горенская [идр.] // Цитология и генетика. – 1999. – С. 33, 64-71.
9.Kraemer W. J. Hormonal Responses and Adaptations to Resistance Exercise and Training Sports / W. J. Kraemer, N. A. Ratamess // Med. – 2005. – Vol. 35 (4). – P. 339-361.
11.Shckorbatov Y. The state of chromatin as an integrative indicator of cell stress. In New Developments in Chromatin Research. / Y. Shckorbatov. – New York : Editors: Neil M. Simpson and Valerie J. Stewart, Nova Publishers,2012 .
В настоящее время люди ищут более простые и информативные методы диагностики изменения гомеостаза человека. Одним из современных методов диагностики является исследование клеток буккального эпителия полости рта. Этот объект является одним из не инвазивных тестов, отражающих общее состояние человека. Отклонение биохимических, физико-химических и морфофункциональных показателей, возникающие под воздействием различных экзогенных и эндогенных факторов, приводят к изменениям дифференцировки эпителия, регистрируемым морфологически (размер, характер ядер и гранул, признаки цитолиза), а также изменению заряда на поверхности ядра живой клетки.
Цель исследования – провести сравнительную характеристику методов определения состояния эпителиальных клеток слизистой оболочки полости рта.
При дополнительной оценке скорости пробега ядер буккального эпителия с помощью окуляр-микрометра возможно составить интегральную кривую. При анализе данной кривой возможно проследить зависимость процента электроподвижных ядер от возраста и определить биологический возраст испытуемого [6].
Метод определения конденсации хроматина. При окрашивании ядра клетки орсеином в нем можно четко определить количество гранул гетерохроматина. Этот показатель характеризует морфологический параметр клеточного ядра, связанный с его функциональным состоянием. Для определения изменения степени конденсации хроматина в интерфазных ядрах клеток буккального эпителия клетки окрашивают в 2% растворе орсеина в 45% уксусной кислоте, в течение 30 мин, затем рассматривают при увеличении х600. Определяют среднее количество гранул гетерохроматина на одно ядро, потом подсчитывают среднюю величину содержания гранул гетерохроматина для некоторого количества ядер и величину статистической ошибки. Повышение показателя содержания гранул гетерохроматина свидетельствует о возрастании степени конденсации хроматина.
Как правило, явление конденсации хроматина связано с понижением активности биосинтетических процессов в ядре [10]. Эта реакция является также неспецифическим клеточным ответом на действие повреждающих факторов [11]. Также известно, что содержание стрессовых гормонов в крови возрастает в ответ на физическую нагрузку [9]. Было установлено, что гормоны стресса вызывают увеличение содержания гранул гетерохроматина в концентрациях, близких к физиологическим [8], поэтому в случае утомления, вызванного физическими нагрузками конденсация хроматина может быть связана с воздействием гормонов стресса [5].
Метод лазерной корреляционной спектрометрии (ЛКС). Для измерения размеров наночастиц используется метод динамического рассеяния света (ДРС). Данный метод позволяет определить коэффициент диффузии дисперсных частиц в жидкости путем анализа корреляционной функции флуктуаций интенсивности рассеянного света. Далее, из коэффициента диффузии рассчитывается радиус наночастиц. Метод ЛКС позволяет определять дисперсный состав исследуемой жидкости по относительному вкладу содержащихся в ней частиц в рассеяние света. Распределение частиц по размерам, в результате математической обработки, позволяет охарактеризовать дисперсный состав конкретной биологической жидкости и классифицировать распределения в соответствии с выделенными информативными зонами спектра.
Заключение. Таким образом, среди рассмотренных методов нет ни одного, который подходил бы для диагностики всех заболеваний. Отдельно взятый метод имеет свои достоинства и недостатки. Так, например, цитологический метод прост в использовании, не требует специализированного оборудования и высокой квалификации микроскописта. Появление микроядер в клетках буккального эпителия служит хорошим индикатором воздействия ксенобиотиков или лучевого поражения. Однако этот метод отражает только цитогенетические характеристики и не дает возможности определить локализацию патологии. Остальные методы более сложны в использовании и требуют дорогого оборудования для их осуществления, но позволяют исследовать клетки более детально. С помощью метода внутриклеточного микроэлектрофореза можно определить функциональное состояние человека и его биологический возраст
Метод определения конденсации хроматина показывает влияние стрессовых факторов на состояние организма и утомляемость человека при физических нагрузках. С помощью, описанных выше, методов можно исследовать отдельные структуры клетки. Но для более объективной оценки функционального состояния человека по буккальному эпителию необходимо использовать комплексный подход.
Читайте также:

