Историческая справка кто открыл электролитическую диссоциацию возможно портрет
Обновлено: 07.07.2024
Основные положения ТЭД
1. При растворении в воде
электролиты диссоциируют
(распадаются) на положительные и
отрицательные ионы.
NaCl = Na+ + ClИоны – это одна из форм
существования химического элемента
• ИОНЫ – это положительно или отрицательно
заряженные частицы, в которые превращаются
атомы или группы атомов в результате отдачи
или присоединения электронов
ЭЛЕКТРОННЫЕ ФОРМУЛЫ
0 2ē 8ē 1ē
Na
+11
атом
0 2ē 8ē 7ē
Cl
+17
атом
+ 2ē 8ē
Na
+11
ион
0 2ē 8ē 8ē
Cl
+17
ион
Основные положения ТЭД
2. Причиной диссоциации электролита
в водном растворе является его
гидратация, т.е. взаимодействие
электролита с молекулами воды и
разрыв химической связи в нем.
ИОНЫ
(по наличию водной оболочки)
• ГИДРАТИРОВАННЫЕ
• НЕГИДРАТИРОВАННЫЕ
Например:
В растворах и
кристаллогидратах
CuSO4 * 5H2O
Na2SO4* 10H2O
Например:
В безводных солях
Cu2+SO42Na+NO3-
Основные положения ТЭД
3. Под действием электрического тока
положительно заряженные ионы
движутся к отрицательному полюсу
источника тока – катоду, поэтому их
называют катионами, а
отрицательно заряженные ионы
движутся к положительному полюсу
источника тока – аноду, поэтому их
называют анионами.
ИОНЫ
(по знаку заряда)
• КАТИОНЫ
положительно
заряженные
частицы
• АНИОНЫ
отрицательно
заряженные
частицы
Основные положения ТЭД
4. Электролитическая диссоциация –
процесс обратимый для слабых
электролитов.
Наряду с процессом диссоциации
протекает и обратный процесс –
ассоциация (соединение ионов)
HNO2
H+ + NO2-
степень диссоциации
• Отношение числа молекул
электролита, распавшихся на ионы
к общему числу молекул в
растворе
Факторы, влияющие на
степень диссоциации
• 1) природа электролита и растворителя
• 2) температура
• 3) концентрация электролита
Основные положения ТЭД
6. Химические свойства растворов
электролитов определяются
свойствами тех ионов, которые они
образуют при диссоциации.
ЗАДАНИЕ
Составьте возможные уравнения
электролитической диссоциации
веществ в водных растворах.
1) HCl
2) HNO3 3) Н2SiO3
КИСЛОТЫ
• электролиты, которые при диссоциации
образуют катионы водорода и анионы
кислотного остатка.
HCl = H+ + ClHNO3 = H+ + NO3-
Многоосновные кислоты
диссоциируют ступенчато
H3PO4 (фосфорная кислота)
1) Образование дигидрофосфат-ионов
H3PO4 ↔ H+ + H2PO42) Образование гидрофосфат-ионов
H2PO4- ↔ H+ + HPO423) Образование фосфат-ионов
HPO42- ↔ H+ + PO43-
ЗАДАНИЕ
Составьте возможные уравнения
электролитической диссоциации
веществ в водных растворах.
1) NaOH 2) KOH 3) Fe(OH)2
ОСНОВАНИЯ
• электролиты, которые при диссоциации
образуют катионы металла и гидроксиданионы.
NaOH = Na+ + OHKOH = K+ + OH-
Многокислотные основания
диссоциируют ступенчато
Ba(OH)2 (гидроксид бария)
1) Образование гидроксо-ионов бария
Ba(OH)2 ↔ OH- + BaOH+
2) Образование ионов бария
BaOH+ ↔ Ba2+ + OH-
ЗАДАНИЕ
Составьте возможные уравнения
электролитической диссоциации
веществ в водных растворах.
1) NaCl 2) KNO3 3) BaSO4
СОЛИ
электролиты, которые при
диссоциации образуют катионы
металла (или аммония NH4) и анионы
кислотных остатков.
K3PO4 = 3K+ + PO43NH4Cl = NH4+ + Cl-
ПРОВЕРЬ СВОИ ЗНАНИЯ
• Пользуясь таблицей растворимости,
приведите примеры трех веществ,
которые в растворах образуют
сульфат-ионы. Запишите уравнения
электролитической диссоциации
этих веществ.
1) H2SO4 ↔ H+ + HSO42) HSO4- ↔ H+ + SO42-
В первой половине XIX в. М. Фарвдей ввел понятие об электролитах и неэлектролитах. Электролитами он назвал вещества, водные растворы которых проводят электрический ток) а неэлектролитами — веществе, водные растворы которых не проводят электрический ток.
Для объяснения свойств водных растворов электролитов шведский ученый С. Арреииус (1859—1927) в 1887 г. предложил теорию электролитической диссоциации.
Согласно этой теории, при растворении в воде электролиты распадаются на свободные ионы. Этот процесс назвали электролитической диссоциацией. Растворы веществ тогда становятся проводниками электрического тока, когда они содержат ионы (положительно или отрицательно заряженные частицы), которые в электрическом поле приходят в направленное движение.
Но эта теория не ответила на некоторые вопросы: почему одни вещества являются электролитами, а другие нет? Какую роль в образовании ионов играет растворитель?
Представления о диссоциации электролитов получили развитие в работах русских химиков И. А. Каблукова и В. А. Кистаковского. Они применили к объяснению процесса электролитической диссоциации химическую теорию растворов Д. И. Менделеева. Как известно, он экспериментально доказал, что при растворении электролитов происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. .Эти ионы связаны с молекулами воды, то есть являются гид рати ронянными. Гидратированные ионы в растворе находятся в постоянном хаотическом движении. Бели же в этот раствор поместить противоположно заряженные электроды, то положительные ионы начнут двигаться к катоду — их назвали катионами, а отрицательные будут двигаться к аноду — и потому их назвали анионами.
Проникнуть в сущность процесса электролитической диссоциации помогло установление природы химической связи.
Вы, очевидно, помните синие кристаллы медного купороса, эту окраску ему придают гидратированные ноны меди.
По свойствам ионы отличаются от атомов. Так, атомы натрии образуют простое вещество — металл натрий. Он активно взаимодействуете водой, вытесняя водород, а гидратированные ионы натрия этой способностью не обладают. Атомы хлора объединяются в двухатомные молекулы Сl2. Простое вещество хлор Сl2 имеет желто-зеленую окраску, удушливый запах, а гидратированные ионы хлора бесцветны и не имеют запаха. Молекулы водорода, состоящие из двух атомов Н. образуют бесцветный горючий газ, который плохо растворяется в воде, а ноны водорода не горят и существуют в водных растворах в виде иона оксония CuS04, окрашивающего лакмус в красный цвет.
Электролитами могут быть только вещества с ионной и ковал ент ной полярной связями. Вы знаете такие вещества — это соли, основания, кислоты. Вспомните определения классов этих веществ с точки зрения теории электролитической диссоциации.
Степень электролитической диссоциации. Сильные и слабые электролиты
С. Аррениус для количественной характеристики электролитической диссоциации ввел понятие степени электроли-тической диссоциации, обозначаемой греческой буквой a.
Степень электролитической диссоциации — это отношение числа молекул электролита, распавшихся на ионы, к общему числу растворенных молекул .
a= Число молекул, распавшихся на ион/ Общее число растворенных молекул.
Если а = 0, то вещество совсем не распадается на ионы, оно является неэлектролитом. К неэлектролитам относятся вещества с ковал битным и малополярными и менолярныыи связями, такие, как эфиры, углеводороды, кислород, азот и др.
Степень электролитической диссоциации может иметь значение от 0 до 1(в процентах от 0 до 100%).
Сильные электролиты — это такие электролиты, которые в водных растворах (даже концентрированных) практически полиостью диссоциируют на ноны. У таких электролитов степень диссоциации стремится к 1 (100%). К сильным электролитам относятся почти все соли, неорганические кислоты, щелочи.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы. Их степень диссоциации значительно меньше 1 (100%), в большинстве случаев она стремится к нулю. Но при разбавлении, как вы помните, степень диссоциации увеличивается.
К слабым электролитам относятся: многие неорганические кислоты , органические кислоты, основания (за исключением щелочей), гидрат аммиака, некоторые соли.
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между педиссоцииро ванны ми молекулами и ионами.
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия.
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации. Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадется на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Фториводородная кислота более сильный электролит, чем уксусная.
Многоосновние кислоты, а также миогокпелотные основания диссоциируют ступенчато.
Диссоциация воды. Водородный показатель. Среды водных растворов электролитов
Вода, как было отмечено ранее, слабый электролит. Без учета гидратации ионов Н2 уравнение диссоциации воды имеет вид:
Произведение концентрации ионов водорода и гидроксид-ионов называют ионным произведением воды.
В разбавленных водных растворах электролитов, как и в воде, произведение концентраций ионов водорода Н2 и гидроксид-ионов ОН — величина постоянная при определенной температуре. Ионное произведение воды дает возможность вычислить концентрацию гидроксид-ионов ОН" в любом водном растворе, если известна концентрация ионов водорода Н и наоборот.
Различают три типа сред: нейтральную, щелочную, кислотную.
Нейтральная — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов:
[Н+] = [ОН-] =10 -7 моль/л
Кислотная — это среда, в которой концентрация ионов водорода больше концентрации гндроксид-ионов:
[Н+] > [ОН-], [Н+] > 10 -7 моль/л
Щелочная — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
[Н+] Свойства растворов электролитов
Свойства растворов слабых электролитов обусловлены и молекулами, и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Запах уксусной кислоты обусловлен наличием молекул СН3СООН. кислый вкус и изменение окраски индикаторов связаны с наличием в растворе ионов Н*.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
Например, общие свойства кислот, такие, как кислый вкус, изменение окраски индикаторов и др.. обусловлены наличием в их растворах катионов водорода Н~ (точнее ионов Н30 + ). Общие свойства щелочей, такие, как мылкость на ощупь, изменение окраски индикаторов и др. связаны с присутствием в их растворах гидроксид-ионов ОН-, а свойства солей — с распадом их в растворе на катионы металла (или аммония) и анионы кислотных остатков.
Как вы знаете, большая скорость многих химических реакций в растворах электролитов объясняется тем. что они протекают не между молекулами, а между ионами.
Реакции, протекающие между ионами, называют ионными реакциями.
Реакции ионного обмена в водных растворах могут протекать:
1) необратимо, до конца;
2) обратимо, то есть протекать одновременно в двух противоположных направлениях.
Как вам известно, реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ноны, соединяясь друг с другом, образуют вещества:
а) нерастворимые;
б) малодиссоциирующие (слабые электролиты);
в) газообразные.
В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Например:
СН3СО0Н + КОН СН3СО0К + H2O
слабый слабый
электролит электролит
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.
1. Какие вещества относят к электролитам, а какие — к неэлектролитам ?
2. Какие из следующих жидкостей проводит электрический ток: этиловый спирт, водный раствор глюкозы, водный раствор натрия, раствор кислорода в воде, водный раствор карбоната натрия, расплав гидроксида калия? Ответ объясните.
3*. Заполните следующую таблицу:
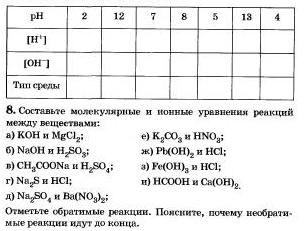
9. Определите возможность протекания реакций обмена между водными растворами веществ:
а) сульфата калия и гилроксилн бария;
б) карбонита натрия и хлорида кальция; нитрита меди(ІІ) и сульфата железа(ІІ);
г) пцроксцяа натрия и серной кислоты;
д) сульфита калия и азотной кислоты;
е) нитрата алюминия и хлорида калия.
Составьте уравнения возможных реакций в молекулярной, полной и сокращенной ионных формах.
Лабораторные опыты
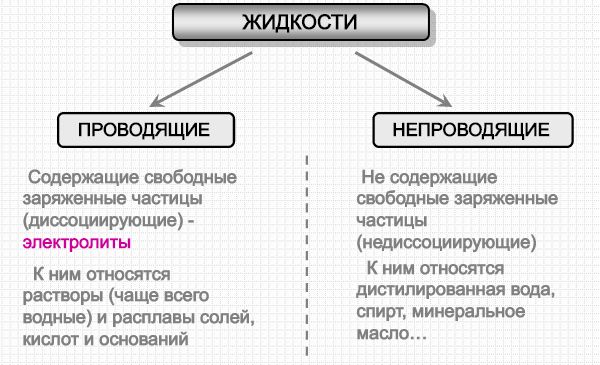
Сегодняшний наш урок был посвящен изучению электролитической диссоциации, на котором вы узнали, что так называют распад нейтральных молекул вещества на положительные и отрицательные ионы, который происходит под воздействием растворителя.
Кроме этого, вам уже известно, что в зависимости от электрических свойств, жидкости делятся на две группы:
А теперь давайте проведем опыты и на практике проверим некоторые вещества на электрическую проводимость. А чтобы понять, проводит ли взятое нами вещество электрический ток, необходимо в него поместить электроды.
И в том случае, если взятое нами вещество проводит электрический ток, то мы с вами будем наблюдать процесс, при котором происходит замыкание цепи и лампочка при этом загорается. А если же взятое нами вещество не обладает электропроводностью, то в этом случае цепь по-прежнему останется разомкнутой и естественно, что мы не сможем наблюдать, как загорится лампочка.
А теперь приступим к испытанию веществ на его электропроводимость:
• Первое, что мы с вами сделаем, так это насыпаем в чашку Петри кристаллический хлорид натрия NaCl, а нам уже известно, что это простая поваренная соль, и дальше подносим к электродам. Теперь внимательно смотрим и видим, что в данном случае лампочка не загорается. Отсюда мы делаем вывод, что поваренная соль электрический ток не проводит.
• Второе, что мы с вами сделаем, так это возьмем какое-то органическое вещество и проверим его на наличие электропроводимости. Пускай этим органическим веществом будет, например, сахар. Проделываем наш опыт заново и опять видим, что лампочка все также не горит. Какой мы можем сделать вывод из этого опыта? А вывод будет такой, что твердые вещества, также не способны проводить электрический ток.
• На третьем опыте мы с вами попробуем проверить электропроводность на дистиллированной воде и узнаем, является ли она электролитом? И опять мы наблюдаем, что лампочка все также не горит. Почему так происходит? А все очень просто, оказывается, что в дистиллированной воде ионов совсем мизерное количество и за счет этого вода имеет очень низкую электропроводность. Поэтому делаем вывод, что дистиллированная вода, является довольно слабым электролитом.
• Ну и следующее, что мы сделаем, так это проверим на электропроводимость растворы солей, щелочей, кислот. Проводя опыт с раствором гидроксида натрия, мы наблюдаем, как загорается лампочка. И отсюда делаем вывод, что гидроксида натрия обладает электропроводностью. При испытании на электропроводность раствора поваренной соли, лампочка также зажглась. Тот же эффект мы получим и проделывая опыт с раствором соляной кислоты HCl. Как видите, все испытания, проводимые с растворами доказали, что они являются электролитами.
Теперь попробуем подвести итог наших испытаний и сделать выводы о том, какие вещества являются электролитами, а какие электрический ток не проводят. После проведенных опытов мы можем уверенно утверждать, что твердые вещества не являются электролитами и поэтому неспособны проводить электрический ток. А вот растворы солей, щёлочей, кислот способны проводить электрический ток, так как являются электролитами. Но, также следует запомнить, что не все растворы являются электропроводными, так как у некоторых отсутствуют заряжение частицы и естественно, что такие растворы электролитами не могут быть.
Домашнее задание
На уроке вы наблюдали за проведением опытов, с помощью которых велись испытания на электропроводность некоторых веществ. Постарайтесь вспомнить все, что вы наблюдали на уроке, и заполните таблицу, записав результаты опытов по электрической проводимости указанных веществ:
Содержание
Введение 3
1 Истоки теории электролитической диссоциации
1.1 Основоположник ТЭД – С.Аррениус 4
1.2 Новые представления о солях, кислотах и основаниях 6
1.3 Дальнейшее развитие ТЭД 7
2 Борьба за признание ТЭД
2.1 ТЭД и Д.И.Менделеев 11
2.2 ТЭД В России 13
3 Теория растворов
3.1 Химическая теория растворов Д.И.Менделеева 16
3.2 Осмотическая теория Вант-Гоффа 18
3.3 Неводные растворы 19
3.4 Дальнейшее развитие теории растворов 24
Заключение 25
Список литературы 26
Работа состоит из 1 файл
реферат по истории химии.doc
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ГОУ ВПО ТВЕРСКОЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Реферат по истории химии
Истоки теории электролитической диссоциации. Возникновение теории растворов.
1 Истоки теории электролитической диссоциации
1.1 Основоположник ТЭД – С.Аррениус 4
1.2 Новые представления о солях, кислотах и основаниях 6
1.3 Дальнейшее развитие ТЭД 7
2 Борьба за признание ТЭД
2.1 ТЭД и Д.И.Менделеев 11
2.2 ТЭД В России 13
3 Теория растворов
3.1 Химическая теория растворов Д.И. Менделеева 16
3.2 Осмотическая теория Вант-Гоффа 18
3.3 Неводные растворы 19
3.4 Дальнейшее развитие теории растворов 24
Список литературы 26
Для двух ребят подарков груз
Ион взвалил себе на спину:
Для Кати Он несет свой плюс,
Для Ани Он несет свой минус.
Еще на заре изучения электрических явлений ученые заметили, что ток могут проводить не только металлы, но и растворы. Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток. Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток.
В 1887 году шведский физик-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду. Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет.
К середине 19 века возрастает интерес ученых к природе растворов. Становится все очевиднее, что без знания природы растворов невозможно изучать многие явления и проникнуть в сущность различных производственных процессов. В связи с развитием химических производств появилась острая необходимость в изучении свойств и состава различных растворов. Многие ученые того периода рассматривали растворы как механические смеси определенных соединений растворенного вещества с молекулами растворителя. Наибольшее развитие учение о растворах получило в фундаментальных работах Д.И.Менделеева [1].
1.1 ОСНОВОПОЛОЖНИК ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ - С.АРРЕНИУС
История возникновения теории электролитической диссоциации связана с именем шведского физика-химика Сванте Аррениуса (1859— 1927). Его перу принадлежит 200 научных работ в области химии, физики, геофизики, метеорологии, биологии, физиологии.
АРРЕНИУС (Arrhenius), Сванте Август. Шведский физикохимик Сванте Август Аррениус родился в имении Вейк, недалеко от Упсалы. Он был вторым сыном Каролины Кристины (Тунберг) и Сванте Густава Аррениуса, управляющего имением. Предки Аррениуса были фермерами. Через год после рождения сына семья переехала в Упсалу, где С.Г.Аррениус вошел в состав совета инспекторов Упсальского университета. Посещая кафедральное училище в Упсале, Аррениус проявил исключительные способности к биологии, физике и математике.
В 1876г. Аррениус поступил в Упсальский университет, где изучал физику, химию и математику. В 1878г. ему была присвоена степень бакалавра естественных наук. Однако он продолжал изучение физики в Упсальском университете в течение трех последующих лет, а в 1881г. уехал в Стокгольм, в Шведскую королевскую академию наук, чтобы продолжать исследования в области электричества под руководством Эрика Эдлунда.
В 1884г. Аррениус защищает докторскую диссертацию в Упсальском университете. А в 1886г. Аррениус становится стипендиатом Шведской королевской академии наук, что позволило ему работать и проводить исследования за рубежом. В течение следующих пяти лет он работал в Риге с Оствальдом, в Вюрцбурге с Фридрихом Кольраушем (здесь он встретился с Вальтером Нернстом), в Грацком университете с Людвигом Больцманом и в Амстердамском – с Якобом Вант-Гоффом. Вернувшись в Стокгольм в 1891г., Аррениус начинает читать лекции по физике в Стокгольмском университете, а в 1895г. получает там должность профессора. В 1897г. он занимает пост ректора университета.
Аррениус получил много наград и титулов. Среди них: медаль Дэви Лондонского королевского общества (1902), первая медаль Уилларда Гиббса Американского химического общества (1911), медаль Фарадея Британского химического общества (1914). Он был членом Шведской королевской академии наук, иностранным членом Лондонского королевского общества и Германского химического общества. Аррениус был удостоен почетных степеней многих университетов, в т. ч. Бирмингемского, Эдинбургского, Гейдельбергского, Лейпцигского, Оксфордского и Кембриджского [6].
Интересно, что идея, ставшая основой этой теории, возникла на основе опытов, поставленных для решения совершенно иной проблемы.
Но в результате первых наблюдений С. Аррениус теряет интерес к задуманной теме. Его увлекает новая мысль. Что происходит с молекулой электролита в растворе? Молодой ученый сознавал, что успешное решение этого вопроса позволит пролить яркий свет на темную область растворов. Так вместо определения молекулярной массы растворенного неэлектролита С.Аррениус начинает интенсивно изучать состояние молекулы электролита в растворе.
И все же опыты С.Аррениуса, да и других ученых, упорно приводили к выводу, что в растворах электролитов действительно существуют ионы, независимо от того, действует на них электрическое поле или нет. И это придавало С.Аррениусу уверенность в своей правоте. Встретили теорию Аррениуса по-разному: одни ученые с воодушевлением, другие – в штыки. Это и понятно. Она имела много плюсов, но не меньше и минусов [3].
1.2 НОВЫЕ ПРЕДСТАВЛЕНИЯ О СОЛЯХ, КИСЛОТАХ И ОСНОВАНИЯХ
С.Аррениус создал фактически новые представления о кислотах, основаниях и солях. Кислотой он считал соединение, диссоциирующее в водном растворе с отщиплением ионов водорода. Например:
Отсюда стало ясно, почему кислоты имеют ряд общих свойств. Кислый вкус, одинаковая окраска индикатора, выделение водорода при действии активных металлов – за все эти свойства отвечали ионы водорода, образующиеся при диссоциации кислот.
Основанием он считал соединение, диссоциирующее в водном растворе с образованием гидроксид-ионов:
1.3 ДАЛЬНЕЙШЕЕ РАЗВИТИЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
ВАНТ-ГОФФ (van't Hoff), Якоб Генрик. Нидерландский химик Якоб Генрик Вант-Гофф родился в Роттердаме, в семье врача Якоба Генрика Вант-Гоффа. По настоянию родителей Вант-Гофф начал изучать инженерное дело в Политехнической школе в Дельфте. В ней Вант-Гофф за два года прошел трехлетнюю программу обучения и лучше всех сдал выпускной экзамен.
В 1871 г. Вант-Гофф стал студентом естественно- математического факультета Лейденского университета. На следующий год он перешел в Боннский университет, чтобы изучать химию под руководством Фридриха Августа Кекуле. Два года спустя Вант-Гофф продолжил свои занятия в Парижском университете, где и завершил работу над диссертацией. Вернувшись в Нидерланды, он представил ее к защите в Утрехтском университете.
Читайте также:

