Для чего назначают актовегин в протоколе эко
Обновлено: 12.05.2024
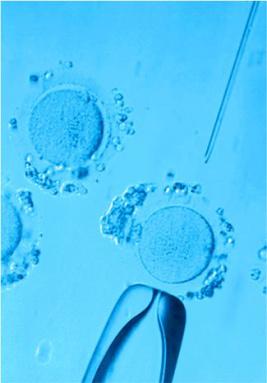
Многие считают, что положительный исход ЭКО полностью зависит от репродуктолога. Но успех программы ЭКО+ИКСИ заключается в слаженной работе всех специалистов клиники, а также и от самих пациентов. Врач консультирует пациента, назначает анализы и готовит к программе. После осуществляется пункция яйцеклеток и подсаживается эмбрион. Врач контактирует с пациентом все время: при обследовании, во время участия в протоколе ЭКО, в период после процедур. Потому вполне логично, что при выборе клиники пациенты обращают внимание на репродуктолога, отношения, которые устанавливаются между ними и врачом. Но только ли от этого зависит итог участия в программе?
После пункции полученные ооциты передаются в лабораторию. И с данного момента будущее ребенка переходит в руки состава врачей-эмбриологов. Какой расходный материал, какие среды используются в лаборатории, насколько они стабильны, соблюдается ли температурный режим это все очень важно и для правильного оплодотворения, и для последующего культивирование эмбрионов. Клиника OXY-center при прохождении программ ЭКО+ИКСИ предоставляет только высококачественные расходные материалы, используются сертифицированные среды для культивирования. Здесь важна каждая деталь, и мы обращаем пристальное внимание на все мелочи процесса.
Рассмотрим кратко описание функционирования эмбриологической лаборатории, а также те работы, которые выполняет врач-эмбриолог.
Важность температурных режимов (термостабилизация) для всех эмбриологических процедур
Термостабилизация подразумевает прогрев всех инструментов, используемых при работе с эмбрионами и ооцитами: иглы для пункции, катетеры, пробирки для фолликулярной жидкости. Поддержание нужной температуры возможно благодаря специальным термостоликам, которыми оборудована эмбриологическая лаборатория.
Контроль уровня углекислого газа и температуры в инкубаторе
При манипуляциях, направленных на оплодотворение яйцеклетки, а также культивирование эмбриона, важно сохранять не только определенную температуру, но и уровень кислорода, влажности, углекислого газа. Используемые нашей клиникой инкубаторы имеют интегрированные термометры и сенсоры, которые регулируют и измеряют данные показатели. Однако для дополнительного контроля их необходимо снимать и вручную. Измерения проводятся нашими эмбриологами с помощью независимых приборов. Полученные показания сравнивают с теми, что высвечиваются на дисплее инкубатора.
Как проходит процедура
В день пункции эмбриолог в лабораторных условиях изучает сперму. Прежде, чем добавить сперму в среду с ооцитами, ее обрабатывают средствами для удаления семенной плазмы, очищают, центрифугируют, затем микроскопируют, определяют качество спермы и отправляют в инкубатор. Это проводится для получения полноценных и подвижных сперматозоидов. Полученные яйцеклетки врач-эмбриолог совместно с врачом-репродуктологом просматривает под микроскопом и отбирает лучшие, способные к оплодотворению, которые затем переносят в инкубатор с пониженным содержанием кислорода и соблюдением оптимальных условий для культивирования. Они воссоздают натуральную среду в организме будущей матери. Эмбрионы восприимичивы к загрязнению на молекулярном уровне, поэтому в лаборатории строго контролируется чистота и качество воздуха. Для этого применяется уникальная система фильтрации из нескольких стадий. За ее счет достигается стерильная для эмбрионов атмосфера.
Этот алгоритм действий повторяется отдельно для каждого полученного ооцита. Яйцеклеточная мембрана обладает эластичностью, и минимальное отверстие от микроиглы быстро затягивается благодаря этому свойству мембраны. Далее эмбрионы в индивидуальных каплях специальной среды растут в инкубаторе. Проводится обязательный ежедневный мониторинг их развития. Есть еще три важных вопроса, решаемые репродуктолого и эмбриологом сообща: когда, сколько и какие эмбрионы подсаживать.
Когда и сколько переносить эмбрионов в маточную полость?
В нашей клинике этот вопрос решается индивидуально для каждой супружеской пары. На основании оценки качества эмбрионов, они могут быть перенесены на 3 или 5 сутки после пункции. Так же возможен двойной перенос (на 3 и 5 сутки). Перед началом переноса репродуктолог обсуждает с супругами эмбриологическую ситуацию: сколько имеется эмбрионов, какого они качества, сколько будет перенесено, сколько может быть подвергнуто криоконсервации витрификационным методом, то есть заморозкой, минуя стадию льда. Пациенткам OXY-center мы переносим в маточную полость не более 2-х эмбрионов, по международным стандартам, для понижения риска возникновения многоплодной беременности.
Какие эмбрионы отбираются для переноса?
К 5 дню внутри эмбриона формируется полость, заполненная жидкостью, увеличивающаяся в размерах, а затем образуется бластоциста. При этом в самой бластоцисте, клетки подразделяются на два типа: те, из которых далее формируется плод (эмбриобласт), и те, из которых формируется плацента (трофобласт). Трофобласты отвечают за имплантацию эмбриона, то есть его крепление в эндометрий. Плацента даст начало внезародышевым оболочкам плода.
В чем заключается процедура переноса?
Большая часть женщин переживает эмбриональный перенос безболезненно: он осуществляется быстро и пациентка может не заметить окончания процедуры. Иногда, эмоционально лабильным женщинам может потребоваться поддержка психолога. При переносе в качестве инструмента применяется гибкий мягкий катетер, заполняемый питательной средой с содержанием одного или нескольких эмбрионов. Перенос происходит под контролем УЗИ, чтобы отслеживать движение среды с эмбрионами в маточной полости. Мы приглашаем приходить на перенос супруга, для психологической поддержки пациентки.

Прошло достаточно немного времени с начала применения препарата Актовегин в борьбе с ишемической болезнью сердца и ишемическим поражением головного мозга, как стали поступать сведения о положительных результатах, полученных при использовании препарата для ускорения заживления ран, терапии некрозов, эрозивно-язвенного поражения кожи и слизистых оболочек различного генеза. Более того, Актовегин нашел свое место и в акушерско-гинекологической практике, став препаратом выбора при ряде гинекологических заболеваний, зарекомендовав себя как действенное средство для применения в акушерской практике в широком спектре патологии беременности. У пациенток с сахарным диабетом, гестозами, плацентарной недостаточностью, являющейся основной причиной внутриматочной гипоксии, задержки роста и развития плода, его травм в процессе родов, Актовегин в качестве препарата с выраженным метаболическим действием входит в состав комплексной терапии.
Актовегин содержит компоненты, обладающие высокой биологической активностью: аминокислоты, олигопептиды, нуклеозиды, олигосахариды и гликолипиды, ферменты, электролиты и ряд важных макро- и микроэлементов (магний, натрий, кальций, фосфор Si и Cu). Молекулярная масса органических соединений не превышает 500 Да. Актовегин производится в соответствии с требованиями безопасности в отношении прионовых заболеваний. Магний – основной компонент нейропептидных ферментов и каталитический центр всех известных нейропептидов – необходим для синтеза клеточных пептидов. Микроэлементы, в частности Cu, имеют большое значение для активности супероксиддисмутазы – одного из ключевых ферментов антиоксидантной защиты.
Метаболические эффекты Актовегина связаны с:
- усилением физиологического процесса переноса кислорода и глюкозы в недостаточно снабжаемые ткани;
- стимулированием активности ферментов окислительного фосфорилирования;
- повышением обмена богатых энергией фосфатов;
- ускорением, благодаря повышенному энергетическому обмену, распада лактата и b-гидроксибутирата, что способствует нормализации клеточного рН.
- увеличением притока ионов К+ в клетку, что сопровождается активацией калийзависимых ферментов (каталаза, сахараза, глюкозидаза);
Активные компоненты, входящие в состав Актовегина, оказывают инсулиноподобное действие. Олигосахариды Актовегина активируют транспорт глюкозы внутрь клетки, минуя рецепторы инсулина. Одновременно Актовегин модулирует активность внутриклеточных носителей глюкозы, что сопровождается интенсификацией липолиза. Чрезвычайно важно, что действие Актовегина инсулинонезависимое и сохраняется у пациентов с инсулинозависимым сахарным диабетом, способствует замедлению прогрессирования диабетической ангиопатии и восстановлению капиллярной сети за счет новообразования сосудов.
Максимальной эффективности препарат Актовегин достигает в условиях кислородного голодания клетки. Установлено, что клетки различного происхождения под влиянием Актовегина увеличивают потребление глюкозы и улучшают утилизацию кислорода. Этот эффект приводит к активации энергетических процессов внутри клеток и оказывает влияние на их функциональный метаболизм. При условиях, ограничивающих нормальные функции энергетического метаболизма (гипоксия, недостаток субстрата), и при повышенном потреблении энергии (заживление, регенерация) Актовегин стимулирует энергетические процессы функционального метаболизма и анаболизма. Вторичным эффектом является усиление кровоснабжения. В условиях тканевой гипоксии, вызванной нарушением микроциркуляции, он способствует становлению капиллярной сети за счет новообразующихся сосудов. Повышение диффузии и утилизации кислорода клетками различных органов и тканей приводит к улучшению оксигенации в зоне микроциркуляции. При этом улучшается анаэробный энергообмен в эндотелии сосудов, сопровождающийся высвобождением эндогенных веществ с мощными вазодилятирующими эффектами – простациклина и оксида азота, обуславливая улучшение перфузии органов.
Способность Актовегина активизировать обмен веществ на клеточном уровне за счет усиления транспорта и утилизации кислорода клетками, улучшения анаэробного метаболизма и стимуляции образования энергии делает патогенетически оправданным применение препарата при гипоксических состояниях в акушерско-гинекологической практике.
При нарушениях метаболизма и кровоснабжения головного мозга, например при синдроме церебральной недостаточности (травма, острые и хронические нарушения мозгового кровообращения), ухудшается перенос глюкозы через гематоэнцефалический барьер и ее утилизация клетками. Снижается также активность пируватдегидрогеназы и концентрация ацетилхолина.
Антигипоксические и антиоксидантные свойства Актовегина были наиболее тщательно изучены в неврологии. Результаты многочисленных исследований послужили основанием для применения препарата в неврологии по широкому кругу показаний, включая нарушения мозгового кровообращения по ишемическому и геморрагическому типу, последствия черепно-мозговой травмы, сосудисто-мозговую недостаточность у больных, страдающих гипертонией, гипертоническую энцефалопатию и др.
Под влиянием инфузий Актовегина существенно улучшаются показатели центральной гемодинамики у беременных, имевших гипокинетический тип кровообращения. При этом значительно снижается общее периферическое сосудистое сопротивление и улучшается плодово-плацентарный кровоток. В акушерской практике при плацентарной недостаточности используют различные препараты, повышающие устойчивость головного мозга и тканей плода к гипоксии (антигипоксанты, нейропротекторы). Одним из хорошо изученных антиоксидантов является Актовегин. При лечении беременных с хронической ПН проводится ступенчатая терапия Актовегином, начиная с инфузионных форм с переходном на пероральные . У больных с привычным невынашиванием возможно и профилактическое применение Актовегина.
Метаболическая терапия является ключевым компонентом комплексного лечения хронического эндометрита. Важной мерой профилактики обострения этого заболевания и необходимой частью комплексной терапии послеабортного или послеродового хронического эндометрита, а также после лечебно-диагностических выскабливаний матки является реабилитация структурно-функционального состояния эндометрия, особенно при наличии факторов риска развития эндометрита. Использование Актовегина у таких пациенток с целью восстановления морфофункционального состояния ткани, а также профилактики постабортных и обострения хронических воспалительных процессов в эндометрии является научно обоснованным.
Таким образом, метаболическая терапия является ключевым компонентом комплексного лечения многих патологических состояний и направлена на усиление тканевого обмена, активацию энергетических процессов в клетках, устранение последствий гипоксии ткани, в т.ч. угнетение анаэробного гликолиза. С этой целью целесообразно использование Актовегина, который является ярким представителем лекарственных средств с выраженным метаболическим действием.
Рассмотрены факторы риска развития хронического эндометрита, клинические симптомы заболевания, методы диагностики и подходы к комплексной терапии.
An examination was performed on the factors of the risk of the development of chronic endometritis, clinical symptoms of disease, methods of diagnostics and approaches to complex therapy.
.jpg)
В структуре гинекологической патологии у женщин репродуктивного возраста частота хронического эндометрита (ХЭ) по данным разных авторов составляет от 3% до 73% [3, 4]. Это связано, прежде всего, с трудностями морфологической верификации диагноза, различиями в исходно анализируемом материале и контингенте больных, значительной вариабельностью числа наблюдений. По нашим данным, частота ХЭ среди гинекологических больных составляет около 3%.
В настоящее время актуальность проблемы ХЭ приобретает не только медицинское, но и социальное значение, поскольку данное заболевание часто приводит к нарушению репродуктивной функции, являясь причиной бесплодия, неудачных попыток экстракорпорального оплодотворения (ЭКО), невынашивания беременности (НБ), осложненного течения беременности и родов [1].
Хронический эндометрит — клинико-морфологический синдром, характеризующийся комплексом морфофункциональных изменений эндометрия воспалительного генеза, приводящих к нарушению нормальной циклической трансформации и рецептивности ткани.
Среди пациенток с ХЭ 97,6% составляют женщины репродуктивного периода, что подчеркивает особую значимость данной патологии с точки зрения влияния на репродуктивную функцию [2].
У женщин с бесплодием ХЭ встречается в 12–68% случаев, достигая своего максимума при наличии трубно-перитонеального фактора бесплодия. У больных с неудачными попытками ЭКО и переноса эмбрионов (ПЭ) частота ХЭ возрастает до 60% и более. Наибольшие показатели распространенности ХЭ отмечены у больных с привычным невынашиванием беременности и составляют более 70% [5, 6].
По данным различных авторов, факторами риска развития ХЭ являются все инвазивные вмешательства в полости матки (гистероскопия, выскабливание полости матки, биопсия эндометрия, гистеросальпингография, манипуляции в программах вспомогательных репродуктивных технологий и др.), инфекционно-воспалительные осложнения после беременностей и родов, использование внутриматочных спиралей (ВМС), инфекции влагалища и шейки матки, бактериальный вагиноз, деформации полости матки с нарушением циклического отторжения эндометрия, лучевая терапия в области органов малого таза [1, 7, 8].
В современных условиях эндометрит характеризуется рядом особенностей: изменением этиологической структуры с увеличением значимости вирусной и условно-патогенной флоры, ростом резистентности флоры к фармакотерапии, трансформацией клинической симптоматики в сторону стертых форм и атипичного течения, длительными сроками терапии и высокой ее стоимостью [9]. Современная общепризнанная классификация ХЭ, выстроенная по этиологическому фактору, претерпела в последнее десятилетие значительные изменения в сторону расширения перечня специфических форм заболевания. Существуют вирусные (вирус папилломы человека — ВПЧ, цитомегаловирус, вирус иммунодефицита человека), хламидийные, микоплазменные, грибковые, протозойные и паразитарные специфические эндометриты, отдельно выделен саркоидоз эндометрия [1, 10]. Для идентификации инфекционного агента обязательно проводить тщательное микробиологическое исследование соскоба эндометрия с определением чувствительности флоры к антибактериальным препаратам. В одной трети случаев при гистологически верифицированном ХЭ выявляются стерильные посевы эндометрия, что может свидетельствовать о важной роли условно-патогенной флоры в развитии воспалительного процесса или недостаточной детекции возбудителя, особенно в случае вирусной инвазии [11]. Длительная и часто бессимптомная персистенция инфекционных агентов в эндометрии приводит к выраженным изменениям в структуре ткани, препятствуя нормальной имплантации и плацентации, формируя патологический ответ на беременность, а также вызывает нарушение пролиферации и нормальной циклической трансформации ткани [12]. По различным данным, у больных с бесплодием частота ХЭ составляет в среднем 10% (от 7,8 до 15,4%). Среди женщин с верифицированным ХЭ в 60% случаев диагностируется бесплодие (в 22,1% — первичное бесплодие, в 36,5% — вторичное бесплодие), неудачные попытки ЭКО и переноса эмбрионов в анамнезе отмечены у 40% женщин [4, 12]. Клиническая картина ХЭ в значительной степени отражает глубину структурных и функциональных изменений в ткани эндометрия. Неполноценная циклическая трансформация эндометрия на фоне воспалительного процесса, нарушение процессов десквамации и регенерации функционального слоя эндометрия приводят к появлению основного симптома заболевания — маточных кровотечений (перименструальные, межменструальные). Достаточно постоянными являются жалобы на тянущие боли внизу живота, дисменорею и диспареунию, нередко отмечаются серозные и серозно-гноевидные бели. Среди клинических симптомов особое место занимает бесплодие (преимущественно вторичное), неудачные попытки ЭКО и НБ. Более половины пациенток в анамнезе имеют инвазивные вмешательства в полости матки и на органах малого таза. Часто хронический эндометрит сочетается с хроническим сальпингоофоритом и спаечным процессом в малом тазе. Важно отметить, что использование минимальных критериев для диагностики воспалительных заболеваний органов малого таза (ВЗОМТ), предложенных CDC (Centers for Disease Control and Prevention, США, 1993), информативно в случае с хроническим эндометритом только в 33% [7]. В целом у 35–40% пациенток какие-либо клинические симптомы заболевания отсутствуют [8, 13]. Диагностика ХЭ основана на анализе клинических симптомов, данных анамнеза, эхографической картины [2, 11]. Обязательным этапом диагностики заболевания является морфологическое исследование эндометрия [14].
В настоящее время для диагностики внутриматочной патологии широко используется гистероскопия [16]. Наиболее частыми признаками воспалительного процесса в эндометрии являются: неравномерная толщина эндометрия — 30% случаев, полиповидные нарастания — 32,2%, неравномерная окраска и гиперемия слизистой оболочки — 23% и 11,8%, точечные кровоизлияния — 9%, очаговая гипертрофия слизистой оболочки — 7%. Трудности гистероскопической интерпретации данных связаны с отсутствием типичных макроскопических признаков хронического эндометрита, с очаговым характером воспалительного процесса и стертыми формами заболевания [17]. По разным данным гистероскопия позволяет по макроскопическим признакам точно идентифицировать хронический эндометрит только в 16–35% случаев [7, 16]. При подозрении на ХЭ гистероскопия важна для исключения всего спектра внутриматочной патологии, но для верификации диагноза во всех случаях необходимо проведение морфологического исследования эндометрия [8].
Несмотря на значительное развитие фармакологической основы терапии, лечение ХЭ в настоящее время представляет значительные трудности для клиницистов [4].
Комплексная терапия ХЭ должна быть этиологически и патогенетически обоснованной, поэтапной и базироваться на результатах максимально тщательного обследования [5]. Алгоритм лечения должен учитывать все звенья патогенеза заболевания.
Необходимость использования этиотропных препаратов для элиминирования повреждающего агента или снижение вирусной активности не вызывает сомнения. Принимая во внимание, что почти в 70% случаев ВЗОМТ применение рутинных методов диагностики не позволяет выявить этиологический фактор, эмпирическая антимикробная терапия при ХЭ всегда оправдана и приводит к достоверному уменьшению частоты клинических симптомов. При этом она должна обеспечивать элиминацию широкого спектра возможных патогенных микроорганизмов, включая хламидии, гонококки, трихомонады, грамотрицательные факультативные бактерии, анаэробы, стрептококки и вирусы. Оправдано назначение нескольких курсов этиотропной терапии со сменой групп препаратов [5, 18].
Выбор группы лекарственных препаратов зависит от данных микробиологического исследования содержимого влагалища и полости матки, анамнестических указаний на использование антибактериальных препаратов в течение последнего года, от выраженности клинической симптоматики и обширности воспалительного процесса [16].
Основу базовой антибактериальной терапии должны составлять комбинации фторхинолонов и нитроимидазолов; цефалоспоринов III поколения, макролидов и нитроимидазолов, а также сочетание защищенных пенициллинов (амоксициллин/клавулановая кислота) с макролидами. При наличии вирусной инфекции (чаще вируса простого герпеса) в зависимости от клинической картины применяют современные аналоги нуклеозидов (Ацикловир или Валтрекс), как правило, в длительном режиме — в течение не менее 3–4 месяцев [3, 19].
Одновременно на основании данных иммунного и интерферонового статуса проводится коррекция иммунных нарушений [20].
Второй этап лечения ХЭ направлен на восстановление морфофункционального потенциала ткани и устранение последствий вторичных повреждений: коррекция метаболических нарушений и последствий ишемии, восстановление гемодинамики и активности рецепторного аппарата эндометрия. Данный этап лечения крайне важен, должен быть продуманным и достаточно продолжительным [11].
Метаболическая терапия при ХЭ направлена на усиление тканевого обмена, активацию энергетических процессов в клетках, устранение последствий гипоксии ткани, в том числе угнетение анаэробного гликолиза [4, 12]. С этой целью используются комплексные метаболические препараты, длительность приема которых должна составлять не менее 3–4 недель. Представителем данной группы препаратов является Актовегин, полученный посредством диализа и ультрафильтрации, в состав которого входят низкомолекулярные пептиды и дериваты нуклеиновых кислот. Актовегин активирует клеточный метаболизм путем увеличения транспорта, накопления и усиления внутриклеточной утилизации глюкозы и кислорода, что приводит к ускорению метаболизма аденозинтрифосфата (АТФ) и повышению энергетических ресурсов клетки. Актовегин удобен для приема. Его выпускают и в таблетках, и в растворе для инъекций. Поэтому женщины, которые по каким-либо причинам не могут лечь в стационар или систематически приезжать на прием, принимают его дома по схеме, расписанной врачом. Актовегин таблетки принимают, не разжевывая, перед едой, запивая небольшим количеством жидкости, по 1 таблетке 2 раза в день в течение 30 дней [21]. При введении в форме инфузии к 200–300 мл основного раствора (0,9% раствор хлорида натрия или 5% раствор декстрозы) добавляют 10–20 мл Актовегина, раствор используют по следующей схеме: внутривенно через день в течение не менее двух недель. Скорость введения: около 2 мл/мин [22].
Положительное влияние Актовегина на кровообращение связано с улучшением доставки и утилизации кислорода, увеличением перфузии глюкозы и восстановлением аэробного метаболизма как в периферических тканях, так и в нейрональных структурах. Путем активации фермента супероксиддисмутазы препарат оказывает выраженное антиоксидантное и противоишемическое действие. Актовегин хорошо сочетается с другими лекарственными средствами, что очень удобно для комплексного лечения хронического эндометрита.
Традиционно в комплексной терапии ХЭ применяются физические факторы. Наиболее часто в комплексной терапии ХЭ применяют электроимпульсную терапию, интерференционные токи, переменное магнитное поле низкой частоты, ток надтональной частоты. Задачи физиотерапии при ХЭ заключаются в улучшении гемодинамики органов малого таза, стимуляции функции рецепторов, ускорении процессов регенерации эндометрия, повышении иммунологических свойств [4].
Дискуссионными остаются вопросы о целесообразности использования в комплексном лечении ХЭ циклической гормональной терапии. В настоящее время считается, что при хроническом эндометрите оправдано только дифференцированное назначение гормонотерапии при наличии гипофункции яичников или ановуляции. Потенциал к патологической регенерации ткани, который таит в себе хроническое воспаление, при назначении циклической заместительной гормональной терапии может быть усилен и реализован [3, 8].
Контроль эффективности терапевтических мероприятий должен проводиться не ранее чем через 2 месяца после окончания лечения с учетом эффекта последействия физиотерапии [2, 5]. При этом оценивается динамика клинических симптомов, проводится ультразвуковое исследование матки (допплерометрия сосудов матки) и аспирационная биопсия эндометрия (на 7–10 день менструального цикла) с последующим морфологическим исследованием эндометрия [1, 11].
Литература
- Кузнецова А. В. Хронический эндометрит // Арх. патол. 2000; 3 (62): 48–52.
- Краснопольский В. И., Серова О. Ф., Туманова В. А. и др. Влияние инфекций на репродуктивную систему женщин // Российский вестник акушера-гинеколога. 2004, № 5.
- Sharkey A. M., Smith S. K. The endometrium as a cause of implantation failure // Best Practice & Research Clinical Obstetrics Gynecology. 2003; 17 (2): 289–307.
- Сухих Г. Т., Шуршалина А. В. Хронический эндометрит: руководство. М.: ГЭОТАР-Медиа, 2010.
- Шуршалина А. В., Ежова Л. С., Силантьева Е. С. Патогенетические подходы к терапии хронического эндометрита // Акушерство и гинекология. 2004. № 6. С. 54–56.
- Стругацкий В. М., Силантьева Е. С. // Акуш. и гин. 2002; 6: 51–53.
- Mount S., Mead P., Cooper K. Chlamydia trachomatis in the endometrium: can surgical pathologists identify plasma cell // Adv Anat Pathol. 2001; 8 (6): 327–329.
- Stern R. A., Svoboda-Newman S. M., Frank T. S. Analysis of chronic endometritis for Chlamydia trachomatis by polymerase chain reaction // Hum Pathol. 1996; 27 (10): 1085–1088.
- Eckert L. O., Hawes S. E. Endometritis: The clinical-pathologic syndrome // Am J Obstet Gynecol. 2002; 186 (4): 690–695.
- Ingerslev H. J., Meller B. R. Chlamydia trachomatis in acute and chronic endometritis // Scand J Inf Dis. 1982.
- Шуршалина А. В. Хронический эндометрит у женщин с патологией репродуктивной функции: автореф. дис. д-ра мед. наук. М., 2007. 37 с.
- Glasser S. R., Aplin J. D. The endometrium. Taylor and Francis., 2002.
- Чен П. Т. К., Гоулдстайн М., Роузенвэкс З. Секреты репродуктивной медицины. Пер. с англ. Под общ. ред. акад. РАМН, проф. В. И. Кулакова. М.: МЕДпресс-информ, 2006.
- Buckley C. H., Fox H. Biopsy pathology of the endometrium. Arnold., 2002.
- Демидов В. Н., Гус А. И. Патология полости матки и эндометрия. ВМК. Практическое пособие. М., 2001; 16–21.
- Подзолкова Н. М., Бархина Т. Г., Осадчев В. Б. и др. Роль панорамной и микрогистероскопии в диагностике хронического эндометрита // Российский вестник акушера-гинеколога. 2004, № 6.
- Eisert W. G. Dipiridamole. Platelets/Ed. by Michelson A. D. Cambridge (USA), 2002. P. 215. Glasser S. R., Aplin J. D. The endometrium. Taylor and Francis., 2002.
- Haggerty C. L., Ness R. B., Amortegui A. et al. Endometritis does not predict reproductive morbidity after pelvic inflammatory disease // Am. J. Obstet. Gynecol. 2003. Vol. 188. P. 141–148.
- Шубич М. Г., Авдеева М. Г. Медиаторные аспекты воспалительного процесса // Apx. патол. 1997; 2: 3–8.
- Шуршалина А. В., Дубницкая Л. В. Иммуномодулирующая терапия в программе реабилитации пациенток с хроническим эндометритом // Российский вестник акушера-гинеколога. 2006. № 1. С. 36–38.
- Кулаков В. И., Шуршалина А. В. Хронический эндометрит // Гинекология. 2005. Т. 11. № 5, с. 18–20.
- Сидорова И. С., Макаров И. О., Унанян А. Л. Патогенез и патогенетически обоснованная терапия хронического эндометрита (клиническая лекция) // Акушерство, гинекология и репродукция. 2010; № 3, c. 21–24.
А. З. Хашукоева, доктор медицинских наук, профессор
Н. Д. Водяник, кандидат медицинских наук, доцент
С. А. Хлынова, кандидат медицинских наук
Е. А. Цомаева
ГБОУ ВПО РНИМУ им. Н. И. Пирогова Минздравсоцразвития России, Москва

вспомогательное вещество: вода для инъекций – до 2 мл.
1 ампула (5 мл) содержит в качестве активного вещества актовегина концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят) – 200 мг, содержащий натрия хлорид –134,0 мг;
вспомогательное вещество: вода для инъекций – до 5 мл.
1 ампула (10 мл) содержит в качестве активного вещества актовегина концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят) – 400 мг, содержащий натрия хлорид – 268,0 мг;
вспомогательное вещество: вода для инъекций – до 10 мл.
Описание
Прозрачный, желтоватый раствор, практически свободный от частиц.
Фармакотерапевтическая группа
Прочие гематологические средства.
Код АТХ: В06АВ.
Фармакологические свойства
Фармакодинамика
Депротеинизированный гемодериват крови телят вызывает увеличение энергетического метаболизма клеток, не являющееся органоспецифическим. Эта активность подтверждается результатами измерений увеличенного накопления и повышенной утилизации глюкозы и кислорода. Суммарный эффект этих процессов приводит к повышению метаболизма АТФ и, соответственно, к увеличению энергетического обеспечения клетки. При дефицитных состояниях с нарушением нормального функционирования энергетического метаболизма (гипоксия, субстратный дефицит) и при состояниях с увеличенными энергетическими потребностями (репарация, регенерация) Актовегин® активизирует энергозависимые процессы функционального метаболизма и метаболизма сохранения. В качестве вторичного эффекта наблюдается увеличение кровоснабжения.
Фармакокинетика
С помощью химико-аналитических методов невозможно изучать фармакокинетические показатели препарата Актовегин®, такие как абсорбция, распределение и выведение, поскольку его активные ингредиенты являются физиологическими компонентами, которые в нормальных условиях присутствуют в организме.
Изучение различных параметров в экспериментах на животных и в клинических исследованиях показало, что эффект препарата Актовегин® начинает проявляться самое позднее через 30 минут после применения. Максимальный эффект после парентерального введения или перорального приема достигается через 3 часа (2–6 часов).
Показания к применению
- метаболические и сосудистые нарушения головного мозга (в том числе деменция);
- периферические (артериальные и венозные) сосудистые нарушения и их последствия (артериальная ангиопатия, венозные язвы нижних конечностей), в том числе диабетическая полинейропатия.
Способ применения и дозировка
Общие указания по дозированию
Ампулы с точкой разлома (ТР)
Инструкция по применению ампул ТР:
Взять ампулу, направив цветную точку вверх! Дать раствору стечь из верхней части ампулы, слегка постукивая по ампуле и встряхивая ее.
Взять ампулу, направив цветную точку вверх! Отломать верхушку ампулы, как показано на рисунке.
Раствор для инъекций имеет слегка желтоватый цвет. Интенсивность цвета препарата из разных серий может различаться из-за использованного исходного сырья. Цвет не влияет на эффективность и переносимость препарата.
Раствор Актовегин® для инъекций можно вводить внутривенно (в/в), внутримышечно (в/м) или внутриартериально (в/а), также его можно добавлять к растворам для инфузий.
При введении в виде инфузий 10-50 мл препарата добавляется к 200-300 мл основного раствора (изотонический раствор хлорида натрия или 5 % раствор глюкозы). Темп инфузий: приблизительно 2 мл/мин. При назначении в виде инфузий следует учитывать общие противопоказания к инфузионной терапии, такие как декомпенсированная сердечная недостаточность, отек легких, олигурия, анурия, гипергидратация.
Дозировка в зависимости от определенных показаний
Метаболические и сосудистые нарушения головного мозга: от 5 до 25 мл (200-1000 мг в сутки) внутривенно ежедневно в течение двух недель, с последующим переходом на таблетированную форму.
Метаболические и сосудистые нарушения головного мозга, такие как ишемический инсульт: 20-50 мл (800-2000 мг) в 200-300 мл 0,9 % раствора натрия хлорида или 5 % раствора декстрозы, внутривенно капельно ежедневно в течение 1 недели, далее по 10-20 мл (400-800 мг) внутривенно капельно – 2 недели с последующим переходом на таблетированную форму.
Периферические (артериальные и венозные) сосудистые нарушения и их последствия: 20-30 мл (800-1000 мг) препарата в 200 мл 0,9 % раствора натрия хлорида или 5 % раствора декстрозы, внутриартериально или внутривенно ежедневно; продолжительность лечения 4 недели.
Венозные язвы нижних конечностей: 10 мл (400 мг) внутривенно или 5 мл внутримышечно ежедневно или 3-4 раза в неделю в зависимости от процесса заживления.
Диабетическая полинейропатия:
50 мл (2000 мг) в сутки внутривенно на протяжении 3 недель с последующим переходом на таблетированную форму – 2–3 таблетки 3 раза в день не менее 4–5 месяцев.
Длительность курса лечения определяется индивидуально согласно симптоматике и тяжести заболевания.
Противопоказания
Наличие аллергии на Актовегин® или аналогичные препараты или на вспомогательные вещества.
Актовегин – это препарат для стимуляции регенерации тканей. Его действующее вещество – депротеинизированный (лишенный белков) гемодериват телячьей крови. Препарат назначается с целью улучшения кровообращения и насыщения тканей кислородом. Он безопасен, а потому нередко используется в акушерстве. Актовегин при беременности назначается врачами достаточно часто.

- Состав и форма выпуска
- Показания
- Безопасность Актовегина при беременности
- Зачем назначают Актовегин при беременности?
- Способы применения и дозы
- Противопоказания
- Цена
- Использование при гестозах и плацентарной недостаточности
- Использование при антифосфолипидном синдроме
Консультации проводятся профессиональными врачами, которые имеют значительный стаж в решении проблем бесплодия.
Состав и форма выпуска
| Раствор для инъекций | 1 амп. (2 мл) |
|---|---|
| Актовегин® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)1 | 80 мг |
| вспомогательное вещество: | |
| вода для инъекций | до 2 мл |
| Раствор для инъекций | 1 амп. (5 мл) |
|---|---|
| Актовегин® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)1 | 200 мг |
| вспомогательное вещество: | |
| вода для инъекций | до 5 мл |
| Раствор для инъекций | 1 амп. (10 мл) |
|---|---|
| Актовегин® концентрат (в пересчете на сухой депротеинизированный гемодериват крови телят)1 | 400 мг |
| вспомогательное вещество: | |
| вода для инъекций | до 10 мл |
В составе концентрата Актовегин® присутствует натрия хлорид в виде ионов натрия и хлора, являющихся компонентами крови телят. Натрия хлорид не добавляется и не удаляется в процессе производства концентрата. Содержание натрия хлорида составляет около 53,6 мг (для ампул 2 мл), около 134 мг (для ампул 5 мл) и около 268 мг (для ампул 10 мл)
Актовегин обладает тремя клиническими эффектами.

- Метаболический эффект. Препарат улучшает насыщение тканей кислородом. Он усиливает утилизацию кислорода и его поглощение тканями. Присутствующие в составе Актовегина фосфоолигосахариды способствуют улучшению углеводного обмена. Препарат положительно влияет на транспорт глюкозы и улучшает энергетический обмен в клетках. В условиях кислородного голодания тканей в них обычно образуется большое количество лактата. Это молочная кислота. Она усиливает разрушение тканей под действием гипоксии. Актовегин уменьшает количество лактата, чем защищает их от повреждений.
- Нейропротектор. Актовегин за счет нескольких механизмов действия защищает нервные клетки от разрушения. Препарат предотвращает апоптоз (запрограммированную гибель клеток). Он также угнетает факторы воспаления в центральной и периферической нервной системе. Ещё один механизм нейропротекторного действия связан с воздействием на фермент PARP. Он восстанавливает повреждения ДНК, но при чрезмерной активности провоцирует гибель клеток при сосудистых патологиях головного мозга и сахарном диабете (диабетической полинейропатии). Актовегин угнетает PARP, тем самым предотвращая отмирание нейронов.
- Стимулятор микроциркуляции. Актовегин является корректором микроциркуляции, потому что он способен увеличивать скорость кровотока в капиллярах. Он снижает тонус гладкомышечных структур артериол (мелких артерий, которые переходят в капилляры), благодаря чему стенки сосудов расслабляются и расширяются. Доступ крови к тканям улучшается. Актовегин стимулирует выработку в эндотелии оксида азота, что тоже способствует расширению сосудов.
Эффект от препарата развивается через 30 минут после приема таблетки. Максимальный эффект – через 3-6 часов. При парентеральном (внутривенном) введении Актовегина действует он раньше. Максимальный эффект развивается не позднее, чем через 3 часа после введения.
Фармакодинамика препарата изучена недостаточно. Невозможно проследить, как распределяются и выводятся компоненты гемодеривата телячьей крови. Потому что все вещества в составе препарата – физиологические. Они присутствуют и вырабатываются в организме человека.
Показания
Согласно инструкции по применению Актовегин имеет такие показания:
- Диабетическая полинейропатия. Препарат используется для уменьшения симптомов этого позднего осложнения сахарного диабета, связанного с гибелью нервных клеток.
- Когнитивные нарушения. В том числе Актовегин может использоваться при деменции (приобретенной олигофрении) и состояниях после инсульта. Исследования показали, что препарат за счет нейропротекторного эффекта и улучшения циркуляции крови в головном мозге повышает когнитивные функции.
- Расстройства периферического кровообращения. Актовегин используется для улучшения кровоснабжения тканей. Он также может назначаться для устранения последствий расстройств циркуляции крови.
В инструкции не описан репаративный эффект Актовегина. В числе показаний отсутствуют длительно незаживающие раны. Тем не менее, на практике врачи очень часто назначают препарат для стимуляции регенерации тканей. Его используют после травм и операций, чтобы ускорить заживление повреждений. Потому что темпы регенерации напрямую зависят от интенсивности кровотока в пораженной области. Чем лучше циркуляция крови, тем быстрее восстанавливаются поврежденные ткани. Актовегин улучшает микроциркуляцию. Соответственно, он усиливает и репаративные процессы.
Безопасность Актовегина при беременности
Актовегин применяется в основном в странах СНГ, включая Россию, и некоторых азиатских государствах. Потому не известно, насколько он безопасен. В Европе препарат имеет ограниченное применение и не одобрен в качестве лекарственного средства. В США и Канаде он и вовсе запрещен. Препарат нельзя импортировать и продавать в этих странах. Несмотря на это, в России Актовегин даже при беременности достаточно часто назначается врачами.
Производителем препарата является Takeda Pharmaceutical. Производится он в Германии и Швейцарии. Несмотря на это, основным рынком сбыта лекарственного средства являются рынки стран СНГ, куда уходит около 70% произведенного Актовегина.

Основные опасения западных стран связаны с тем, что препарат изготавливается из крови. Тем не менее, побочные эффекты после его приема наблюдаются крайне редко. Профиль безопасности у этого препарата достаточно высокий. Из побочных эффектов возможны разве что аллергические реакции на компоненты Актовегина, но они могут возникнуть на любые лекарства.
Передозировка практически невозможна. Исследования показали, что даже увеличение средней терапевтической дозы в десятки раз не приводит к негативным последствиям. Случаи передозировки Актовегина, в том числе при беременности, до настоящего времени не известны.
В инструкции по применению указано, что Актовегин при беременности должен быть использован с осторожностью. Его применяют только в тех случаях, когда ожидаемая польза превышает риски для матери и плода, связанные с применением препарата. Тем не менее, на практике его назначают на любых сроках беременности. Случаи осложнений, связанных с Актовегином, не известны. Этот препарат неоднократно упоминается в российских клинических рекомендациях для врачей акушеров-гинекологов как средство для улучшения маточно-плацентарного и плодово-плацентарного кровотока.
Зачем назначают Актовегин при беременности?
Основным показанием к назначению Актовегина при беременности является фетоплацентарная недостаточность. Это состояние часто приводит к гипоксии (кислородному голоданию) плода. Оно является одним из самых частых осложнений беременности и может развиться на любом её сроке. Назначение Актовегина в комплексе с другими лекарственными препаратами позволяет предотвратить патологические изменения в тканях плода и пролонгировать беременность до того срока, когда можно будет провести родоразрешение без риска для ребенка. Обычно Актовегин при беременности в случае плацентарной недостаточности назначается в комбинации с бета-адреномиметиками и антиагрегантами.
Способы применения и дозы
Актовегин выпускается в двух формах: раствор для парентерального введения и таблетки.
После инсульта препарат назначается через неделю. Суточная доза – 2 грамма. Вначале Актовегин вводится парентерально. Его вливают внутривенно капельно. После проведения 10-20 инфузий переходят на таблетки. Суточная доза – 1,2 грамма. Это 6 таблеток. Их нужно использовать в 3 приема (по 2 таблетки за один раз). Курс лечения длится полгода.
При диабетической полинейропатии препарат назначают внутривенно капельно, по 2 грамма в сутки. После проведения 20 инфузий переходят на таблетки. Их назначают в суточной дозе 1,8 г. Это 9 таблеток. Их нужно принять в 3 приема (по 3 таблетки на прием). Курс лечения длится 4-5 месяцев.
При деменции Актовегин назначается в таблетках. Суточная доза – 1,2 г в день. Это 6 таблеток, которые пациент принимает по 2 штуки, 3 раза в день.
Актовегин при беременности назначают главным образом с целью улучшения маточно-плацентарного и плодово-плацентарного кровообращения. В этом случае препарат может использоваться в различных дозировках, по разным схемам. При отсутствии токсикоза и рвоты могут применяться таблетки. Суточная доза – от 3 до 6 таблеток. Курс лечения обычно длится 1-1,5 месяца. В первые 5 дней Актовегин при беременности в случае фетоплацентарной недостаточности часто назначается внутривенно, так как в этом случае препарат действует быстрее.
Противопоказания
У Актовегина практически нет противопоказаний. В их числе лишь детский возраст, потому что препарат не исследовался на детях, а также непереносимость компонентов. Это могут быть аллергические реакции или генетические заболевания, связанные с ферментной недостаточностью. Таблетки Актовегин содержат в качестве вспомогательных веществ фруктозу, галактозу, сахарозу, изомальтозу. В случае непереносимости этих углеводов принимать препарат не рекомендуется.
Таблетки Актовегин обходятся покупателю в 1600 рублей за 50 штук. В каждой содержится 200 мг действующего вещества. Принимают препарат обычно по 6 таблеток в сутки. Соответственно, на месяц лечения требуется 180 таблеток. Стоимость месячного курса составляет около 3 тысяч рублей.
Подписаться на рассылку
Я принимаю условия Пользовательского соглашения и даю согласие на обработку своих персональных данных
Актовегин в инъекциях представлен в двух разных упаковках. 25 ампул по 2 мл стоят 1650 рублей. За 5 ампул по 5 мл обходятся в 650 рублей. Обычно инъекционно препарат вводят 5-10 дней. Стоимость курса – от 5 до 10 тысяч рублей. Она зависит от назначенной врачом дозы Актовегина. Покупать большие ампулы по 5 мл выгоднее по цене.

- Солкосерил
- Курантил
- Дипиридамол
- Альгофин
- Церебролизин
- Мемория
- Ноотропил
Использование при гестозах и плацентарной недостаточности
При гестозе ухудшается кровообращение. Его нужно восстановить, для чего и назначают актовегин при беременности в таблетках. В настоящее время гестозы остаются одной из основных причин материнской смертности.
Препарат может быть использован и для профилактики осложнений. Его назначают при преэклампсии легкой степени и первых признаках фетоплацентарной недостаточности. При этом две трети пациенток достигают стойкой ремиссии осложнения. Симптомы регрессируют быстрее на несколько дней, роды с высокой вероятностью проходят без осложнений, уменьшается риск преждевременного рождения ребенка.
По данным УЗИ актовегин при беременности улучшает показатели кровотока в системе мать-плод, для чего этот препарат и назначают. Именно с этим фактом связывают уменьшение рисков неблагоприятных исходов беременности.
Благоприятное влияние препарата на плод:
- уменьшается риск задержки внутриутробного развития;
- пролонгируется беременность;
- лучше функциональные показатели плода при пролонгации беременности в случае угрозы преждевременных родов;
- уменьшается риск гипоксического поражения центральной нервной системы плода за счет улучшения плацентарного кровотока;
- ниже риск гипогликемии у недоношенных новорожденных.
Использование при антифосфолипидном синдроме
Антифосфолипидный синдром повышает риск образования тромбов. Риск тромботических осложнений у беременных повышается. Поэтому своевременная их профилактика – важнейшая задача акушера-гинеколога.
При АФС вырабатываются антитела фосфолипидсвязывающим белкам крови. Он может быть первичным или вторичным. Первый развивается на фоне системной красной волчанки или другого аутоиммунного процесса. Вторичный АФС – следствие инфекции или приема препаратов. В клинической практике их не делят, потому что терапевтическая тактика одинаковая.
При АФС и возникающем тромбозе ткани страдают в результате таких механизмов:
Поэтому в комплексное лечение включают препараты из группы антигипоксантов и антиоксидантов. Одним из таких средств является актовегин. Он улучшает утилизацию тканями кислорода, снижает потребность в нём за счет улучшения аэробной продукции энергии в клетке. Одновременно улучшается анаэробный обмен в эндотелии сосудов. Этот эффект дополняется высвобождением эндогенных вазодилятаторов (веществ, расширяющих сосуды) – простациклина и оксида азота. При использовании Актовегина при беременности повышается сосудистое сопротивление и улучшается перфузия органов беременной.
В литературе описаны случаи успешного применения препарата не только при АСФ, но также при других ревматических заболеваниях: ревматоидном артрите и подагре. Многие гинекологи назначают его в качестве средства дополнительной терапии при антифосфолипидном синдроме. Препарат вводят в основном внутривенно. Преимуществом средства является отсутствие побочных эффектов. Актовегин при беременности используют в течение 10 дней. За этот срок отмечается:

- улучшение самочувствия;
- устранение головных болей;
- исчезновение трофических язв кожи.
Если язвы не заживают, Актовегин может быть использован внутрикожно в очаг поражения. Делают 5 уколов в дозе 0,2 мл. Обкалывают кожу по периферии язвы, на расстоянии 1 см от края. Процедуру проводят через день. Положительные эффекты отмечаются уже после первого введения, спустя сутки. Отмечается краевая эпителизация язвы, которая распространяется на 2-3 мм дальше места введения препарата.
Актовегин используется и при тяжелых проявлениях АФС. Его применяют при некротических процессах в костях и суставах. Вводят препарат под контролем УЗИ внутрикостно, в область некроза. Это способствует уменьшению болей, в том числе ночных. Уколы делают 1 раз в 3 дня. Всего проводят 5 инъекций. Эффект объясняется декомпрессией кости в зоне введения средства и усилением репаративных процессов.
Таким образом, Актовегин может использоваться для предотвращения трофических нарушений или их обратного развития. Преимуществом средства является обеспечение комплексного воздействия за счет разных форм выпуска. Средство может приниматься в таблетках, вводится в внутривенно и местно, непосредственно в очаг поражения.
Эффект является дозозависимым. Суточная доза должна составлять не меньше 1 грамма. Внутривенно вводят по 1-2 грамма в сутки, в течение 10 дней. Затем переходят на таблетки. Их принимают по 6 таблеток (1,2 грамма) в сутки, курсом 20 дней. В случае диабета 2 типа продолжать препарат нужно курсом до 5 месяцев.
Читайте также:
- В документах оон указывается что толерантность является моральным долгом правовой и политической пот
- Как расторгнуть договор с альянс телеком
- Форекс дилер вправе заключать договоры с физическими лицами в отношении
- Приказы об ответственности за рб отнесении к группе а
- Учет как вид систематизации нормативно правовых актов

