Синтез белка в клетке осуществляют где
Обновлено: 30.06.2024
Биосинтез белка — сложный многостадийный процесс синтеза полипептидной цепи из аминокислот, происходящий на рибосомах с участием молекул мРНК и тРНК. Процесс биосинтеза белка требует значительных затрат энергии.
Введение
Биосинтез белка происходит в два этапа. В первый этап входит транскрипция и процессинг РНК, второй этап включает трансляцию. Во время транскрипции фермент РНК-полимераза синтезирует молекулу РНК, комплементарную последовательности соответствующего гена (участка ДНК). Терминатор в последовательности нуклеотидов ДНК определяет, в какой момент транскрипция прекратится. В ходе ряда последовательных стадий процессинга из мРНК удаляются некоторые фрагменты, и редко происходит редактирование нуклеотидных последовательностей. После синтеза РНК на матрице ДНК происходит транспортировка молекул РНК в цитоплазму. В процессе трансляции информация, записанная в последовательности нуклеотидов переводится в последовательность остатков аминокислот.
Процессинг РНК
Между транскрипцией и трансляцией молекула мРНК претерпевает ряд последовательных изменений, которые обеспечивают созревание функционирующей матрицы для синтеза полипептидной цепочки. К 5΄-концу присоединяется кэп, а к 3΄-концу поли-А хвост, который увеличивает длительность жизни иРНК. С появлением процессинга в эукариотической клетке стало возможно комбинирование экзонов гена для получения большего разнообразия белков, кодируемым единой последовательностью нуклеотидов ДНК, — альтернативный сплайсинг.
Трансляция
Готовая белковая молекула затем отщепляется от рибосомы и транспортируется в нужное место клетки. Для достижения своего активного состояния некоторые белки требуют дополнительной посттрансляционной модификации.
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 12 мая 2011.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Биосинтез белка" в других словарях:
Биосинтез белка — В обмене веществ организма ведущая роль принадлежит белкам и нуклеиновым кислотам. Белковые вещества составляют основу всех жизненно важных структур клетки, они входят в состав цитоплазмы. Белки обладают необычайно высокой реакционной… … Биологическая энциклопедия
биосинтез белка — совокупность реакций полимеризации аминокислот в полипептидную цепь молекулы белка, протекающих в клетках на специализированных органеллах рибосомах; нарушение Б. б. лежит в основе многих болезней человека, животных и растений … Большой медицинский словарь
Биосинтез — процесс синтеза природных органических соединений живыми организмами. Путь биосинтеза соединения это приводящая к образованию этого соединения последовательность реакций, как правило, ферментативных (генетически детерминированных), но изредка… … Википедия
биосинтез — [тэ], а; м. Образование различных органических веществ в живых организмах. Б. белка. Механизм биосинтеза. * * * биосинтез образование необходимых организму веществ в живых клетках с участием биокатализаторов ферментов. Обычно в результате… … Энциклопедический словарь
биосинтез — (тэ) а; м. Образование различных органических веществ в живых организмах. Биоси/нтез белка. Механизм биосинтеза … Словарь многих выражений
Рибосомный биосинтез — * рыбасомны біясінтэз * ribosomal biosynthesis сборка рибосомных частиц из РНК и белковых компонентов. У эукариот и прокариот координируется т. обр., что не накапливается ни избыток белка, ни избыток нуклеиновых кислот. У E. coli синтез белков… … Генетика. Энциклопедический словарь
Белки — У этого термина существуют и другие значения, см. Белки (значения). Белки (протеины, полипептиды[1]) высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа аминокислот. В живых организмах… … Википедия
Белки — I Белки (Sciurus) род млекопитающих семейства беличьих отряда грызунов. Распространены в лесах Европы, Азии и Америки. Около 50 видов. Приспособлены к древесному образу жизни. Длина тела до 28 см. Мех обычно густой, у некоторых пушистый.… … Большая советская энциклопедия

В видеоуроке рассказывается о строении белков. Описываются этапы биосинтеза белка. Рассказывается о том, как происходят транскрипция и трансляция. В данном уроке приводятся следующие понятия: геном, генетический код, кодон, структурные гены, терминатор, полисома.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности



Конспект урока "Синтез белков в клетке"
Получаемые с пищей белки, жиры и углеводы в организме распадаются на более простые вещества, а затем из них уже строятся необходимые организму высокомолекулярные соединения (белки, нуклеиновые кислоты, полисахариды и липиды). Этот процесс называется ассимиляцией или пластическим обменом.

Однако самым важным процессом ассимиляции все же является синтез белков. Так как белки в организме выполняют достаточно много функций их роль чрезвычайно разнообразна.
Клетки нашего организма содержат тысячи белков. В процессе жизнедеятельности все белки рано или поздно разрушаются. И для нормального хода всех реакций они должны синтезироваться вновь.
За обедом вы съели какую-либо белковую пищу (мясо, рыбу или творог, например).
В организме поступившие с пищей белки расщепляются.
Под влиянием ферментов в двенадцатиперстной кишке завершается начавшееся в желудке расщепление белков до аминокислот.

Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят (аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин).

А незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей.
Это (валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин). Содержатся они в основном в продуктах животного происхождения.

Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков.
Их называют (протеиногенными аминокислотами или стандартными). Однако, в организме человека обнаружено около 40 непротеиногенных аминокислот.
Для удобства названия аминокислот имеют общепринятые сокращения.

Аминокислоты соединяются между собой благодаря пептидной связи. Так образуется молекула, которая представляет собой дипептид.

Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом – свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
В состав белков могут входить не только аминокислоты. Если белок содержит компоненты неаминокислотной природы, то такой белок относят к сложным. Простые белки состоят только из аминокислот.
Итак, мы сказали, что в двенадцатиперстном кишечнике происходит окончательное расщепление белков до аминокислот.
Затем аминокислоты в виде водных растворов всасываются в кровь капиллярами ворсинок тонкого кишечника.

Кровеносные сосуды, отходящие от кишечника поступают в воротную вену.
Которая собирает кровь от желудка, селезёнки, кишечника в печень.

Печень играет важную роль в обмене белков. Наибольшее количество белка синтезируется в мышцах, однако в пересчёте на 1 г массы в печени их производится все же больше.

Здесь образуются не только собственные белки клеток печени, но и большое количество секретируемых белков, необходимых для нужд всего организма.
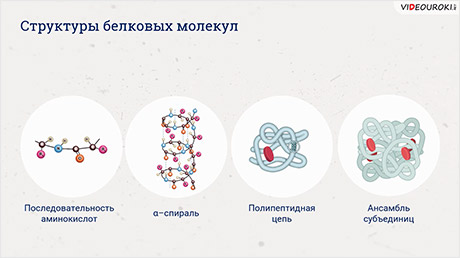
Функции белков зависят от их строения. От последовательности, аминокислот, которые составляют их основу.

После синтеза белки для, того чтобы осуществлять свои биологические функции, сворачиваются в одну или несколько особых пространственных конфигураций.
Приобретают вторичную, третичную и четвертичную структуру.
Однако изначально, когда они только синтезировались белки имеют первичную структуру.
Первичная структура белка представлена определённой последовательностью аминокислот, которые связаны между собой пептидной связью.

В какой последовательности должны располагаться аминокислоты?

Информация о первичной структуре белков закодирована в последовальности нуклеотидов в молекуле двухцепочечной ДНК. Эта информация называется генетической информацией.
А участок ДНК, в котором содержится информация о первичной структуре одного белка, называется геном.

Генетический код.
В состав нуклеотидов входят азотистые основная.
У ДНК четыре разных азотистых основания: аденин (А), тимин (Т) гуанин (Г) и цитозин (Ц).

3 нуклеотида (триплет) кодируют 1 аминокислоту.

А какую именно аминокислоту можно понять по последовательности этих самых нуклеотидов.
На сегодняшний день уже известно какие триплетные сочетания нуклеотидов ДНК соответствуют той или иной из 20 аминокислот, входящих в состав белков.

Однако изначально информация с ДНК переписывается на информационную (матричную) РНК в виде триплетов – кодонов.
Определённые кодоны как вы видите соответствуют определённым аминокислотам.

Однако, многим аминокислотам соответствует не один, а несколько различных триплетов – кодонов.
Считается что такое свойство генетического кода повышает надёжность хранения и передачи генетической информации при делении клеток.
Например, аминокислоте аланину соответствует 4 кадона. ГЦУ, ГЦЦ, ГЦА и ГЦГ.
Первые два азотистых основания у всех триплетов одинаковы. Поэтому даже если произойдёт случайная ошибка в третьем нуклеотиде, то все равно это будет кодон аланина.
Важное свойство генетического кода — это специфичность. То есть один триплет будет обозначать только одну аминокислоту.

Итак, мы сказали, что в последовательности нуклеотидов молекулы ДНК закодирована информацию о первичной структуре белка.
Как же получить эту информацию?
Сначала генетической информация с ДНК переносится на информационную (матричную) РНК, этот процесс называется транскрипцией.
Давайте посмотрим каким образом происходит этот перенос.
Списывание генетической информации осуществляет фермент РНК-полимераза.

РНК полимераза узнает специфическую последовательность нуклеотидов, называемая промотером. Благодаря промотору синтез иРНК начинается с нужного участка цепи ДНК.
Перед промотером располагаются структурные гены, которые несут информацию о структуре иРНК.
РНК-полимераза производит цепочку иРНК с сайта инициации стартового кодона кодирующей области.
Процесс наращивания молекулы РНК нуклеотидами называется элонгацией.
Именно с промотора РНК-полимераза начинает расплетать двуспиральную ДНК и синтезировать информационную РНК по ДНК.
И по мере движения РНК-полимеразы по матрице впереди неё происходит расплетание, а позади — восстановление двойной спирали ДНК.
Тем самым РНК-полимераза по принципу комплементарности копирует одну из двух цепочек.
Вы помните, что по принципу комплементарности аденин соединяется только с тимином двумя водородными связями. А гуанин соединяется только с цитозином тремя водородными связями. Таким образом, нуклеотиды образуют пары.
По тому же принципу синтезируется и информационная РНК: против Цитозина молекулы ДНК становиться Гуанин молекулы РНК, против Тимина –Аденин. Против гуанина цитозин. А против аденина молекулы ДНК – урацил РНК.
Так РНК-полимераза синтезирует иРНК до тех пор, пока она не встретит определённую последовательность нуклеотидов, которая называется терминатором. Терминатор является знаком препинания, он указывает на то что синтез РНК следует прекратить.

Так формируется цепочка иРНК, которая представляет собой точную копию цепочки ДНК (только вместо тимина включён урацил).
Синтезированная информационная РНК выносит списанную генетическую информацию из ядра в цитоплазму. Где и будет происходит синтез белка.
С этого момента наступает следующий этап синтеза – его называют трансляцией.

Как мы уже говорили выше белки необходимые организму строятся из аминокислот. Которые были либо синтезированы самим организмом, либо получены с пищей.
Так вот эти аминокислоты попали в клетки с током крови. Теперь они находятся в цитоплазме.
Наступает трансляция перевод последовательности нуклеотидов молекулы иРНК в последовательность аминокислот молекулы белка.
Информационная РНК переместилась из ядра в цитоплазму. Здесь в цитоплазме её встречают рибосомы.
Вы помните, что рибосома состоит из малой и большой субъединицы.

Сперва к информационной РНК к (кодону АУГ, который сигнализирует о начале цепи) присоединяется малая субъединица рибосомы.
Так как кодон АУГ кодирует аминокислоту метионин, то все белки начинаются с метионина. За исключением некоторых случаев.
Когда присоединяется большая субъединица в рибосоме формируется пептидильный (или П-участок) и аминоацильный (или А-участок).

Аминокислоты, которые плавают в цитоплазме поступают в рибосому при помощи ещё одной специализированной РНК её называют транспортная РНК или тРНК.
Эти небольшие молекулы, способны сворачиваться таким образом, что образуют структуры, напоминающие по форме клеверный лист. В клетке имеется столько же разных тРНК, сколько кодонов, шифрующих аминокислоты.
Одна т-РНК несёт 1 аминокислоту. Однако т-РНК может захватить не любую аминокислоту, а строго определённую.

На вершине "листа" каждой тРНК имеется последовательность трёх нуклеотидов, их называют антикодоном. Данный антикадон взаимосоответствует, то есть комплементарен кодону в информационной РНК с которым он связывается. И соответствует той аминокислоте, которую он переносит.
Так первая аминокислота поступает в П-участок рибосомы.
Между аминокислотами формируется пептидная связь.
Первая транспортная РНК уходит, и рибосома продвигается дальше. А очередная т-РНК подносит необходимую аминокислоту, наращивающую растущую цепочку белка.
Эта операция повторяется столько раз, сколько аминокислот должен содержать строящийся белок.

Аминокислоты, которые поднесли т-РНК формируются в полипептидную цепочку.
После завершения синтеза цепи, полипептид высвобождается из рибосомы.
Чтобы принять обычную форму, белок должен свернуться, образуя при этом определённую пространственную конфигурацию. Это происходит в цистернах аппарата Гольджи. Белки созревают, а затем они доставляются к месту своего назначения.
Любой полипептид можно полностью задать словом, длина которого равна количеству аминокислотных остатков и в котором используется 20 букв, каждая из которых соответствует одной аминокислоте.
Этот простой, "буквенный" способ хранения и передачи информации задействован в живых организмах – вся информация о первичной структуре белков содержится в ДНК, а её главная функция как раз и состоит в хранении и передаче именно этой информации.
Так как белки в организме выполняют много функций они являются и гормонами и ферментами, то их необходимо достаточно много.
Поэтому, как только рибосома продвигается вперёд, за ней тут же на информационную РНК нанизывается следующая, которая будет синтезировать естественно тот же белок.
На одну и ту же иРНК может быть нанизана и третья и четвертая рибосома. Все рибосомы, синтезирующие белок на одной молекуле иРНК называются полисомой.

Когда этого белка для организма на данный момент достаточно, рибосома находит другую информационную РНК которая содержит информацию о каком-то другом белке.
Таким образом, последовательность аминокислот в первичной структуре белка не зависит от рибосом, а определяется только последовательностью нуклеотидов иРНК.

Партнер номинации — компания Cytiva.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Молекулярный аппарат трансляции и его консервативность
Трансляционный цикл на множестве этапов может быть нарушен или замедлен многочисленными и разнородными по химическому строению ингибиторами. Ключевые компоненты трансляционного аппарата клетки — это рибосомы и факторы трансляции (белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла), а также большое количество вспомогательных белков, необходимых для обеспечения синтеза нужными материалами: например, аминоацил-тРНК-синтетазы (АРСазы) — ферменты, соединяющие тРНК с соответствующей ей аминокислотой; или регуляторы биосинтеза белка — компоненты сигнальных путей, связанных с трансляцией. При подборе ингибиторов нельзя не учитывать, что многие из этих молекул есть у всех живых организмов, и некоторые из них довольно консервативны. А значит, одни и те же вещества могут действовать как на про-, так и на эукариот, что не всегда приемлемо.
Каждый живой организм на Земле может быть отнесен к одному из трех доменов жизни: это максимально удаленные друг от друга в эволюционном смысле группы — эукариоты (здесь ищите самые известные царства: животных, растений и грибов), бактерии и археи [2]. Эта удаленность означает, что они давно разошлись (то есть их последний общий предок жил давно [3]), и у представителей групп накопилось множество отличий. Но есть и признаки, по которым представители различных доменов похожи друг на друга. Речь идет об основополагающих признаках: например, способности удваивать ДНК, синтезировать на ее основе РНК и в конце концов получать закодированный в ней белок. Трансляция относится к самым консервативным биологическим процессам.
При ближайшем рассмотрении оказывается, что устройство белоксинтезирующего аппарата довольно схоже у представителей разных доменов. К примеру, основные факторы инициации и элонгации у бактерий имеют гомологов у архей, а рибосомы архей по многим аспектам строения очень напоминают рибосомы эукариот (что даже позволило создать из рибосом дрожжей гибридные рибосомы, в которых одна из субъединица очень напоминала рибосомную субъединицу архей [4]). В пределах этих трех доменов есть отличия, но мы видим, что трансляционная машинерия в целом очень консервативна, и таких отличий не так много. Это является несомненным свидетельством общности (монофилетичности) происхождения жизни.
Ингибиторы трансляции как антибиотики
Чаще всего исследователям приходится подбирать ингибиторы биосинтеза белка у бактерий и заботиться о том, чтобы они не действовали на эукариот, так как это позволяет применять такое вещество в качестве антибиотика. Больше половины используемых сейчас антибиотиков подавляет именно трансляцию, действуя на рибосому , [5]. И здесь на первый план зачастую выходят те тонкие различия, которые все-таки можно отыскать в строении аппарата трансляции у представителей разных доменов.
Трансляционный цикл
Схема может показаться сложной, но в действительности это не так. Попробуйте выхватить взглядом желтую 40S-субъединицу (в свободном от других компонентов трансляции виде ее можно найти рядом со стадией i.1) и пройтись по циклу, как в настольной игре, посмотрев на все, что успевает с ней за это время произойти. Особенно любознательным предлагаем покликать по элементам схемы и прочитать о каждом из этапов дополнительно.
Этапы трансляции
Трансляционный цикл принято подразделять на несколько этапов:
Отдельно происходит активация аминокислот с помощью аминоацил-тРНК-синтетаз (см. e.1 на рисунке 1).
Некоторые трансляционные факторы известны уже очень давно, для них понятна функция, известны ортологи у архей и бактерий (подробнее про гомологичные взаимоотношения генов можно прочитать здесь [7]) и выяснено, являются ли они строго необходимыми для синтеза белка — ведь некоторые вирусные мРНК, например, могут обходиться без целого ряда факторов инициации трансляции [8], [9]. Роль других участников была открыта относительно недавно. Примером таких белков служат факторы DENR и MCTS1 (см. область рециклинга (r) на рисунке 1), изучением которых, кстати, занимается наша лаборатория.
На рисунке 1 (см. s.1, s.2) также изображена часть путей внутриклеточного сигналинга, которые непосредственно регулируют трансляцию. Кроме того, существует еще и сложнейший процесс сборки рибосомы из рибосомной РНК и белков, который протекает по большей части в ядре. Его также можно подавить низкомолекулярными веществами, но о них известно гораздо меньше, а их специфичность часто оставляет желать лучшего.
Типы ингибиторов
С ингибиторами трансляции удобно знакомиться, если классифицировать их согласно мишеням, на которые они воздействуют.
Ингибиторы эукариотической рибосомы
Многие из ингибиторов действуют на рибосомы. При этом они могут быть универсальными (подавлять трансляцию у всех доменов живого), а могут — специфичными (например, к рибосоме эукариот или даже каких-то узких таксономических групп). Специфичность действия, как правило, определяется тонкими различиями в строении места связывания: структурные исследования показывают, что часто достаточно замены одного нуклеотида в рРНК или разницы в единственной аминокислотной позиции рибосомного белка, чтобы конфигурация участка не позволяла ингибитору связаться. Подавляющее большинство ингибиторов рибосомы действует на стадии элонгации, однако существуют и другие типы, перечисленные в таблице 1 (заметьте, что пункты могут перекрываться).
Если классифицировать по сайтам связывания, то выделяют: ингибиторы пептидилтрансферазного центра; ингибиторы транслокации, узнающие E-сайт; ингибиторы, связывающиеся в пептидном тоннеле; ингибиторы, взаимодействующие с декодирующим центром; ингибитор, связывающийся с ГТФаза-активирующим центром (пока достоверно описан только один такой пример).
Пока не так много веществ этого типа допущены до практического применения (самое известное из них — гомохаррингтонин (рис. 2)), но их число постепенно растет. Клинические и доклинические испытания проходили, например, такие ингибиторы пептидилтрансферазного центра, как ликорин, нарциклазин и бруцеантин, а ингибитор транслокации эметин используется как антигельминтное и противомалярийное средство.
Интересные случаи применения
Гомохаррингтонин. Рибосом-направленные ингибиторы элонгации
Гомохаррингтонин — ингибитор пептидилтрансферазного центра в виде полусинтетического аналога омацетаксина мепесукцината (продаваемого под торговой маркой Synribo; рис. 2) активно применяется для лечения хронического миелоидного лейкоза, а также проходит испытания в терапии ряда других онкологических заболеваний. Кроме того, его широко используют в научной работе: его способность прекращать трансляцию новоинициировавших рибосом (при этом не трогая рибосомы, которые уже успели синтезировать несколько пептидных связей) применяется для картирования старт-кодонов в мРНК.
Аталурен и гентамицин. Вещества, вызывающие ошибки декодирования
Рисунок 4. Гентамицин. Пока что препарат прошел клинические испытания только как антибиотик, однако у его производных есть потенциал и в терапии генетических заболеваний. Препарат, продаваемый в аптеках, представляет собой смесь более четырех похожих веществ. Его стоимость куда ниже, чем у аталурена: купить тюбик мази для наружного применения можно за 40 рублей. Однако в нынешнем виде гентамицин нельзя принимать в дозах, достаточных для устранения эффектов нонсенс-мутаций: из-за воздействия на рибосомы митохондрий он имеет побочные эффекты в виде нефро- и ототоксичности.
Чтобы понять, как именно ингибиторы могут подавлять активность рибосомы, полезно вспомнить ее общее строение. Это удобно сделать с помощью интерактивного аплета (см. рис. 5).
Рисунок 5. Пристальный взгляд на эукариотическую рибосому. В верхней кнопочной панели можно изучить структурные элементы рибосомы. Для того чтобы узнать о структурном элементе или сайте связывания, наведите курсор на кнопку. В нижней панели можно найти распространенные ингибиторы, которые действуют на разные части эукариотической рибосомы, визуализированные в предыдущем разделе. В виде на лиганд взаимодействующие основания выделены оранжевым. Встроенный в статью этот апплет очень маленький, поэтому рекомендуем открыть полноэкранную версию.
- Чтобы увидеть лиганд-белковые взаимодействия, можно кликнуть на лиганд в режиме его просмотра.
- Из-за большого размера структур и их сложности для просмотра рекомендуется пользоваться компьютером со стабильным подключением.
- При переходе между видом рибосомы и видом на лиганд структура перезагружается.
- К сожалению, выделение структурных элементов из прошлого раздела в структурах с ингибиторами не поддерживается.
- В будущем рисунок будет совершенствоваться, при клике на хищную рибосому читатель может найти более совершенную версию, которая периодически обновляется.
Для показа структурных элементов использована структура дрожжевой рибосомы, полученная методом криоэлектронной микроскопии группой Р. Бекманна (6SNT). Для визуализации используется веб-плагин MolStar.
Ингибиторы трансляционных факторов
Трансляционные факторы — белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла. Чаще всего эти факторы жизненно необходимы для нормального синтеза белка в клетках или митохондриях/пластидах, которые, как правило, тоже имеют свой трансляционный аппарат.
Эта группа веществ взаимодействует с факторами в растворе, блокируя их активность или препятствуя присоединению к рибосоме (во втором случае они могут контактировать не только с фактором, но и с рибосомой, что приводит к неоднозначности в классификации: иногда их относят к ингибиторам рибосомы).
Ингибиторы факторов инициации трансляции
Инициация трансляции в эукариотических клетках устроена сложнее, чем у бактерий: факторов инициации здесь больше, и многие из них являются эукариот-специфичными. Поэтому и набор мишеней для ингибиторов довольно разнообразен. Со всем многообразием факторов инициации и их набором у трех доменов живого удобно ознакомится в таблице 2.
* — IF3 бактерий не гомологичен a/eIF1, но очень похож на него по пространственной структуре.
** — Каталитические γ- и ε-субъединицы у архей отсутствуют, поэтому вопрос о наличии целостного aIF2B и даже об участии остальных субъединиц в трансляции неясен: на этот счет в научной литературе до сих пор ведутся споры.
Ингибиторы факторов элонгации
На данный момент известно большое количество ингибиторов фактора eEF2 (транслоказы), однако некоторые вещества действуют и на eEF1A, доставляющий аминоацил-тРНК. Бóльшая часть и тех, и других препятствует диссоциации факторов с рибосомы после гидролиза ГТФ, что блокирует цикл элонгации. Некоторые их этих ингибиторов (сордарин и его производные) обладают специфичностью к eEF2 грибов, но не связываются с фактором из человеческих клеток, что позволяет использовать их в качестве противогрибковых средств. Среди известных веществ из этой категории нельзя не упомянуть плитидепсин (аплидин), который, согласно работе, недавно опубликованной в журнале Science, показывает хорошие результаты в борьбе с вирусом SARS-CoV-2 [15].
Ингибиторы аминоацил-тРНК-синтетаз
Помимо рибосом и фактор-направленных ингибиторов, специфичное влияние на биосинтез белка могут оказывать вещества, блокирующие вспомогательные компоненты трансляционной машинерии — в первую очередь ингибиторы аминоацил-тРНК-синтетаз (АРСаз). Фундаментальной основой трансляции является генетический код (соответствие между триплетами нуклеотидов и аминокислотами). Осуществляют это соответствие не столько рибосома (хотя в ее функции, разумеется, входит контроль правильного декодирования триплетов — то есть соответствия тРНК кодону в мРНК), сколько АРСазы, навешивающие аминокислотный остаток на нужную тРНК. Из примерно 20 аминоацил-тРНК-синтетаз эукариот (точное их число может варьировать от вида к виду) специфичные ингибиторы известны как минимум для семи.
При ингибировании АРСаз в клетке уменьшается концентрация Аа-тРНК, и темпы трансляции снижаются. От этого сильнее всего страдают клетки с высокой интенсивностью белкового синтеза — к примеру, иммунные и раковые. Поэтому ингибиторы АРСаз имеют важное медицинское значение: они обладают иммуносупрессорным эффектом и применяются при лечении опухолей. Их также используют в качестве фунгицидов и антималярийных препаратов. Большинство ингибиторов этого типа высокоспецифичны по отношению к конкретным АРСазам, однако вещество пурпуромицин препятствует присоединению аминокислотного остатка к любой тРНК. На рисунке 1 ингибиторы АРСаз обозначены e.1.
Ингибиторы сигнальных путей, связанных с регуляцией трансляции
Существует несколько сигнальных путей, которые тонко регулируют трансляцию на разных уровнях. Эти пути образуют сложную сеть и на схеме отображены лишь частично. Ключевые регуляторные каскады, контролирующие эффективность трансляции в клетке, — это пути PI3K/AKT/mTOR и MAPK/ERK/Mnk, а также набор киназ α-субъединицы фактора eIF2. Ингибиторы mTOR представляют особую ценность из-за выраженных комплексных эффектов на организм, у них множество применений в медицине: к примеру, они используются при лечении рака или как иммуносупрессоры при трансплантациях органов. Самый известный пример лекарств последнего типа — это рапамицин (сиролимус), который ингибирует один из двух комплексов киназы mTOR (mTORC1). С этим лекарством, а также с другими ингибиторами mTOR связаны и надежды на замедление темпов старения: показано, что некоторые из этих веществ ощутимо продлевают период здоровой жизни у мышей [16]. На рисунке 1: s.1–s.9.
Немного о научной группе
Наша лаборатория расположена в отделе взаимодействия вирусов с клеткой НИИ физико-химической биологии имени А.Н. Белозерского МГУ. Основные направления исследований — изучение механизмов биосинтеза белка, молекулярная вирусология и анализ возрастных изменений в живых организмах на молекулярном и клеточном уровне. В отделе работают несколько научных сотрудников, аспирантов и множество студентов, руководитель отдела — к.б.н. Сергей Дмитриев. В исследованиях мы применяем широкий арсенал методов молекулярной биологии, генной инженерии, биохимии, системной биологии и биоинформатики. Со списком публикаций отдела можно ознакомиться на сайте МГУ.
Рисунок 6. Структуры из нашей лаборатории. А пока можете посмотреть на структуры белков, которыми занимается лаборатория и которые были получены нашими партнерами с помощью рентгеноструктурного анализа и криоэлектронной микроскопии. Также вы можете открыть полноэкранную версию апплета.
Раздел ЕГЭ: 2.6. Генетическая информация в клетке. Гены, генетический код и его свойства. Матричный характер реакций биосинтеза. Биосинтез белка и нуклеиновых кислот
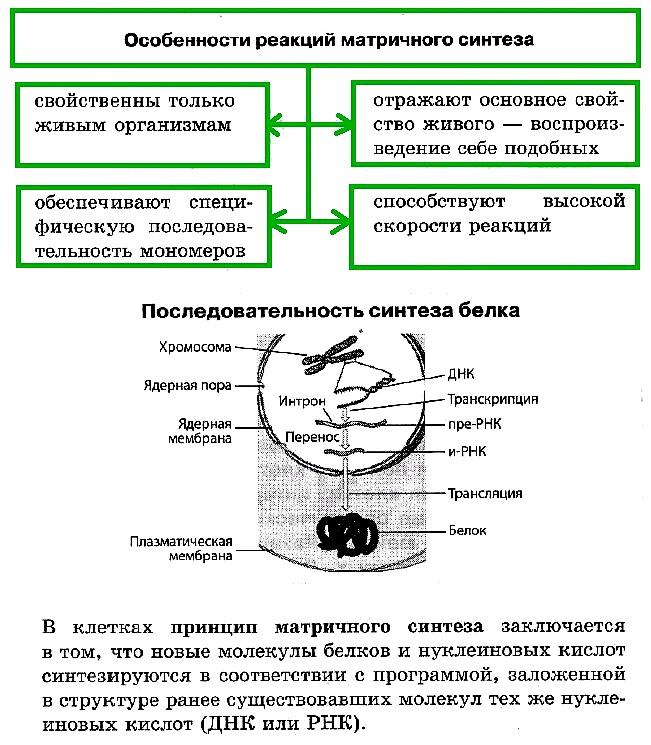
К реакциям матричного синтеза относят репликацию ДНК, синтез и-РНК на ДНК (транскрипцию) и синтез белка на и-РНК (трансляцию), а также синтез РНК или ДНК на РНК вирусов.
Биосинтез белка — это один из видов пластического обмена, в ходе которого наследственная информация, закодированная в генах ДНК, реализуется в определенную последовательность аминокислот в белковых молекулах. В биосинтезе белка выделяют два основных этапа: транскрипцию и трансляцию.
Репликация ДНК
Структура молекулы ДНК, установленная Дж. Уотсоном и Ф. Криком в 1953 г., отвечала тем требованиям, которые предъявлялись к молекуле-хранительнице и передатчику наследственной информации. Молекула ДНК состоит из двух комплементарных цепей. Эти цепи удерживаются слабыми водородными связями, способными разрываться под действием ферментов. Процесс удвоения ДНК происходит полуконсервативным способом: молекула ДНК расплетается, и на каждой из цепей синтезируется новая цепь по принципу комплементарности. Процесс самовоспроизведения молекулы ДНК, обеспечивающий точное копирование наследственной информации и передачу ее из поколения в поколение, называется репликацией.
Передача информации и синтез белка идут по матричному принципу, сравнимому с работой печатного станка в типографии. Информация от ДНК многократно копируется. Если при копировании произойдут ошибки, то они повторятся во всех последующих копиях. Правда, некоторые ошибки при копировании информации молекулой ДНК могут исправляться. Этот процесс устранения ошибок называется репарацией. Первой из реакций в процессе передачи информации является репликация молекулы ДНК и синтез новых цепей ДНК.
Репликация — это процесс самоудвоения молекулы ДНК, осуществляемый под контролем ферментов. На каждой из цепей ДНК, образовавшихся после разрыва водородных связей, при участии фермента ДНК-полимеразы синтезируется дочерняя цепь ДНК. Материалом для синтеза служат свободные нуклеотиды, имеющиеся в цитоплазме клеток.
Биологический смысл репликации заключается в точной передаче наследственной информации от материнской молекулы к дочерним, что в норме и происходит при делении соматических клеток.
Биосинтез белка и нуклеиновых кислот
В биосинтезе белка выделяют два основных этапа: транскрипцию и трансляцию.
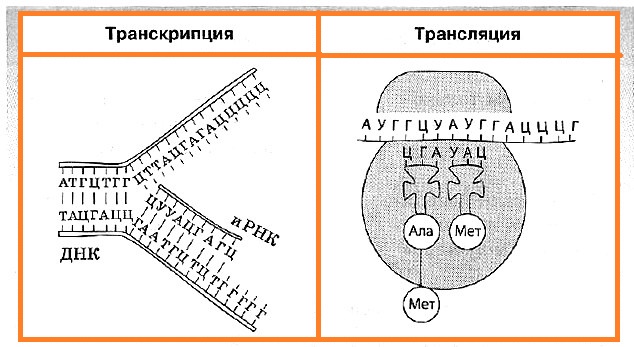
Транскрипция — это биосинтез молекул иРНК на соответствующих участках ДНК. Транскрипция происходит только на одной цепи ДНК, которая называется кодирующей, в отличие от другой — некодирующей, или кодогенной. Обеспечивает процесс переписывания специальный фермент РНК-полимераза, который подбирает нуклеотиды РНК по принципу комплементарности.
Синтезированные в процессе транскрипции в ядре молекулы иРНК покидают его через ядерные поры, а митохондриальные и пластидные иРНК остаются внутри органоидов. После транскрипции происходит процесс активации аминокислот, в коде которой аминокислота присоединяется к соответствующей свободной тРНК.
Трансляция — это биосинтез полипептидной цепи на молекуле иРНК, при котором происходит перевод генетической информации в последовательность аминокислот полипептидной цепи.
Второй этап синтеза белка чаще всего происходит в цитоплазме, например на шероховатой ЭПС. Для его протекания необходимы наличие рибосом, активация тРНК, в ходе которой они присоединяют соответствующие аминокислоты, присутствие ионов Mg 2+ , а также оптимальные условия среды (температура, рН, давление и т. д.).
Для начала транскрипции (инициации) к молекуле иРНК присоединяется малая субъединица рибосомы, а затем по принципу комплементарности к первому кодону АУГ подбирается тРНК, несущая аминокислоту метионин. Лишь после этого присоединяется большая субъединица рибосомы. В пределах собранной рибосомы оказываются два кодона иРНК, первый из которых уже занят. К соседнему с ним кодону присоединяется вторая тРНК, также несущая аминокислоту, после чего между остатками аминокислот с помощью ферментов образуется пептидная связь.
Когда рибосома передвигается на один кодон иРНК, первая из тРНК, освободившаяся от аминокислоты, возвращается в цитоплазму за следующей аминокислотой, а фрагмент будущей полипептидной цепи как бы повисает на оставшейся тРНК. К новому кодону, оказавшемуся в пределах рибосомы, присоединяется следующая тРНК, процесс повторяется, и шаг за шагом полипептидная цепь удлиняется, то есть происходит ее элонгация.
Окончание синтеза белка (терминация) происходит, как только в молекуле иРНК встретится специфическая последовательность нуклеотидов, которая не кодирует аминокислоту (стоп-кодон). После этого рибосома, иРНК и полипептидная цепь разделяются, а вновь синтезированный белок приобретает соответствующую структуру и транспортируется в ту часть клетки, где он будет выполнять свои функции.
Трансляция является весьма энергоемким процессом, поскольку на присоединение одной аминокислоты к тРНК расходуется энергия одной молекулы АТФ, еще несколько используются для продвижения рибосомы по молекуле иРНК.
Репликация ДНК и синтез белка в клетке протекают по принципу матричного синтеза, поскольку новые молекулы нуклеиновых кислот и белков синтезируются в соответствии с программой, заложенной в структуре ранее существовавших молекул тех же нуклеиновых кислот (ДНК или РНК).
Читайте также:

