Синдром фибромиалгии берут ли в армию
Обновлено: 19.05.2024
В практике врача-невролога наиболее частой причиной хронической скелетно-мышечной боли становятся фибромиалгия и миофасциальный болевой синдром. Фибромиалгия представляет собой синдром, характеризующийся хронической мышечно-скелетной болью и наличием пальпируемых болезненных точек, определяемых как дискретные области мягкой ткани, болезненные при нажатии с небольшим усилием, никак не отличимые от окружающей здоровой ткани. В то же время миофасциальный болевой синдром связан с нарушениями двигательной и чувствительной функций, характеризуется наличием миофасциальных триггерных точек – гиперраздражимых узлов, обнаруживаемых в волокнах скелетной мышцы. В настоящее время дифференциальная диагностика данных состояний затруднена в связи с отсутствием четких критериев для постановки диагноза, в связи с чем очень часто данные заболевания диагностируются неверно. Неправильный диагноз любого из состояний приводит к ряду негативных последствий, в т.ч. ненужным анализам и обследованиям у различных специалистов, отсутствию улучшения симптомов, удлинению времени до установления верного диагноза, фрустрации пациентов и повышению нагрузки на систему здравоохранения в целом. В статье представлены современные данные о патофизиологии, критериях диагностики и дифференциальной диагностики данных состояний.
Введение
Скелетно-мышечная боль – широко распространенное состояние, возникающее у 80% общей популяции, причем 10–20% случаев относятся к хроническим [1–3]. К двум наиболее распространенным формам скелетно-мышечной боли, с которыми сталкиваются неврологи в повседневной практике, относятся фибромиалгия (ФМ) и миофасциальный болевой синдром (МБС).
ФМ – это синдром, характеризующийся хронической мышечно-скелетной болью и наличием пальпируемых болезненных точек (ПБТ) [4–5]. ПБТ – ограниченные области мягкой ткани, болезненные при нажатии с небольшим усилием (менее 4 кг), в остальном никак не отличимые от окружающей здоровой ткани. ФМ обычно развивается в среднем возрасте, но в целом может наблюдаться в любой возрастной категории [5]. Общая распространенность ФМ в клинической популяции варьируется в широких пределах, составляя от 9 до 85% [6, 7] и обычно выше в США (1,1–6,4%) и Европе (1,4–3,7%), несколько ниже в Азии (0,6–3,6%), что, вероятно, отражает культурные различия в восприятии боли и соответствующих жалобах [8]. Распространенность ФМ традиционно выше у женщин (1,0–12,5%), чем у мужчин (0,1–5,1%; соотношение 3:1) [8], что, вероятно, связано с более высокой распространенностью коморбидных психиатрических расстройств у женщин. Кроме того, женщины при одинаковой выраженности симптомов с мужчинами склонны тяжелее переносить болевой синдром [9]. Наиболее широко принятые и применяемые критерии для диагностики ФМ были разработаны и пересмотрены Американским колледжем ревматологии (ACR) [10–11]. Критерии ACR значительно различаются в зависимости от версии. Самое значимое расхождение между критериями 1990 г., где наибольшее внимание уделяется результатам физикального осмотра, и критериями 2010 и 2011 гг., которые делают больший упор на имеющиеся симптомы.
МБС в отличие от ФМ обычно проявляется регионарным мышечным болевым синдром, связанным как с нарушениями двигательной, так и чувствительной функций [12–14]. Определяющая характеристика МБС – это физическое появление миофасциальных триггерных точек (МТТ), представляющих собой чувствительные при пальпации узелки, обнаруживаемые в волокнах скелетной мышцы [13]. Руководство по диагностике триггерных точек, написанное авторами D.G. Simons и J.G. Travell, – это самый часто используемый набор критериев для диагностики МБС [15]. Согласно этому руководству, диагностические критерии преимущественно основаны на физикальном осмотре и выявлении МТТ.
Значительное сходство между МБС и ФМ представляет серьезную диагностическую сложность и часто приводит к неверному становлению диагноза МБС в случае ФМ [16–17]. Неверная диагностика любого из этих состояний приводит к ряду отрицательных последствий, включая назначение ненужных анализов и обследований у разных специалистов, отсутствие уменьшения выраженности симптомов, удлинение времени до постановки диагноза, ненужную фрустрацию пациента и повышение нагрузки на систему здравоохранения. Ранее проведенные исследования показали, что затруднения в дифференциальной диагностике двух указанных состояний объясняются схожестью клинических проявлений МБС и ФМ [18], отсутствием надежных дифференциально-диагностических лабораторных исследований [19–20], потенциальной коморбидностью ФМ и МБС [21] и вариабельностью клинических проявлений МБС по сравнению с ФМ [22].
Патофизиология МБС и ФМ: общее и различное
Этиология и патофизиология МБС до сих пор мало изучены. Наиболее широко распространенное среди врачей-клиницистов представление об МБС характеризуется наличием регионарной мышечной боли и пальпируемых гиперчувствительных областей, называемых МТТ. В соответствии с обобщенной гипотезой [15] МТТ формируются в области концевой пластинки мышцы [6, 15]; патологический процесс предположительно запускается после локальной травматизаци или повторных микротравм [6, 18]. Местное повреждение приводит к избыточному высвобождению ацетилхолина, что в результате приводит к повышению активности концевой пластинки, проявляющемуся образованием пальпируемой гипервозбудимой области на периферической мышце [6, 15, 23, 24]. Стойкое сокращение приводит к каскаду биохимических реакций, включая высвобождение вазоактивных компонентов и провоспалительных факторов [15, 18, 23, 24], включая брадикинин, который способствует возникновению локальной мышечной боли. Одновременно с этим стойкий ноцицептивный стимул с периферии приводит к высвобождению субстанции Р в заднем роге спинного мозга и последующим нейропластическим изменениям (повышенной возбудимости) центральной нервной системы, известной как центральная сенситизация [23, 25]. В соответствии с альтернативной гипотезой важную роль в патофизиологии формирования МТТ и МБС играют нейрогенные механизмы, включая экспрессию сенситизированных спинальных проводящих путей [26] и сенситизированных мотонейронов в результате центральной сенситизации [27]. Недавно проведенное исследование указывает на возможность инициации и облегчения формирования локализованных гипервозбудимых МТТ в отсутствие повреждения периферических мышц в результате нейрогенного воспаления, возникающего как следствие центральной сенситизации [28].
Патофизиология ФМ также слабо изучена. В отличие от регионарно возникающей боли и пальпируемых болезненных узелков при МБС, по согласованному мнению врачей-клиницистов, диагноз ФМ устанавливается при наличии обширной зоны болезненности с симметричным распределением ПБТ в мышце [18] в течение более 3 месяцев [10, 11, 29]. Хотя этиология ФМ изучена слабо [18, 17, 29], предполагается, что в основе формирования клинических проявлений заболевания лежит нарушение центральной обработки сигнала [18]. Данная концепция подтверждается частым выявлением генерализованной болезненности мышц [18] и симметричным распределением ПБТ у пациентов с ФМ [10, 18, 30, 31]. В соответствии с этой теорией ПБТ располагаются в областях вторичной гиперальгезии [32, 33], т.к. в пробах спинномозговой жидкости обнаруживается повышенный уроень синаптических модуляторов, включая субстанцию Р [34, 35]. Потенциальным ключевым фактором дифференциальной диагностики ФМ и МБС может стать тот факт, что в ПБТ обычно не обнаруживается экспрессии провоспалительных факторов [18], в то время как при МБС в области МТТ обнаруживается изменение биохимического окружения [23].
Клинические проявления МБС и ФМ
МБС и ФМ различаются по характеру анатомического расположения и клиническим характеристикам болевого синдрома (см. таблицу).
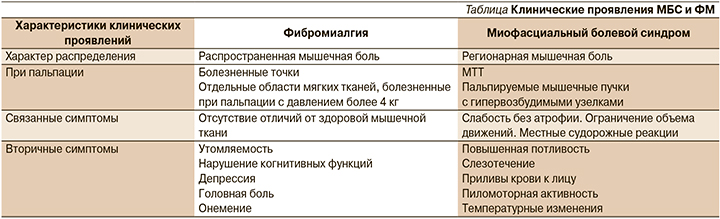
МБС обычно проявляется регионарными мышечными болями [35], связанными с нарушением как двигательной, так и чувствительной функций. Клинически МБС проявляется наличием пальпируемых напряженных пучков мышечных волокон с гипервозбудимыми узелками, называемыми МТТ [6, 35, 36]. В мышцах с МТТ также отмечается нарушение функции – мышцы становятся слабыми в отсутствие явлений атрофии или изменения объема движений [13]. При выявлении МТТ также часто отмечаются местные судорожные реакции – быстрые кратковременные подергивания отдельных напряженных пучков мышечных волокон в ответ на физические стимулы или внутримышечное введение иглы [15, 35]. Некоторые исследователи считают местные судорожные реакции подтверждением наличия МТТ [15], в то время как другие рассматривают этот критерий как ненадежный [37]. Напротив, ФМ характеризуется распространенными скелетно-мышечными болями и наличием ПБТ [29–31, 35, 36]. В отличие от МТТ при пальпации они не определяются как узелковые структуры в мышечной ткани. ПБТ не отличимы на ощупь от окружающей мышечной ткани, за исключением наличия локального повышения болевой чувствительности. Таким образом, важным клиническим отличием МБС от ФМ является обнаружение при пальпации МТТ в отличие от ПБТ при ФМ. Другое клиническое различие ФМ и МБС заключается в наличии сопутствующих проявлений при ФМ, включая нарушения сна, синдром раздраженного кишечника, синдром нейрогенного мочевого пузыря, утомляемость, когнитивные нарушения, тревогу, депрессию, головные боли, заболевания височно-нижнечелюстного сустава, онемение, ощущение покалывания и синдром Рейно [31–32, 38]. Эти состояния вносят значительный вклад в снижение качества жизни пациентов с ФМ [29–32] по сравнению с МБС. У пациентов с МБС хотя и редко, но также возникают сопутствующие вегетативные нарушения, включая избыточное потоотделение, слезотечение, приливы крови к лицу, дермографию, активацию пиломоторных рефлексов и изменения температуры кожи [6], что вносит дополнительные затруднения в дифференциальную диагностику ФМ и МБС.
Диагностика ФМ и МБС
Современные диагностические критерии ФМ. В 1990 г. ACR разработал широко применявшиеся в клинической практики критерии классификации [10]. В соответствии с этими критериями для диагностики ФМ требовалось наличие хронической распространенной боли на обеих сторонах тела как выше, так и ниже талии, с вовлечением верхней и/или нижней части позвоночника, а также наличия более 11 из 18 определенных областей, болезненных при пальпации. Более современные критерии ACR (2010) подразумевают, что ФМ характеризуется наличием хронической распространенной боли в сочетании с утомляемостью, нарушениями сна и когнитивных функций, а также широким спектром соматических симптомов [30]. Критерии подразумевают использование шкалы распространенной боли и шкалы для оценки степени тяжести утомляемости, нарушений сна, когнитивных нарушений и 41 возможного соматического симптома. В модифицированной версии 2010 г. устранена оценка степени выраженности соматических симптомов врачом и заменена на общий балл трех симптомов, что облегчает применение критериев при сохранении необходимой чувствительности [11].
Сочетание описанных факторов ограничивает надежность использования только физикального осмотра для дифференциальной диагностики МБС и ФМ. Современные критерии ACR для диагностики ФМ (2010) [11] направлены на устранение необходимости в использовании данных физикального осмотра для дифференциальной диагностики. Кроме того, существует необходимость выявления и разработки новых объективных диагностических критериев, которые могли бы быть использованы для дифференциальной диагностики видов хронической скелетно-мышечной боли.
Заключение
Скелетно-мышечная система является самым крупным по массе органом человеческого организма и состоит более чем из 400 скелетных мышц. Проблемы, связанные с болевым синдромом или утомляемостью этой системы, слжат частой причиной обращения за медицинской помощью. За последние десятилетия изучение этих патологий прибрело новые направления: сенситизация центральной нервной системы на уровне спинного и головного мозга как механизм хронификации нарушений локального тонуса при МТТ и боли при фибромилагии, неадаптивная перестройка механизмов подавления боли как существенный фактор ее поддержания благодаря нейропластичности нервной системы, нейрогенное воспаление как возможная реакция ирритации корешков с выделением брадикинина, CGRP и поддержания МТТ. Также существенным можно считать фактор наличия у многих пациентов с ФМ тревожно-депрессивных расстройств и изучение патологии явления МТТ как периферической реакции на нейромедиаторные изменения головного мозга. Однако в настоящее время дифференциальная диагностика этих состояний основывается на неточных и субъективных критериях, что требует поиска новых диагностических методов и разработки более современных и надежных клинических алгоритмов дифференциальной диагностики.
Литература
1. Кадырова Л.Р., Акарачкова Е.С., Керимова К.С. и др. Мультидисциплинарный подход к пациенту с хронической болью. РМЖ. 2018;7:28–32.
2. Голубенко Е.О., Силина Е.В., Орлова А.С. Персонифицированный подход в лечении болевых синдромов. Современная наука: актуальные проблемы теории и практики. Серия: Естественные и технические науки. 2017;7–8:107–12.
3. Hawker G.A. The assessment of musculoskeletal pain. Clin Exp Rheumatol. 2017;35(Suppl.107, 5):8–12.
4. Данилов А.Б. Фибромиалгия: диагностика и лечение (обзор). Поликлиника. 2016;4(3):18–23.
10. Wolfe F., Smythe H.A., Yunus M.B., et al. The American College of Rheumatology 1990 Criteria for the Classification of Fibromyalgia. Report of the Multicenter Criteria Committee. Arthr Rheum. 1990;33(2):160–72.
12. Курушина О.В., Барулин А.Е., Данилов А.Б. Миофасциальный болевой синдром. РМЖ. 2015;23(30):22–6.
15. Simons D.G., Travell J.G., Simons L.S. Myofascial pain and dysfunction: The trigger point manual (2nd ed.). Baltimore, MD: Williams &Wilkins, 1999.
16. Bourgaize S., Newton G., Kumbhare D., Srbely J. A comparison of the clinical manifestation and pathophysiology of myofascial pain syndrome and fibromyalgia: implications for differential diagnosis and management. J Can Chiropr Assoc. 2018;62(1):26–41.
17. Gerwin R.D. Diagnosing fibromyalgia and myofascial pain syndrome: a guide. J Fam Pract. 2013;62(12, Suppl. 1):19–25.
18. Perle S.M. Tender points/fibromyalgia vs. trigger points/myofascial pain syndrome: a need for clarity in terminology and differential diagnosis. J Manipulative Physiol Ther. 1996;19(2):146–47.
26. Hong C.Z. New trends in myofascial pain syndrome. Zhonghua Yi Xue Za Zhi (Taipei). 2002;65(11):501–12.
36. Tunks E., McCain G.A., Hart L.E., et al. The reliability of examination for tenderness in patients with myofascial pain, chronic fibromyalgia and controls. J Rheum. 1995;22(5):944–52.
38. Боровая Т.В., Захаренко А.Г., Силивончик Н.Н. и др. Фибромиалгия. Вопросы диагностики и лечения. Вопросы организации и информатизации здравоохранения. 2016;(Suppl.):64–7
Описаны этиология и патогенез, а также механизмы формирования хронической боли при фибромиалгии, диагностические критерии и клинические характеристики заболевания и способы его терапии, включая немедикаментозное и медикаментозное лечение.
Are described etiology and pathogenesis, and also the mechanisms of the forming of chronic pain with fibromyalgia, diagnostic criteria and clinical characteristics of disease and the methods of its therapy, including non medicament and drug treatment.
История
Этиология и патогенез
Однако сегодня убедительно показано, что ЦС, а также нарушение нисходящего (норадренергического и серотонинергического) ингибиторного контроля боли возникают при фибромиалгии не вследствие периферических изменений в мышцах, фасциях, связках или соединительной ткани, а в результате нейродинамических нарушений в ЦНС у лиц с генетической предрасположенностью под воздействием большого количества стрессовых (физических и психических) событий (табл. 1).
Исследования фибромиалгии последних двух десятилетий показали, что болевой порог зависит от степени дистресса. Многие психологические факторы, такие как сверхнастороженность, мнительность, катастрофизация, внешний локус контроля боли, могут играть важную роль в степени выраженности симптомов фибромиалгии. Специальные исследования показали, что у пациентов с фибромиалгией снижена серотонинергическая и норадренергическая активность. Также было обнаружено, что у пациентов с фибромиалгией наблюдается снижение уровня сывороточного серотонина и его предшественника L-триптофана и снижение основного метаболита серотонина в ликворе — 5-гидроксииндола ацетат. В подтверждение этих данных говорит тот факт, что препараты, которые одновременно повышают уровни серотонина и норадреналина (трициклические антидепрессанты, дулоксетин, милнаципрам и трамадол), обладают эффективностью в лечении фибромиалгии. Нейробиологические доказательства того, что фибромиалгия является состоянием с повышенной болевой чувствительностью (ЦС) и нарушениями процессов восприятия, подтверждаются результатами аппаратных методов диагностики: однофотонной эмиссионной компьютерной томографией и функциональной магнитно-резонансной томографией [1, 2].
Клиническая картина и диагностика
В 1990 году Американской коллегией ревматологов были разработаны методические рекомендации по диагностике фибромиалгии (критерии ACR) (табл. 2) [3]. Хотя эти критерии не предназначены для использования в клинических условиях, а только в рамках исследований, тем не менее, они обеспечивают более 85-процентную точность в дифференциальной диагностике пациентов с фибромиалгией от похожих заболеваний.
У пациентов с фибромиалгией при физикальном обследовании обнаруживается лишь повышенная чувствительность или болезненность в определенных точках тела. Исследование болезненных точек требует опыта. Врач должен знать, где именно пальпировать и с какой силой. Согласно критериям ACR определено 9 пар болезненных точек при фибромиалгии (рис.).
Давление, производимое в этих точках, должно составлять 4 кг/см — давление, при котором белеют ногтевые ложа исследователя. При выполнении пальпации 18 болезненных точек рекомендуется оказывать равномерное давление на парные точки и с тем же усилием пальпировать другие участки тела для сравнения чувствительности. У больных с фибромиалгией в болезненных точках наблюдается повышенная чувствительность по сравнению с другими участками тела. Болезненные точки отражают участки повышенной чувствительности к болевым стимулам, а не являются следствием локального воспаления или поражения тканей.
Наличие положительной реакции более чем в 11 из 18 болезненных точек определено диагностическим критерием на основании анализа статистических данных больших популяций больных. Однако не обязательно у всех пациентов с фибромиалгией будет отмечаться повышенная чувствительность в более чем 11 точках. Еще раз отметим, что критерии ACR фибромиалгии предназначены для исследовательских целей, а не для постановки диагнозов конкретным больным. Тем не менее, обследование болезненных точек считается важной частью изучения функционирования скелетно-мышечной системы у больных с синдромом генерализованной боли. Пальпация мягких тканей и суставов позволяет выявить зоны повышенной чувствительности. Это обследование позволяет исключить синовит или миозит и является очень важным в диагностике фибромиалгии.
Как видно из критериев ACR, фибромиалгия — это не только болевой синдром. Это состояние включает в себя целый комплекс беспокоящих больного симптомов. Наряду с хронической диффузной болью другим типичным симптомом фибромиалгии является повышенная утомляемость. Этот симптом наиболее ярко проявляется при пробуждении, но встречается и во второй половине дня. Незначительная физическая нагрузка способна резко усилить боль и усталость, хотя длительный отдых и отсутствие активности также могут обострять симптоматику.
Недавно был предложен опросник FiRST (Fibromyalgia Rapid Screening Tool) для проведения скрининга на выявление фибромиалгии (табл. 3). Преимуществами опросника являются его краткость и простота заполнения. Следует подчеркнуть его высокую чувствительность (90,5%) и специфичность (85,7%). Важно отметить, что опросник предназначен для скрининга и только по нему диагноз ставить нельзя. Пациенты, набравшие 5 и более баллов по опроснику FiRST, должны быть тщательно обследованы для постановки достоверного диагноза фибромиалгии.
Лечение фибромиалгии
Немедикаментозное лечение
Специально проведенный анализ различных немедикаментозных методов лечения фибромиалгии показал, что достоверной эффективностью обладают два метода — когнитивная поведенческая терапия и физкультура (табл. 4) [4]. На фоне проведения обоих методов лечения отмечалось стойкое улучшение симптомов фибромиалгии на протяжении одного года и более.
Медикаментозное лечение
Антидепрессанты
Среди лекарственных препаратов одними из первых для лечения болевого синдрома при фибромиалгии были использованы трициклические антидепрессанты (ТЦА). Было показано, что амитриптилин способен купировать интенсивность болей, укреплять сон и снижать утомляемость больных с фибромиалгией [5]. При этом антидепрессанты из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) (флуоксетин, сертралин, циталопрам, пароксетин) показали низкую эффективность в ходе рандомизированных, плацебо-контролируемых исследований при фибромиалгии [5].
Ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) (венлафаксин, дулоксетин, милнаципран) оказались более эффективными, чем СИОЗС. Эти препараты, также как и ТЦА, ингибируют обратный захват серотонина и норадреналина, однако, в отличие от ТЦА, практически не влияют на другие рецепторы. Такая избирательность приводит к снижению побочных эффектов и лучшей их переносимости. Данные по венлафаксину говорят о его успешном применении для лечения нейропатической боли и фибромиалгии [6].
В исследованиях с использованием дулоксетина отмечалось более выраженное снижение общего балла по шкале тяжести фибромиалгии FIQ (Fibromyalgia Impact Questionnaire) [7] и 30-процентное снижение боли у 54% принимавших препарат по сравнению с 33% из группы плацебо [8, 9]. Дулоксетин утвержден американским Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration, FDA) в качестве средства из группы ИОЗСН для лечения большого депрессивного расстройства, нейропатической боли при сахарном диабете и фибромиалгии.
Милнаципран, который широко используется в качестве антидепрессанта, утвержден FDA для лечения фибромиалгии. В ходе 12-недельного рандомизированного клинического исследования (РКИ) 125 пациентов с фибромиалгией получали либо милнаципран один или два раза в день (в дозах до 200 мг/сутки), либо плацебо [10]. Всего у 37% пациентов с фибромиалгией удалось достичь 50-процентного снижения боли на фоне двукратного приема, у 22% — на фоне однократного приема и у 14% — в группе плацебо. В ходе 27-недельного исследования милнаципрана у 888 пациентов с фибромиалгией в 56% случаев интенсивность боли уменьшилась не менее чем на 30%, тогда как в группе плацебо таких случаев было 40% [11]. Побочные эффекты обычно были легкими и чаще всего наблюдались тошнота и головная боль.
Несмотря на то, что многие хронические болевые синдромы, включая фибромиалгию, сопровождаются депрессиями, некоторые исследования показали, что анальгетическая активность антидепрессантов не зависит от их влияния на эмоциональный статус больных [7–11].
Недавний метаанализ результатов 18 РКИ подтвердил то, что антидепрессанты могут снизить интенсивность боли при фибромиалгии, уменьшить депрессию, утомляемость, восстановить сон и повысить качество жизни [5].
Антиконвульсанты
Прегабалин, лиганд альфа-2-дельта-кальциевых каналов, утвержден для лечения нейропатической боли и был первым препаратом, утвержденным FDA для лечения фибромиалгии.
В ходе крупного РКИ с участием 528 пациентов с фибромиалгией прегабалин показал значительное снижение балла боли, повышал качество сна, снижал утомляемость и улучшал общее самочувствие [12]. Участники исследования получали плацебо или одну из доз прегабалина (150, 300 или 450 мг/сутки) в течение 8 недель. У всех пациентов, принимавших препарат, наблюдалось улучшение в течение 2 недель, которое сохранялось вплоть до окончания исследования. В последующем 6-месячном плацебо-контролируемом исследовании участвовали 566 пациентов с фибромиалгией, завершивших 6-недельное открытое исследование и ответивших на лечение (респондеры) [13]. Проводилась монотерапия прегабалином 300, 450 или 600 мг/сутки (два раза в сутки). В результате показано, что ответная реакция на лечение прегабалином является протяженной во времени. Время до снижения терапевтического ответа у лиц, получавших плацебо, было значительно короче, чем у принимавших прегабалин. Прегабалин при длительной терапии приводил к более позднему ухудшению таких параметров, как нарушение сна, усталость и общее самочувствие пациента. В двух других крупных РКИ, где лечение продолжалось 13–14 недель, показано, что монотерапия прегабалином была эффективна для уменьшения интенсивности боли при фибромиалгии в дозировках 300, 450, и 600 мг/сутки [14, 15]. Эффективность прегабалина в лечении фибромиалгии оценивалась в ходе мета-анализа результатов шести РКИ, в которых приняло участие более 2000 пациентов с фибромиалгией [16, 17]. Показано, что прегабалин вызывал снижение боли при фибромиалгии, улучшал сон и повышал качество жизни, но не влиял на тяжесть депрессивного настроения. Кроме того, у пациентов с фибромиалгией, получавших прегабалин, отмечалось снижение утомляемости и тревожности.
Габапентин, чьи фармакологические свойства сходны с прегабалином, применяли в ходе 12-недельного РКИ с участием 150 пациентов с фибромиалгией [18]. В группе габапентина отмечалось достоверное снижение среднего балла интенсивности боли, чем в группе плацебо. Кроме того, габапентин значительно улучшал балл по шкале тяжести фибромиалгии FIQ, шкале самостоятельной оценки пациентом своего состояния PGIC (Patient Global Impression of Change) и по шкале оценки качества сна. По сравнению с плацебо габапентин приводил к значительному повышению частоты встречаемости седативного эффекта, дурноты и головокружения.
Эффективность бензодиазепинов в лечении фибромиалгии до конца не изучена. Многие исследования дали противоречивые результаты. Например, бензодиазепины, включая алпразолам (0,5–3,0 мг перед сном), не показали преимущество перед плацебо для лечения боли при фибромиалгии, но клоназепам достаточно эффективно купировал болевой синдром височно-нижнечелюстного сустава, который часто наблюдается при фибромиалгии [22, 23]. Кроме того, этот препарат достаточно эффективно купировал синдром беспокойных ног, который является частой причиной беспокойного и прерывистого сна у пациентов с фибромиалгией.
Системное применение лидокаина применялось для лечения пациентов с фибромиалгией: однократные и курсовые инфузии лидокаина в дозах 5–7 мг/кг приводили к достаточно заметному снижению боли у пациентов с фибромиалгией [24]. В ходе недавнего РКИ с участием пациентов с фибромиалгией выполняли инъекции лидокаина 50 мг в болевую точку в области трапециевидной мышцы. В результате было замечено не только локальное снижение боли в месте инъекции, но и общий анальгезирующий эффект [25]. Это исследование показало важную роль периферических тканей в развитии гипералгезии при фибромиалгии и доказало возможность клинического применения локальных инъекций анестетиков для купирования боли при фибромиалгии.
Заключение
Таким образом, на сегодняшний день существуют четыре основных направления в лечении фибромиалгии (табл. 5): 1) уменьшение периферической боли, в частности, боли в мышцах; 2) профилактика центральной сенситизации; 3) нормализация нарушений сна; 4) лечение сопутствующей патологии, в частности депрессии. Первый подход в большей степени направлен на купирование острой боли при фибромиалгии и включает в себя применение физиотерапии, миорелаксантов, мышечные инъекции и анальгетики. Центральная сенситизация успешно купируется когнитивной поведенческой терапией, коррекцией сна, антидепрессантами и антиконвульсантами. Нарушения сна корректируются снижением стрессового воздействия, аэробными физическими нагрузками и агонистами гамма-аминомасляной кислоты (ГАМК). Медикаментозная и поведенческая терапия вторичного болевого аффекта (тревожность, депрессия, страх) являются одними из самых перспективных лечебных стратегий при фибромиалгии. Хотя любые комбинации этих подходов могут быть весьма полезными для пациентов с фибромиалгией, только сравнительные исследования могут дать достоверные данные об эффективности того или иного метода лечения. Всеми специалистами подчеркивается необходимость комплексного мультимодального подхода в терапии фибромиалгии, включающего как фармакологические, так и нелекарственные методы.
Литература
А. Б. Данилов, доктор медицинских наук, профессор
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Фибромиалгия — это разновидность миалгии, патологического перенапряжения мышечных волокон, которое сопровождается острым болевым синдромом, повышенной чувствительностью и скованностью тела. Возможно повышение температуры тела, озноб, утомляемость и другие признаки. Сопровождается вегетативными расстройствами, нарушениями сна, стрессовыми состояниями и тревожностью. Чтобы избавиться от боли, необходимо своевременно поставить диагноз и начать лечение у одного из профильных специалистов (невролог, травматолог, психиатр, ревматолог).

Симптомы фибромиалгии
Болезнь наблюдают преимущественно у молодых людей в возрасте 25-35 лет, у детей возникает крайне редко. Больше всего подвержены женщины из-за чувствительной психики и склонности к стрессам. Хроническое течение патологии сопровождается регулярными обострениями. Характерные симптомы:
- диффузный болевой синдром (смешанного типа и локации), возникающий в разных частях тела;
- снижение боли в тёплой месте, усиление — в холодном;
- внезапные проявления боли при естественных движениях;
- повышенная чувствительность в области шеи, затылка, колена;
- скованность движений, преимущественно по утрам;
- повышенная усталость, чувство утомления даже после сна;
- дискомфортные ощущения (онемение, покалывание, жжение кожи);
- уплотнения в зоне колен, стоп и кистей рук;
- болезненные судороги и спазмы конечностей по ночам;
- перепады артериального давления;
- панические атаки, раздражительность, необоснованная агрессия;
- бледность кожи пальцев рук (синдром Рейно);
- неконтролируемая подвижность ног;
- снижение работоспособности и концентрации внимания.
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 02 Января 2022 года
Содержание статьи
Причины
- Нарушения функций периферической и центральной нервных систем;
- острые и хронические травмирования (у спортсменов, танцоров, рабочих);
- сбои гормонального фона и работы эндокринной системы;
- регулярное пребывание в состоянии психоэмоционального напряжения;
- инфекционные и воспалительные процессы в организме;
- злоупотребление сильнодействующими препаратами;
- аллергическая реакция на вакцинацию;
- дефицит питательных веществ в крови;
- сдавливание нервных и мышечных волокон;
- слабое кровоснабжение головного мозга;
- патологические расстройства сосудов.
Стадии развития фибромиалгии
Болезнь развивается постепенно, но при отсутствии лечения прогрессирует с усиленной скоростью, что приводит к осложнениям. Существует три стадии заболевания:
- Первая. Возникает постоянное чувство усталости, особенно в ногах, больной хочет спать в любое время суток, снижается работоспособность и иммунитет. Место поражения опухает и воспаляется, конечности периодически пронзает острая боль.
- Вторая. Болезненные ощущения появляются после пробуждения и обостряются к вечеру. Мышцы спазмируются и хорошо прощупываются, увеличивается отёчность. Пациент ощущает упадок сил и выносливости, возникает частое дыхание и сердцебиение.
- Третья. Болевой синдром проявляется в состоянии покоя и напряжения, больному сложно выполнять элементарные физические упражнения. На теле прощупываются воспалённые сухожилия и мышцы, развивается атрофия и снижение рефлексов.
Разновидности
Врачи классифицируют болезнь на два типа — первичную и вторичную. Оба вида отличаются этиологией, симптомами и последствиями.
Первичная фибромиалгия
Характерный признак — диффузный болевой синдром, т. е., плавающая боль, способная проявиться в беспорядочном направлении. На протяжении болезненности дискомфорт может возникать в области головы, шеи, плеч, рук и ног, спины, грудной клетки. Из-за того, что отсутствует чёткая направленность, пациенту кажется, что болит всё тело. Усиление симптомов происходит при переохлаждении, смене погоды, длительных нагрузках, нервных потрясениях. Первичная форма продолжается 4-6 месяцев, сочетается с вегетативными расстройствами и не зависит от патологий организма.
Вторичная фибромиалгия
Форма заболевания, для которой характерна конкретная локализация боли. Больше всего вторичному типу подвержены мужчины, спортсмены и рабочие тяжёлого производства. Причины возникновения:
- интенсивные физические нагрузки;
- спортивная перенагрузка;
- поднятие тяжестей;
- ненормированный режим дня;
- нарушения сна.
Диагностика
Чтобы определить степень распространения патологии, врач при помощи пальпации исследует точки на теле:
- лоб, шея, затылок;
- плечи, лопатки, ключицы;
- локтевой сгиб руки;
- ягодичный квадрат;
- икроножная зона.
Дополнительно назначают анализы крови и мочи на содержание мочевой кислоты, ферментов, кровяных тел, белка и минералов. Биохимия крови показывает наличие патологических процессов в сосудах и нервных волокнах. Из инструментальных методов диагностики используют:
- УЗИ сосудов, сухожилий, мышц;
- компьютерная томография;
- МРТ головы;
- электронейромиография.
В сети клиник ЦМРТ доступны все способы диагностировать проблему:
МРТ (магнитно-резонансная томография)
УЗИ (ультразвуковое исследование)
Дуплексное сканирование
Компьютерная топография позвоночника Diers

Компьютерная электроэнцефалография

Чек-ап (комплексное обследование организма)
К какому врачу обратиться
Если вас беспокоит постоянная боль в теле и общее недомогание, сначала посетите терапевта. Врач назначит лечение сам, а при необходимости привлечёт невролога.
Боль в спине – наиболее распространенное состояние в структуре обращаемости за медицинской помощью. По данным эпидемиологического исследования, проведенного в городской поликлинике г. Москвы, из 1300 первичных пациентов, обратившихся за амбулаторной медицинской помощью, у 24,9% основной причиной обращения была боль в пояснично–крестцовой области [14]. По результатам изучения эпидемиологии болевых синдромов у взрослого населения России распространенность хронической боли в спине и шее составляет до 56,7% [7].
На основании различных патофизиологических механизмов выделяют ноцицептивную, невропатическую и психогенную боль.
Хроническая боль в спине может формироваться с участием всех трех патофизиологических механизмов: ноцицептивного, невропатического и психогенного. Показано, что у пациентов с хронической болью в спине даже в отсутствие четких клинических признаков поражения корешков могут формироваться боли, формально соответствующие характеристикам невропатического болевого синдрома. Использование специального опросника для диагностики невропатической боли Paindetect и оценочной шкалы невропатических симптомов и признаков университета г. Лидс (LANSS) позволило выявить признаки невропатической боли у 37–54,7% пациентов с хронической болью в спине [31,40]. По данным Российского эпидемиологического исследования распространенности невропатической боли, в качестве основной причины развития невропатического болевого синдрома боли в поясничном отделе позвоночника выявлялись у 34,74% опрошенных, боли в шее – у 11,90%, боли в грудном отделе – в 3,94% случаев [15].
Определение механизмов боли у конкретного больного позволяет выpабатывать патофизиологически обоснованную стpатегию лечения.

В случае хронической боли в спине нужно стремиться максимально точно локализовать источник болевой импульсации, даже с применением при необходимости инвазивных методов (например, диагностических блокад) и обязательно учитывать роль психосоциальных факторов, оказывающих большое влияние на хронизацию боли в спине. В данной статье будут обсуждаться только основные причины скелетно–мышечной боли в спине: миофасциальный и мышечно–тонический синдромы и фибромиалгия.
Очень часто невозможно отличить боль, источником которой является сустав, от боли, обусловленной повреждением мышц или их сухожилий, связанных с суставом. Например, воспалительные изменения, затрагивающие сустав часто распространяются и на прилежащие к нему мягкие ткани, включая мышцы. Рас-пространенные болевые синдромы выявляются у 20–25% пациентов, страдающих ревматоидным артритом или системной красной волчанкой. Альгогенные вещества, такие как брадикинин, серотонин, простагландины, выделяющиеся при воспалении суставов, играют важную роль в формировании мышечной боли. Патология сустава может вызывать перегрузку мышц, которая приводит к формированию локальной мышечной боли. Боль в мышцах может быть локальной и распространенной. Состоянием, для которого характерна локальная боль в мышце, сопровождающаяся формированием отраженной боли, является миофасциальный болевой синдром (МФБС). К формированию распространенной боли в мышцах приводят системные заболевания соединительной ткани, полимиозит, фибромиалгия.
Миофасциальный болевой синдром (МФБС)
Критерии МФБС [по I. Russell, 2008, с изменениями]: Основные (необходимые) критерии
Паттерны боли, отраженной от мышц, детально описаны J.G. Travell и D.G. Simons и наиболее стабильно воспроизводятся при исследовании мышц плечевого пояса (1989) [10]. Проблема диагностики МФБС состоит в том, что относительно большое количество мышц потенциально может принимать участие в развитие МФБС, и, соответственно, врач должен владеть методикой мануального исследования различных мышц.
Затруднения связаны с различной конституцией пациентов, толщиной подкожной жировой клетчатки, глубиной залегания мышц. Особенно трудно доступны пальпации мышцы ног и ягодичной области (например, глубоко залегающая грушевидная мышца). Воспроизводимость диагноза МФБС при сравнении результатов обследования пациентов двумя независимыми обученными для диагностики МФБС специалистами остается низкой. Это отчасти объясняется тем, что области мышечного уплотнения с участками локальной болезненности и даже типичными паттернами отраженной боли и локальным сокращением мышцы нередко выявляются и в здоровой популяции. Показано, что в наибольшей степени пациентов с МФБС от здоровых отличают ограничение движений в пораженной мышце, уменьшение в ней силы (при активном сопротивлении, из–за возникающей при движении боли) и снижение болевого порога, выявляемого при альгометрии [49].
Кроме скелетно–мышечных нарушений, у пациентов с МФБС нередко отмечаются расстройства сна и сопутствующие эмоциональные нарушения (тревожность и депрессия). Несмотря на продолжающуюся дискуссию о МФБС, как самостоятельной нозологической единице, с прямо противоположными точками зрения [25,50], большинство (88%) исследователей и специалистов в области болевых синдромов диагноз МФБС считают правомочным [49]. Задачей врача является диагностика МФБС в качестве причины боли в спине и конечностях для последующего ее устранения.
Для лечения МФБС применяют комплексный подход. Для купирования болевого синдрома показана эффективность нестероидных противовоспалительных препаратов (НПВП). При лечении острой и хронической скелетно–мышечной боли в спине доказательность применения этой группы лекарственных средств относится к уровню А [13,48].
Для уменьшения частоты побочных явлений Вольтарен при хронической боли в спине не рекомендуется применять длительно (более 14 дней). Суточная доза препарата в зависимости от выраженности болевого синдрома может варьировать от 75 до 150 мг/сут. По соотношению эффективности и переносимости Вольтарен является препаратом выбора для лечения скелетно–мышечных болевых синдромов у пациентов без серьезных факторов риска развития НПВП–гастропатии и заболеваний сердечно–сосудистой системы.
Необходимо помнить, что редко Вольтарен вызывает гепатотоксические осложнения. Востребованность Вольтарена подтверждается еще и количеством генериков диклофенака, которых на сегодняшний день в России более 100. Ведущие эксперты высказывают сомнение в возможности переносить данные по эффективности и безопасности оригинального препарата Вольтарен на его генерики, многие из которых не проходили серьезной клинической оценки [5,12,38,54]. Вольтарен может применяться для лечения боли в спине у лиц пожилого возраста без серьезной сопутствующей соматической патологии и у пациентов с поражением желудочно–кишечного тракта в анамнезе (без тяжелых осложнений) в сочетании с ингибиторами протонной помпы.
Большая роль при лечении МФБС принадлежит местному лечению – растяжению, массажу заинтересованной мышцы и ТЗ, воздействию теплом или холодом, ультразвуком, чрескожной нейростимуляцией, инъекциям местных анестетиков в ТЗ. Считается, что при МФБС наиболее эффективны инъекции местных анестетиков в ТЗ. Обычно вводят 0,5–1 мл 0,5% pаствоpа новокаина. Новокаин считается наименее миотоксичным местным анестетиком. Для усиления эффекта блокад дополнительно применяют пассивное растяжение мышцы или использование релаксирующих приемов мануальной терапии [4,41].
Для уточнения эффективности введения ботулотоксина в ТЗ проведено несколько рандомизированных контролируемых исследованиях, систематизированных в обзоре K. Ho и К. Tan [36]. Четыре из пяти проанализированных рандомизированных контролируемых исследований не подтвердили эффективность инъекций ботулотоксина при МФБС.
К другим местным методам лечения относятся массаж, применение ультразвука (в непpеpывном или импульсном pежиме интенсивностью 0,2–0,5 Вт/см2 вокpуг ТЗ). При МФБС возможно применение чрескожной электронейростимуляции, однако ее эффективность, как и большинства методов физиотерапии, при МФБС четко не доказана. По данным нескольких рандомизированных контролируемых исследований, при МФБС потенциальной эффективностью обладает акупунктура. Курс лечения составляет от 10 до 15 сеансов.
Важное место занимают аппликации на болевые участки кожи гелей, мазей, как противовоспалительных, так и раздражающих. Расслабление спазмированной мускулатуры, кроме того, достигается при помощи постизометрической релаксации [4].
Иногда для устранения ТЗ применяется методика прессуры или ишемической компрессии ТЗ. При этом производится энергичное пальцевое давление на ТЗ в течение 1–2 минут. Считается, что это воздействие вызывает фазные изменения кровотока (ишемия и реактивное полнокровие), которые, возможно, лежат в основе лечебного эффекта. Различные методы релаксации мышц подробно описали Г.А. Иваничев (2005), Р.Г. Есин с соавт. (2003), Д.Г. Тревел и Д.Г. Симонс (1989), Л. Фергюсон и Р. Гервин (2008) и др.
Целесообразно применение миорелаксантов: тизанидина (Сирдалуда) (2 мг 3 раза в сутки, при необходимости, дозу постепенно повышают до 8–12 мг/сут. в 3 приема), толперизона (300–450 мг/сут. в 3 приема), баклофена (5 мг 2 раза в сутки с постепенным повышением дозы каждые 5 дней до 30 мг/сут.). Применение миорелаксантов способствует регрессу не только активных, но и латентных ТЗ, то есть улучшает отдаленный прогноз, снижая возможность рецидивирования МФБС [53]. При хроническом течении МФБС целесообразно добавление к терапии антидепрессантов, обладающих собственной анальгетической активностью: амитриптилина (50–75 мг/сут), венлафаксина (75–150 мг/сут.), дулоксетина (60–120 мг/сут.), милнаципрама (50–100 мг/сут.).
Мышечно–тонические синдромы

Хроническое течение мышечно–тонических синдромов чаще всего отмечается в тех мышцах, которые испытывают позные перегрузки, например, при асимметрии конечностей, таза, выраженном сколиозе, патологии внутренних органов. Боль в этих случаях, как правило, имеет слабую или умеренную интенсивность. Пациенты предъявляют жалобы на ощущение дискомфорта, тяжести после физической нагрузки, которые уменьшаются после разминания мышцы, ее согревания. Болезненность в спазмированной мышце возникает при ее активном сокращении и обычно отсутствует при растяжении. При перерастяжении и микротравматизации мышцы на фоне ее перегрузки или при длительном вынужденном положении может возникать локальная боль. При этом в ответ на травму происходит сокращение как пораженной мышцы, так и тех мышц, которые ее окружают. Это защитное напряжение мышц обозначается, как рефлекторный мышечный спазм [1].
Таким образом, важной клинической задачей является выяснение механизма развития локального длительного мышечного напряжения – патологии внутренних органов, позвоночного двигательного сегмента, спровоцировавших спазм движения или длительной неудобной позы. Воздействие на основной пато-логический процесс в этом случае приведет к регрессу и мышечно–тонического синдрома.
Мышечно–тонические синдромы в мышце, выпрямляющей позвоночник, развиваются при дегенеративном спондилолистезе, когда соединительнотканные структуры позвоночника (волокна фиброзного кольца, фронтальная поверхность дугоотростчатых суставов и подвздошно–поясничная связка) утрачивают способность противодействовать силе гравитации. В этом случае мышце, выпрямляющей позвоночник, противодействует большая поясничная мышца, при сокращении которой к позвоночнику прикладывается сила, направленная на смещение позвонка кпереди. Вместе эти мышцы стабилизируют поясничный отдел позвоночника в сагиттальной плоскости.
Лечение мышечно–тонических синдромов. В большинстве случаев коррекции требует первичное состояние, вызвавшее формирование мышечно–тонического синдрома. При устранении первичного источника болевой импульсации рефлекторный мышечно–тонический синдром может регрессировать. В тех случаях, когда мышечно–тонические нарушения становятся основным или самостоятельным источником боли, применяют как местные, так и общие воздействия. Проводятся растяжение, массаж заинтересованной мышцы, воздействие согревающими физиопроцедурами, приемы мануальной терапии, направленные на мобилизация пораженного позвоночного двигательного сегмента. Целесообразна коррекция двигательного стереотипа, избегание провоцирующих нагрузок и поз. При отсутствии саногенетической роли мышечно–тонического синдрома возможно назначение НПВП (Вольтарен (75–150 мг/сут.) и др.) и миорелаксантов, обладающих анальгетическими свойствами, например Сирдалуд (6–12 мг/сут.). Согласно клиническим исследованиям был доказан обезболивающий и миорелаксирующий эффект тизанидина (Сирдалуда) в отношении острого болезненного мышечного спазма уже в течение первых 3 суток от начала лечения [39,44].
Фибромиалгия
Фибромиалгия – хронический генерализованный болевой синдром, нередко сопровождающийся постоянным чувством усталости, депрессией, нарушениями сна, ощущением скованности в мышцах и суставах.
Общепринятые критерии диагностики фибромиалгии, предложенные Американским колледжем ревматологов:
Фибромиалгия обычно развивается постепенно, чаще начинаясь с одной области тела. Определенной причины больные, как правило, назвать не могут, реже указывают на травму, эмоциональный стресс, инфекцию. Для заболевания характерны обострения и ремиссии, как правило, без влияния внешних факторов. Многие пациенты отмечают ощущение пpипухлости и скованности суставов (объективно отечности суставов может не выявляться), метеочувствительность (усиление болей в холодное вpемя года).
Уже на ранних этапах изучения проблемы фибромиалгии отмечалась роль психических нарушений. У 71% пациентов с фибромиалгией в анамнезе были указания на имевшиеся ранее депрессивные нарушения. При обследовании примерно у половины больных фибромиалгией присутствуют характерные жалобы на подавленное настроение, утрату интересов и чувства удовольствия; часты и дополнительные жалобы на снижение аппетита, нарушения сна и др. [9].
Также нередко при фибромиалгии отмечается нарушение когнитивных функций. Пациенты испытывают трудности концентрации внимания, нарушения кратковременной памяти. Они хуже выполняют нейропсихологические тесты, связанные с переключением внимания [49].
Обращается внимание на значение психических травм в детстве и генетических факторов. Считается, что генетические факторы и факторы окружающей среды в одинаковой степени повышают риск развития фибромиалгии.
Вероятно, фибромиалгия представляет собой состояние, при котором нарушается взаимодействие ноцицептивной и антиноцицептивной систем. При этом ключевая роль принадлежит дефициту нисходящих ингибирующих влияний, который опосредуется генетическими, эндокринными и средовыми факторами, что способствует формированию центральной сенситизации, усилению и амплификации ноцицептивной импульсации на различных уровнях ЦНС.
Лечение фибромиалгии
Медикаментозная терапия (с позиций доказательной медицины приведенные ниже данные относятся к рекомендациям уровня A) включает коррекцию нарушений сна, лечение депрессии и усталости. Препараты из группы трициклических антидепрессантов (ТЦА), помимо антидепрессивного эффекта, помогают улучшить сон. Низкие уровни серотонина и норадреналина коррелируют с возникновением депрессии, мышечной боли и усталостью. Применение ТЦА, таких как амитриптилин, помогает уменьшить эти симптомы. Рекомендовано применение амитриптилина в дозе 25–50 мг/сут. за 2–3 часа до сна, что дает возможность получить максимальный седативный эффект с минимальным эффектом последействия. При необходимости можно увеличивать дозу до 50–75 мг/сут. в течение следующих недель. Для лечения фибромиалгии показана эффективность прегабалина в дозе 600 мг/сут. и длительное применение (12 мес.) милнаципрама в дозе 100–200 мг/сут. [9,18].
Препаратом выбора у детей и подростков является флуоксетин (перед началом лечения рекомендуется консультация психиатра). Для дополнительного устранения боли на короткое время может назначаться трамадол (50–100 мг каждые 4–6 часов). Использование других опиоидных анальгетиков не рекомендуется. Не рекомендуется использовать кортикостероиды для лечения фибромиалгии, если при обследовании не выявлено сопутствующих заболеваний суставов и сухожилий воспалительного характера.

При отсутствии достаточного эффекта от лечения адекватными дозами амитриптилина рекомендуется добавить к лечению препарат из группы селективных ингибиторов обратного захвата серотонина (флуоксетин) в дозе 20 мг утром. Для пациента, у которого наиболее выраженными проявлениями являются боль и депрессия, применение дулоксетина может быть лечением первого выбора. В случаях, когда основными расстройствами являются боль и нарушения сна, оправдано применение прегабалина в виде монотерапии или в сочетании с дулоксетином или милнаципрамом. В ситуации сочетания умеренной выраженности боли и депрессии оптимальной является монотерапия дулоксетином или милнаципрамом [49]. Следует избегать комбинации селективных ингибиторов обратного захвата серотонина и трамадола из–за повышения риска серотонинового синдрома.
Другие подходы к лечению фибромиалгии включают коррекцию коморбидных расстройств. При неэффективности приведенных выше комбинаций препаратов для коррекции нарушений сна, а также для уменьшения выраженности тревожных расстройств возможно добавление к лечению бензодиазепинов (альпразолама в начальной дозе 0,125 мг 3 раза в сутки с ее повышением до 1–1,5 мг/сут. в течение 5–7 дней или достижения эффекта на меньшей дозе, клоназепама в начальной дозе 0,5 мг на ночь и ее повышении до 1–2 мг). Показана эффективность зопиклона и золпидема для коррекции инсомнии, при этом последний целесообразно применять через день для уменьшения вероятности развития инсомнии на его отмену. Учитывая, что снотворные средства не влияют на другие проявления фибромиалгии, нарушения сна следует начинать лечить с применения прегабалина, который доказанно уменьшает и интенсивность боли.
В целом, если в лечении острых скелетно–мышечных болевых синдромов основная задача лечения – купирование болевого синдрома и улучшение функциональных возможностей пациента в большинстве случаев достигается назначением НПВП в сочетании с миорелаксантами и советом поддерживать повседневную активность, при лечении хронической боли в спине важно устранение не только периферических источников болевой импульсации (сочетанием медикаментозных и немедикаментозных методов лечения), но и коррекция психологических факторов, принимающих участие в хронизации и поддержании болевого синдрома.
Читайте также:

