Преждевременная деполяризация предсердий берут ли в армию
Обновлено: 04.07.2024
Согласно статистическим данным, нарушение ритма сердца из-за синдрома WPW выявляется только в 0,15–2 % случаев. Чаще болезнь встречается среди мужчин, обычно проявляется в 10–20 лет. Она приводит к тяжелым нарушениям сердечного ритма, требует особого подхода к диагностике и лечению, может представлять угрозу для жизни больного.
Классификация синдрома WPW
В кардиологии различают феномен ВПВ и синдром ВПВ. Для первого характерны электрокардиографические признаки проведения сердечного импульса по дополнительным соединениям и перевозбуждения желудочков. При этом клинические проявления АВ реципрокной тахикардии отсутствуют. Синдром сердца WPW — это сочетание перевозбуждения желудочков с симптомами тахикардии.
С учетом морфологического субстрата ученые выделяют следующие анатомические виды синдрома ВПВ:
1. С добавочными мышечными АВ-волокнами. Мышечные волокна могут:
- проходить через добавочное правое/левое париетальное АВ-соединение;
- идти от ушка правого/левого предсердия;
- быть связанными ваневризмой синуса Вальсальвы/средней вены сердца;
- идти через фиброзное аортально-митральное соединение;
- быть парасептальными, септальными верхними/нижними.
2. С пучками Кента (мышечные АВ-волокна), происходящими из рудиментарной ткани:
- и входящими в миокард правого желудочка;
- и входящими в правую ножку пучка Гиса (атрио-фасцикулярные).
По характеру проявления классифицируют:
- Манифестирующий синдром WPW. Характеризуется постоянным наличием дельта-волны, эпизодами атриовентрикулярной реципрокной тахикардии и синусовым ритмом;
- Преходящий синдром WPW (он же интермиттирующий синдромWPW). На ЭКГ диагностируется синусовый ритм, преходящеепредвозбуждение желудочков, верифицированная атриовентрикулярная реципрокная тахикардия;
- Скрытый синдром WPW. Описывается ретроградным проведением по пучку Кента. На ЭКГ выявляются эпизоды атриовентрикулярной реципрокной тахикардии (в состоянии покоя аномалия с помощью ЭКГ не диагностируется). Проявляется приступами тахикардии.
По расположению пучки Кета могут быть:
- левосторонними (идут от левого предсердия к левому желудочку);
- правосторонними (идут от правого предсердия к правому желудочку);
- парасептальными (идут около сердечной перегородки).
Расположение дополнительного проводящего пути учитывается кардиологами-аритмологами при выборе наиболее эффективной техники операционного доступа (через вену либо через бедренную артерию).
Синдром ВПВ и беременность
Синдром ВПВ, клинически себя никак не проявляющий, не требует дополнительного лечения. Но во время беременности заболевание может заявить о себе пароксизмальными нарушениями сердечного ритма. Тогда необходима консультация кардиолога и подбор эффективного лечения.
При очень частых приступах тахикардии на фоне синдрома WPW беременность противопоказана. Это объясняет тем, что болезнь в любой период может перейти в опасное для жизни нарушение ритма. К тому же тахикардия часто провоцирует недостаточное кровообращение в органах и тканях, что негативно отражается не только на состоянии матери, но и на развитии плода.
Причины синдрома WPW
Синдром ВПВ — это врожденное заболевание. Причина его возникновения состоит в мутации генов, из-за чего при закладке и формировании сердца во внутриутробном периоде образуются мостики между желудочком и предсердием. Вырастает пучок Кента.
У больных синдромом WPW распространение возбуждения от предсердий к желудочкам идет по аномальным путям проведения. Как результат, миокард желудочков возбуждается раньше, чем если бы импульс распространялся обычным путем (АВ-узел, пучок и ветви Гиса). На ЭКГ перевозбуждение желудочков отражается в виде дельта-волны (дополнительная волна деполяризации). При этом длительность QRS увеличивается, а интервал P-Q(R), напротив, укорачивается.
В момент поступления в желудочки основной волны деполяризации их столкновение в сердечной мышце фиксируется в виде немного уширенного и деформированного сливного комплекса QRS.
Аномальное возбуждение желудочков провоцирует нарушение последовательности реполяризационных процессов. На ЭКГ это выглядит как дискордантный комплекс QRS, смещение RS-T сегмента и изменение полярности зубца T.
Развитие мерцания и трепетания предсердий, суправентрикулярной тахикардии при синдроме WPW объясняется формированием круговой волны возбуждения. Импульс движется по узлу АВ в направлении от предсердий к желудочкам, а по дополнительным путям — от желудочков к предсердиям.
Симптомы синдрома WPW
Симптомы синдрома ВПВ обычно слабо выраженные. К ним относятся нарушения сердечного ритма:
- трепетание предсердий;
- фибрилляция предсердий;
- реципрокная наджелудочковая тахикардия;
- желудочковая тахикардия;
- желудочковая/предсердная экстрасистолия.
В свою очередь приступы учащенного ритмичного/неритмичного сердцебиения сопровождаются:
Ухудшение состояния больного может возникать после употребления спиртного, эмоционального либо физического перенапряжения.
В большинстве случаев пароксизм аритмии при синдроме ВПВ можно прекратить, глубоко вдохнув и задержав воздух. Затяжные приступы требуют экстренной госпитализации и лечения под наблюдением кардиолога.
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Диагностика синдрома WPW
Диагностика синдрома ВПВ у детей и взрослых включает проведение комплексного клинико-инструментального обследования. Проводятся:
К электрокардиографическим признакам синдрома сердца ВПВ относятся:
- укороченный PQ-интервал (не превышает 0,12 с);
- дельта-волна;
- деформированный сливной QRS-комплекс.
В ходе постановки диагноза обязательно проводится дифференциальная диагностика синдрома ВПВ с блокадами ножек пучка Гиса.
Лечение синдрома ВПВ сердца
Если пароксизмы аритмии отсутствуют, синдром ВПВ не требует специального лечения. При ярко выраженных приступах, сопровождающихся гипотензией, симптомами сердечной недостаточности, стенокардией, синкопэ, встает вопрос о проведении консервативного либо хирургического лечения.
Консервативные методы направлены на предупреждение приступов учащенного сердцебиения (тахикардии). Больному назначаются:
- Профилактические антиаритмические препараты (Амиодарон, Флекаинид, Пропафенон, Аденозин и др.);
- Бета-адреноблокаторы — препятствуют стимуляции рецепторов к норадреналину и адреналину (Эсмолол);
- Блокаторы медленных кальциевых каналов — оказывают воздействие на клетки сосудов и сердца, снижают частоту сердечных сокращений, уменьшают тонус сосудов;
- Сердечные гликозиды — увеличивают силу сердечных сокращений.
С целью прекращения приступов тахикардии используется внутривенное введение антиаритмических лекарственных препаратов.
В некоторых случаях купировать пароксизмы аритмий помогают:
- проба Вальсавы;
- массаж каротидного синуса;
- внутривенное введение АТФ.
Если консервативная терапия не способствует улучшению состояния больного и симптомы тахикардии не исчезают, проводится хирургическое лечение синдрома WPW. Показаниями к нему также служат:
- противопоказания к длительной лекарственной терапии;
- частые приступы фибрилляции предсердий;
- наличие приступов тахиаритмии, осложненных гемодинамическими нарушениями.
Операция носит название радиочастотной катетерной абляции. Проводится под местной анестезией. Во время нее к сердцу через бедренные сосуды подводится специальная тонкая трубочка — проводник. По ней подается импульс, который разрушает пучок Кента. Эффективность радиочастотной абляции по статистическим данным составляет 95 %. В 2 % случаев возможны рецидивы заболевания — ткани, подвергшиеся абляции, самовосстанавливаются. Тогда требуется повторная операция.
Важно знать, что при синдроме ВПВ противопоказаны занятия спортом.
Опасность синдрома ВПВ
Синдром ВПВ, проявляющийся приступами тахикардии, снижает качество жизни больного. К серьезным травмам и несчастным случаям могут привести потери сознания во время пароксизмов.
Помимо этого реципрокные АВ-тахикардии при WPW синдроме относятся к категории предфибрилляторных аритмий. Это значит, что частые приступы заболевания способны привести к более опасной и сложной фибрилляции предсердий, которая в свою очередь может трансформироваться в фибрилляцию желудочков и привести к летальному исходу.
Профилактика синдрома WPW
Специфической профилактики заболевания не существует. Если в результате ЭКГ у пациента выявлен синдром ВПВ, он должен регулярно обследоваться у кардиолога (даже если симптомы его не беспокоят). При проявлении признаков патологии нужно незамедлительно подобрать грамотное лечение.
Лицам, состоящим в родственных связях с больным синдромом WPW, рекомендуется пройти плановое обследование, чтобы исключить развитие данной патологии у себя. Диагностика должна включать: суточное мониторирование электрокардиограммы, электрокардиограмму, электрофизиологические методы.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
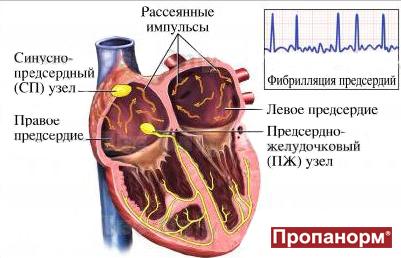
Фибрилляция предсердий является наиболее распространенным нарушением сердечного ритма. ФП не связана с высоким риском внезапной смерти, поэтому ее не относят к фатальным нарушениям ритма, как, например, желудочковые аритмии.
Фибрилляция предсердий
Один из самых распространенных видов наджелудочковых тахиаритмий – фибрилляция предсердий (ФП). Фибрилляцией называют быстрое нерегулярное сокращение предсердий, при этом частота их сокращений превышает 350 в минуту. Появление ФП характеризуется нерегулярным сокращением желудочков. На долю ФП приходится более 80 % всех пароксизмальных суправентрикулярных тахиаритмий. Фибрилляция предсердий возможна у пациентов всех возрастных категорий, однако у больных пожилого возраста распространенность синдрома увеличивается, что связано с учащением органической патологии сердца.
Причины развития и факторы риска
Сердечная патология
- ОИМ (нарушение проводимости и возбудимости миокарда).
- Артериальная гипертензия (перегрузка ЛП и ЛЖ).
- Хроническая сердечная недостаточность (нарушение структуры миокарда, сократительной функции и проводимости).
- Кардиосклероз (замещение клеток миокарда соединительной тканью).
- Миокардиты (нарушение структуры при воспалении миокарда).
- Ревматические пороки с поражением клапанов.
- Дисфункция СУ (синдром тахи-бради).
Внесердечная патология
- Заболевания щитовидной железы с проявлениями тиреотоксикоза.
- Наркотическая или иная интоксикация.
- Передозировка препаратов наперстянки (сердечных гликозидов) при лечении сердечной недостаточности.
- Острая алкогольная интоксикация или хронический алкоголизм.
- Неконтролируемое лечение диуретиками.
- Передозировка симпатомиметиков.
- Гипокалиемия любого происхождения.
- Стресс и психоэмоциональное перенапряжение.
Возрастные органические изменения. С возрастом структура миокарда предсердий претерпевает изменения. Развитие мелкоочагового кардиосклероза предсердий может стать причиной фибрилляции в пожилом возрасте.
Классификация фибрилляции предсердий
По продолжительности клинических проявлений. Различают следующие формы ФП:
- Пароксизмальная (приступообразная). Одиночные эпизоды ФП, длящиеся не более 48 часов в случае применения кардиоверсии, либо до 7 суток в случае спонтанного восстановления ритма.
- Персистирующая форма. Эпизоды фибрилляции предсердий, длящиеся более 7 суток без спонтанного восстановления, либо фибрилляция, поддающаяся кардиоверсии (медикаментозной или электрической) через 48 часов и более.
- Постоянная форма(хроническая). Непрерывная ФП, не поддающаяся кардиоверсии, в случае если врачом и пациентом принято решение оставить попытки восстановить синусовый ритм.
По величине ЧСС
- Тахисистолическая. Фибрилляция предсердий с частотой желудочковых сокращений более 90–100 уд. в мин.
- Нормосистолическая. AV-узел позволяет желудочкам сокращаться с частотой 60–100 уд/мин.
- Брадисистолическая. ЧСС при этой форме фибрилляции не достигает 60 уд./мин.
Типы мерцательной аритмии (МА)
Трепетание предсердий. В этом случае сокращение волокон миокарда происходит в более медленном темпе (200–400 уд./мин.). В отличие от ФП, при трепетании предсердия все-таки сокращаются. Как правило, за счет периода рефрактерности атриовентрикулярного узла на желудочки передается не каждый электрический импульс, поэтому они сокращаются не в столь быстром темпе. Однако, как и при фибрилляции, при трепетании насосная функция сердца нарушается, а миокард испытывает дополнительную нагрузку.
Осложнения мерцательной аритмии
По последним данным, пациенты с мерцательной аритмией попадают в группу риска не только по развитию тромбоэмболического инсульта, но и инфаркта миокарда. Механизмы поражения таковы: при фибрилляции предсердий невозможно полноценное сокращение предсердий, поэтому кровь в них застаивается и в пристеночном пространстве предсердий образуются тромбы. Если такой тромб с током крови попадает в аорту и в менее крупные артерии, то возникает тромбоэмболия артерии, питающей какой-либо орган: головной мозг, сердце, почки, кишечник, нижние конечности. Прекращение кровоснабжения вызывает инфаркт (некроз) участка этого органа. Инфаркт мозга называется ишемическим инсультом. Наиболее часто встречаются осложнения:
Медикаментозная терапия
Выделяют следующие направления лекарственной терапии фибрилляции предсердий: кардиоверсия (восстановление нормального синусового ритма), профилактика повторных пароксизмов (эпизодов) наджелудочковых аритмий, контроль нормальной частоты сокращений желудочков сердца. Также важная цель медикаментозного лечения при МА – предотвращение осложнений – различных тромбоэмболий. Лекарственная терапия ведется по четырем направлениям.
Лечение антиаритмиками. Применяется, если принято решение о попытке медикаментозной кардиоверсии (восстановления ритма с помощью лекарств). Препараты выбора – пропафенон, амиодарон.
Пропафенон – один из наиболее эффективных и безопасных лекарственных препаратов, который используется для лечения наджелудочковых и желудочковых нарушений сердечного ритма. Действие пропафенона начинается через 1 ч после приема внутрь, максимальная концентрация в плазме крови достигается через 2–3 ч и длится 8–12 ч.
Контроль ЧСС. В случае невозможности восстановить нормальный ритм необходимо привести мерцательную аритмию в нормоформу. Для этой цели применяют бета-адреноблокаторы, антагонисты кальция недигидропиридинового ряда (группы верапамила), сердечные гликозиды и др.
Бета-адреноблокаторы. Препараты выбора для контроля работы сердца (частоты и силы сокращений) и артериального давления. Группа блокирует бета-адренергические рецепторы в миокарде, вызывая выраженный антиаритмический (урежение ЧСС), а также гипотензивный (снижение АД) эффект. Доказано, что бета-блокаторы статистически увеличивают продолжительность жизни при сердечной недостаточности. Среди противопоказаний к приему – бронхиальная астма (так как блокировка бета 2-рецепторов в бронхах вызывает бронхоспазм).
Антикоагулянтная терапия. Для снижения риска тромбообразования при персистирующей и хронической формах ФП обязательно назначают препараты, разжижающие кровь. Назначают антикоагулянты прямого (гепарин, фраксипарин, фондапаринукс и пр.) и непрямого (варфарин) действия. Существуют схемы приема непрямых (варфарин) и так называемых новых антикоагулянтов – антагонистов факторов свертывания крови (прадакса, ксарелто). Лечение варфарином сопровождается обязательным контролем показателей свертываемости и, при необходимости, тщательной коррекцией дозировки препарата.
Метаболическая терапия. К метаболическим препаратам относятся лекарственные средства, улучшающие питание и обменные процессы в сердечной мышце. Эти препараты якобы оказывают кардиопротективное действие, защищая миокард от воздействия ишемии. Метаболическая терапия при МА считается дополнительным и необязательным лечением. По последним данным, эффективность многих препаратов сравнима с плацебо. К таким лекарственным средствам относятся:
- АТФ (аденозинтрифосфат);
- ионы К и Mg;
- кокарбоксилаза;
- рибоксин;
- милдронат;
- предуктал;
- мексикор.
Диагностика и лечение любого вида аритмии требует немалого клинического опыта, а во многих случаях – высокотехнологичного аппаратного оснащения. При фибрилляции и трепетании предсердий главная задача врача – по возможности устранить причину, приведшую к развитию патологии, сохранить функцию сердца и предотвратить осложнения.
Симптомы ФП
В зависимости от формы аритмии (постоянная или приступообразная) и восприимчивости больного клиническая картина ФП варьирует от отсутствия симптомов до наличия признаков сердечной недостаточности. Больные могут жаловаться на:
Фибрилляция предсердий и трепетание предсердий может сопровождаться учащенным мочеиспусканием, вызванным повышенной выработкой натрийуретического пептида. Приступы, длящиеся несколько часов или суток и не проходящие самостоятельно, требуют медицинского вмешательства.
Патогенез и общая клиническая картина
Основное проявление фибрилляции предсердий – аритмичный пульс. При высокой частоте сердечных сокращений в момент приступа ФП может возникнуть дефицит пульса, когда число сердечных сокращений превышает частоту пульса.
Причины ФП и факторы риска
Заболевания различного генеза
Наиболее часто ФП возникает у пациентов с заболеваниями сердечно-сосудистой системы – артериальной гипертензией, ИБС, хронической сердечной недостаточностью, пороками сердца – врожденными и приобретенными, воспалительными процессами (перикардит, миокардит), опухоли сердца. Среди острых и хронических заболеваний, не связанных с патологией сердца, но влияющих на возникновение фибрилляции предсердий, выделяют нарушения функций щитовидной железы, сахарный диабет, хроническую обструктивную болезнь легких, синдром сонного апноэ, болезни почек и др.
Возрастные изменения
Другие факторы риска
Фибрилляция предсердий может развиваться на фоне употребления алкоголя, после удара электрического тока и операций на открытом сердце. Пароксизмы могут спровоцировать такие факторы, как физическая нагрузка, стрессовые состояния, жаркая погода, обильное питье. В редких случаях имеется наследственная предрасположенность возникновения ФП.
Методы диагностики
Сначала требуется определить индивидуальный риск инсульта:
Высокий риск
Средний риск
Низкий риск
Atrial Fibrillation Investigators (1) **
Возраст 65 лет и старше
Гипертензия в анамнезе
ИБС
Диабет
Возраст моложе 65 лет
Отсутствие признаков высокого риска
American College of Chest Physicians (2)
Возраст старше 75 лет
Гипертензия в анамнезе
Дисфункция ЛЖ ***
Более 1 фактора среднего риска
Возраст 65 - 75 лет
Диабет
ИБС
Тиреотоксикоз
Возраст моложе 65 лет
Отсутствие факторов риска
Stroke Prevention in Atrial Fibrillation (3)
Женщины старше 75 лет
Систолическое АД более 160 мм рт. ст.
Дисфункция ЛЖ **
Гипертензия в анамнезе
Отсутствие признаков высокого риска
Отсутствие признаков высокого риска
Отсутствие гипертензии в анамнезе
Получение обязательных данных
Изучение истории болезни и жалоб пациента. Необходимо выяснить конкретные симптомы, которыми проявляется фибрилляция предсердий, определить ее клиническую форму, дату появления первых признаков, частоту и продолжительность пароксизмов, определить предрасполагающие факторы и провоцирующие заболевания, эффективность проводимого лечения.
Проведение ЭКГ, ЭхоКГ. Эти обследования позволяют определить вид нарушений сердечного ритма, оценить размеры камер сердца и состояние клапанов, изменение сократимости миокарда.
Исследование крови. Для определения функции щитовидной железы (Т3, Т4) и гипофиза (ТТГ), выявления недостатка электролитов (калия) и признаков острого ревматизма или миокардита.
Получение дополнительных данных
Холтеровское мониторирование ЭКГ. Круглосуточная регистрация ЭКГ позволяет проконтролировать и оценить ЧСС в разное время суток (включая период сна) при обычном режиме дня пациента, зафиксировать приступы ФП.
Запись пароксизмов ФП онлайн. Данная разновидность холтеровского мониторирования позволяет фиксировать сигналы электрокардиограммы, передаваемые по телефону, непосредственно в момент приступа.
Велоэргометрия, тредмил-тест и другие нагрузочные пробы. Эти методы применяются в случае, когда не установлен адекватный контроль ЧЖС (при хронической ФП), для провокации аритмии, вызываемой физической нагрузкой, а также для исключения ишемии сердца перед лечением антиаритмиками 1C-класса.
Чреспищеводная эхокардиография. Данное исследование помогает выявить наличие тромба в левом предсердии до проведения кардиоверсии.
Электрофизиологическое исследование. ЭФИ проводится для объяснения механизма тахикардии, выявления и хирургического лечения предрасполагающей аритмии (радиочастотная абляция).
Стратегии лечения ФП
Для лечения больных с фибрилляцией предсердий используются две принципиальные стратегии:
- rhythm control – восстановление синусового ритма (медикаментозная или электрическая кардиоверсия с последующей профилактикой рецидива;
- rate control – контроль ЧЖС, сочетаемый с антикоагулянтной или антиагрегантной терапией (если ФП сохраняется).
Стратегия лечения конкретного пациента выбирается в зависимости от многих факторов, и, прежде всего, это форма заболевания – пароксизмальная или персистирующая фибрилляция предсердий. Так, в первом случае приступ необходимо купировать (особенно это касается самого первого проявления ФП). При персистирующей форме мерцательной аритмии назначается постоянный прием лекарственных препаратов, направленный на контроль ЧСС и профилактику инсульта.
Согласно результатам последних исследований, применение пропафенона обеспечивает высокую эффективность восстановления и удержания синусового ритма. Следуя рекомендациям ВНОК по диагностике и лечению фибрилляции, данный препарат относят к первому ряду лекарственных средств, применяемых при персистирующей форме ФП для фармакологической кардиоверсии (класс I, уровень доказательности А).
Применение препарата Пропанорм при ФП
Купирование пароксизмов
Профилактика пароксизмов
- Пропанорм® не приводит к ухудшению показателей гемодинамики у пациентов с артериальной гипертензией, ишемической болезнью сердца и хронической сердечной недостаточностью с сохраненной систолической функцией. Применение препарата при фибрилляции предсердий в целях профилактики способствует снижению числа госпитализаций, связанных с декомпенсацией кровообращения, на 72,9 %.
- Антиаритмическая эффективность Пропанорма через 12 месяцев с начала приема практически равна показателям при применении Кордарона – 54,2 % и 52,9 % соответственно.
- При отсутствии постинфарктной кардиопатии (фракция выброса менее 40 %) Пропанорм® может применяться как антиаритмический препарат, в т. ч. в сочетании с бета-адреноблокаторами, если это необходимо.
- Пропанорм® обладает лучшим профилем безопасности, по сравнению с Кордароном.
Обращаем ваше внимание! Эта статья не является призывом к самолечению. Она написана и опубликована для повышения уровня знаний читателя о своём здоровье и понимания схемы лечения, прописанной врачом. Если вы обнаружили у себя схожие симптомы, обязательно обратитесь за помощью к доктору. Помните: самолечение может вам навредить.
Препарат Пропанорм может быть найден
в удобной пациенту аптеке, в том числе с использованием on-line сервисов, например:
Ранняя реполяризация является общей электрокардиографической находкой, которая обычно считается доброкачественной. Его потенциал, как предиктора сердечных аритмий был выдвинут как гипотеза после экспериментальных исследований, но не известно, существует ли клиническая связь с внезапной остановкой сердца.
МЕТОДЫ. Мы рассмотрели данные 206 пациентов в 22 центрах, которые были реанимированы после остановки сердца из-за идиопатической фибрилляции желудочков и оценили распространенность электрокардиографической ранней реполяризации. Последний определялся как повышение QRS-ST-соединения, по меньшей мере, на 0,1 мВ от исходного уровня в нижнем или боковом отведении, проявляющееся как блуждание или насечка QRS. Контрольная группа включала 412 пациентов без сердечных заболеваний, которые соответствовали возрасту, полу, расе и уровню физической активности. Последующие данные, которые включали результаты мониторинга с имплантируемым дефибриллятором, были получены для всех пациентов.
РЕЗУЛЬТАТЫ. Ранняя реполяризация была более частой у лиц с идиопатической фибрилляцией желудочков, чем у контрольных субъектов (31% против 5%, р 0,2 мВ) в грудных отведениях V1-V3 без вмешательства или после инфузии блокатора натриевых каналов (антиаритмиков). Кроме того, были исключены пациенты с катехоламинергическими аритмиями, определяемые как аритмии во время инфузии катехоламинов или нагрузочного тестирования.
Мы оценили распространенность и амплитуду ранней реполяризации в контрольной группе из 412 испытуемых. Эта группа была составлена сотрудниками здравоохранения с нормальными эхокардиографическими бивентрикулярными размерами и функцией и без синкопальных состояний (обмороков) в анамнезе. Для согласования использовались следующие факторы (возраст, пол, раса и уровень физической активности).
Мы собрали следующие клинические данные: синкопальные состояния в анамнезе, внезапная остановка сердца, внезапная смерть в семейном анамнезе (у родственников) (в возрасте 10 часов или ≤10 Часов активности в неделю), результаты усредненной по сигналам электрокардиографии (как стандартной амплификации, так и высокой амплификации) и результаты фармакологического тестирования и инвазивного электрофизиологического тестирования. Электрокардиографические показатели измерялись с использованием автоматизированного онлайн-программного обеспечения и проверялись вручную. Интервал QTc рассчитывали после коррекции сердечного ритма с помощью формулы Базетта.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ. Мы проводили электрофизиологическое исследование с использованием многоэлектродных катетеров, вводимых чрескожно через бедренные сосуды. Запрограммированную желудочковую стимуляцию выполняли с использованием максимум двух или трех желудочковых экстрастимуляций из двух отдельных участков желудочков. Фибрилляция желудочков считалась индуцируемой, если она продолжалась более 30 секунд или требовала электрической кардиоверсии. Ни один пациент не имел индуцируемой мономорфной желудочковой тахикардии.
В случае субъектов с рецидивирующей фибрилляцией желудочков, несмотря на введение антиаритмических препаратов, выполнялась катетерная абляция, направленная на инициирующую желудочковая эктопию, как описано ранее. Такая эктопия была локализована путем картирования самой ранней электрической активности, либо Пуркинье, либо миокарда, относительно начала комплекса QRS. Абляция выполнялась с использованием радиочастотной энергии.
ТЕРАПИЯ И ПОСЛЕДУЮЩАЯ ДЕЯТЕЛЬНОСТЬ. Все пациенты с эпизодами получали имплантируемый дефибриллятор, который обеспечивал точную информацию о рецидиве фибрилляции желудочков. Пациенты наблюдались регулярно каждые 6-12 месяцев для клинического осмотра и проверки устройства или, по мере необходимости, в случае появления симптомов или разряжения батареек устройства. В субъектах с рецидивирующими аритмиями выбор антиаритмических препаратов производился лечащими врачами.
СТАТИСТИЧЕСКИЙ АНАЛИЗ. Непрерывные переменные указывались как среднее ± SD или медианы (с 25-м и 75-м процентилями), в зависимости от ситуации. Сравнение между этими двумя группами проводилось с t-критерием Стьюдента или непараметрическим критерием Уилкоксона, в зависимости от случая, и с t-критерием Стьюдента для парных данных. Категориальные переменные сравнивались с точным тестом Фишера. Распространенность ранней реполяризации сравнивалась между субъектами исследования и контрольной группой с использованием логистического регрессионного анализа (сообщалось как отношение шансов с 95% доверительными интервалами) и корректировалось на соответствие переменных. Число рецидивов фибрилляции желудочков сравнивалось с использованием теста Уилкокинсона, а частота рецидивов оценивалась с использованием актуарных кривых. Для оценки относительного риска, связанного с ранней реполяризацией, использовались коэффициенты опасности от моделей пропорционального риска Кокса. Все тесты были двухсторонними, а значение Р менее 0,05 считалось статистически значимым.
В группе пациентов с идиопатической фибрилляцией желудочков было 123 мужчины и 83 женщины со средним возрастом 36 ± 11 лет. Контрольная группа включала 412 человек, которые соответствовали возрасту (36 ± 12 лет), полу (270 мужчин и 142 женщины), расе (380 белых, 27 азиатов и 5 негров) и физической активности (44 субъекта занимались больше чем 10 часов активности в неделю).
Ранняя реполяризация произошла у 64 пациентов (31%) по сравнению с 21 контрольной группой (5%, Р 5 мм) было более 50 эпизодов фибрилляции желудочков, приведшим к смерти в одном случае. Четырем больным с множественными эпизодами назначали хинидин, что уменьшало аномалии реполяризации и устраняло рецидивы аритмии.
ОБСУЖДЕНИЕ. Внезапная остановка сердца от аритмии может возникать у лиц, у которых нет структурного сердечного заболевания или очевидных электрокардиографических нарушений во время синусового ритма. В нашем исследовании такие субъекты исследования имели значительно более высокую распространенность ранней реполяризации, чем контрольные субъекты, у которых распространенность была сходной с таковой среди здоровых субъектов в ранее сообщавшихся исследованиях. Почти у трети пациентов были доступны электрокардиограммы, полученные до остановки сердца, и они показали раннюю реполяризацию, которая показала, что эта аномалия не может быть результатом травмы после внезапной остановки сердца, реанимации или препаратов, используемых для реанимации.
Маловероятно, что эта аномалия более распространена среди выживших пациентов с сердечными заболеваниями, чем среди не выживших, поскольку единственным наиболее важным фактором, определяющим успешную реанимацию, является доступ к быстрой дефибрилляции. Эта электрокардиографическая картина также была связана с увеличением частоты рецидивов желудочковых аритмий во время мониторного наблюдения дефибриллятора.
Наши результаты показывают связь между ранней реполяризацией и внезапной остановкой сердца, вывод, который противоречит, казалось бы, доброкачественной природе этого распространенного явления. Во-первых, это открытие может быть связано с определением ранней реполяризации, поскольку мы специально включили аномалии в нижне-боковые отведения, в то время как широкое традиционное определение ранней реполяризации включало в себя различной амплитуды, конфигурации и протяженности электрокардиографических паттернов, чаще всего в правых грудных отведениях. Во-вторых, немногие из субъектов исследования в нашем исследовании относились к подгруппам, у которых высокая распространенность ранней реполяризации (например, у спортсменов и чернокожих), что предполагает, что кофакторы влияют на ассоциацию с внезапной остановкой сердца. В-третьих, благоприятный характер ранней реполяризации оспаривается экспериментальными данными, свидетельствующими о наличии формы трансмуральной электрической неоднородности , может быть резко усилен при определенных условиях (использование специфических лекарств и различных уровней автономного тонуса и электролитов), что приводит к злокачественным аритмиям . Потенциальная аритмогенность, таким образом, зависит от дефектной модуляции реполяризации, которая соответствует динамическим изменениям, временным образом связанным с аритмиями, которые мы наблюдали в нашем случае.
Взаимосвязь между этой электрокардиографической картиной и злокачественными аритмиями подтверждается усиленной реполяризацией до наступления аритмии у субъектов исследования и возникновения триггерных сокращений в области ранней реполяризации. Хинидин, который, как было показано, восстанавливает трансмуральную электрическую однородность и отменяет аритмическую активность в этом состоянии, уменьшает электрокардиографическую картину и устраняет повторяющиеся аритмии у четырех субъектов.
Эти результаты потенциально важны для оценки пациентов с синкопальными состояниями (обмороками) или семейной историей внезапной смерти. Аритмии, связанные с аномалией реполяризации, могут быть ответственными за долю необъяснимых смертей, преимущественно у молодых мужчин, как сообщалось ранее. Такие аритмии могут также быть причиной некоторых недиагностированных причин обморока, которые, как сообщалось, увеличивают риск преждевременной смерти.
Результаты нашего исследования, которые требуют подтверждения со стороны других исследователей, имеют несколько ограничений. Хотя когорта включала субъектов со строго определенными общими чертами, сбор данных был неравномерным среди центров. В нашем изучаемом населении у нас не было субъектов со структурной болезнью сердца и у не много спортсменов или чернокожих, поэтому результаты могут не относиться к этим подгруппам. Самое главное, хотя наши результаты свидетельствуют о том, что ранняя реполяризация является маркером расстройства, связанного с злокачественными аритмиями, исследования предсказывают благоприятный курс для большинства из этих пациентов. Необходимы дальнейшие исследования для выявления факторов, которые модулируют лежащую в основе аритмогенность и предсказывают, какие пациенты подвергаются риску.
В заключение, это многоцентровое исследование показало более высокую, чем ожидалось, распространенность ранней реполяризации у пациентов моложе 60 лет, у которых была идиопатическая фибрилляция желудочков, которая вызвала обморок и внезапную остановку сердца.
Желудочковая экстрасистолия является частым нарушением ритма сердца у детей. Клиническое течение и прогноз заболевания определяются наличием патологии сердечно-сосудистой системы, устойчивостью и представленностью аритмии, эффективностью терапии. В статье
Premature ventricular contractions in children: classification, approaches to observation and treatment
Premature ventricular contractions is a frequent disorder of heart rhythm in children. The clinical course and the forecast for the disease is defined by the presence of cardiovascular system pathology, stability and presence of arrhythmia, and therapy efficiency. The article gives classification of premature ventricular contractions, approaches to prescription of anti-arrhythmic therapy and radiofrequency ablation based on the available national and international guidelines.
Желудочковая экстрасистола — это преждевременное по отношению к основному желудочковому ритму возбуждение сердца, исходящее из источника, расположенного ниже разветвления пучка Гиса (ножки пучка Гиса, волокна Пуркинье, миокард желудочков). Желудочковая экстрасистолия — это повторяющиеся желудочковые экстрасистолы.
КОД ПО МКБ-10: I49.3 Преждевременная деполяризация желудочков.
Классификация ЖЭС строится на основании различных характеристик желудочковых экстрасистол, в первую очередь электрокардиографических, которые используются в формировании диагноза:
1. По наличию заболеваний сердца:
1.1. Органическая.
1.2. Идиопатическая.
2.1. Редкая.
2.2. Частая.
3. По циркадной представленности:
3.1. Дневная.
3.2. Ночная.
3.3. Смешанная.
4.1. Одиночная.
4.2. Парная (спаренная).
4.3. Три подряд (неустойчивая желудочковая тахикардия).
5. По периодичности:
5.1. Спорадическая.
5.2. Регулярная, аллоритмия (бигеминия — экстрасистола после каждого основного комплекса, тригеминия — экстрасистола после каждых двух основных комплексов, квадригеминия — после каждых трех и т. д.).
6. По форме комплекса QRS:
6.1. Мономорфная (одной формы).
6.2. Политопная (разной формы).
7. По количеству очагов возникновения:
7.1. Монотопная (из одного источника).
7.2. Политопная (из нескольких источников).
8. По времени появления экстрасистол в диастоле:
8.1. Сверхранняя (восходящее колено зубца Т).
8.2. Ранняя (нисходящее колено зубца Т).
8.3. Поздняя (за зубцом Т).
9. По отношению к основному ритму:
9.1. С полной компенсаторной паузой.
9.2. С неполной компенсаторной паузой.
9.3. С угнетением синусового узла.
9.4. Интерполированная (вставочная).
10. По анатомической локализации источника:
10.1. Правожелудочковая (из выходного тракта, верхушки, свободной стенки и т. д.).
10.2. Левожелудочковая.
10.3. Субэндокардиальная.
10.4. Субэпикардиальная.
В клинической практике часто используют классификацию ЖЭС, предложенную B. Lown и M. Wolf в 1971 г. Следует учитывать, что данная градация ЖЭС была разработана для пациентов с острым инфарктом миокарда. Подразумевалось, что чем выше класс ЖЭС, тем выше риск возникновения фатальных желудочковых аритмий у данных пациентов, поэтому самой опасной была признана ранняя ЖЭС, способная вызвать ЖТ и фибрилляцию желудочков в остром периоде инфаркта миокарда. Для пациентов без острой ишемии миокарда, тем более у детей с идиопатической ЖЭС, ранние желудочковые экстрасистолы не имеют столь важного прогностического значения. Поэтому для детей более предпочтительной выглядит модификация данной классификации по M. Ryan (1975).
Подходы к лечению ребенка с ЖЭС строятся на оценке опасности нарушения ритма сердца и имеющихся жалоб пациента. Дети даже с частой ЖЭС редко жалуются на перебои в работе сердца. Врач отмечает нерегулярный пульс и аритмию при аускультации сердца. ЖЭС нарушает правильность сердечного ритма из-за преждевременности сокращений желудочков и постэкстрасистолических пауз.
В большинстве случаев идиопатическая ЖЭС не требует назначения антиаритмической терапии (ААТ). Ребенок с ЖЭС нуждается в первую очередь в наблюдении, лечении хронических заболеваний, в особенности патологии желудочно-кишечного тракта, ЛОР-органов, нервной системы, опорно-двигательного аппарата. Необходимо нормализовать режим дня, сна, отдыха ребенка, исключить стимуляторы (крепкий чай, кофе, энергетики и т. д.). При гипокалиемии хороший эффект можно ожидать от препаратов калия. Показана витаминотерапия с макро- и микроэлементами.
По нашему опыту, наиболее часто антиаритмическая терапия требуется детям с частой идиопатической ЖЭС (обычно более 20% в сутки) с выявленными признаками снижения сократительной способности миокарда и/или расширения камер сердца, т. е. с начальными признаками аритмогенной кардиомиопатии. При устойчивом характере ЖЭС, неэффективности ААТ рассматривается вопрос о проведении радиочастотной аблации (РЧА) источника ЖЭС. Такое представление соответствует национальным и международным рекомендациям [1, 6, 7]. В подробном документе о лечении желудочковых аритмий у детей без заболеваний сердца, разработанном совместно специалистами Общества детской и врожденной электрофизиологии (Pediatric and congenitalelectrophysiology society, PACES) и Общества нарушений сердечного ритма (Heart Rhythm Society, HRS), одобренном Американским колледжем кардиологов (American College of Cardiology, ACC) и Американской академией педиатрии (American Academy of Pediatrics, ААP), предложен следующий алгоритм выбора метода лечения [6]:
Показания класса I:
- Пациенты с бессимптомной частой ЖЭС или ускоренным идиовентрикулярным ритмом, с нормальной сократительной способностью миокарда нуждаются в проведении комплексного обследования, в медикаментозной терапии не нуждаются.
- У детей с частой ЖЭС, осложненной развитием аритмогенной дисфункцией миокарда, следует рассмотреть вопрос об ААТ или РЧА.
Показания класса IIА:
При наличии у пациента симптомов заболевания, которые коррелируют с частой ЖЭС или ускоренным идиовентрикулярным ритмом, следует рассмотреть вопрос об антиаритмической терапии β-адреноблокаторами или проведении РЧА источника аритмии.
Имеется ряд принципиальных моментов при назначении ААТ у детей. Назначение препарата, подбор дозы осуществляются под контролем ЭКГ. ААТ считается эффективной при уменьшении представленности ЖЭС более чем на 50%, парной ЖЭС более чем на 90%, отсутствии пробежек ЖТ. Препаратом первой линии является пропранолол, он наиболее эффективен при дневной ЖЭС, особенно связанной с физической нагрузкой. Препаратами второй линии являются блокаторы натриевых каналов IС класса (пропафенон, аллапинин), их назначать рекомендуется только в стационаре из-за возможного проаритмогенного эффекта. Аллапинин может быть выбран при сочетании брадикардии и ЖЭС. Амиодарон детям с идиопатической ЖЭС обычно не рекомендуется, при выборе между данным препаратом III класса и возможностью проведения РЧА большинство специалистов в настоящее время выбирают интервенционный вариант лечения как радикальный и более эффективный, чем ААТ. При назначении ААТ следует помнить, что побочные и проаритмогенные эффекты препаратов могут быть значительно опасней, чем ЖЭС, поэтому лечение должно проводиться строго по имеющимся рекомендациям.
Препараты и дозы для ААТ у детей с ЖЭС:
- Пропранолол (Индерал, Анаприлин, Обзидан), неселективный β-адреноблокатор (II класс антиаритмических препаратов). Суточная доза — 1–4 мг/кг/сут (2–4 раза в день).
- Пропафенон (Ритмонорм, Пропанорм), блокатор натриевых каналов (IС класс). Суточная доза — 7–15 мг/кг/сут (3 раза в день).
- Аллапинин (IС класс). Суточная доза — 1 мг/кг/сут (3 раза в день).
- Амиодарон, блокатор калиевых каналов (III класс). Суточная доза: доза насыщения — 10 мг/кг/сут (2 раза в день) — 10 дней. Поддерживающая доза — 5 мг/кг/сут.
- Соталол (Соталекс) (III класс). Суточная доза — 1–4 мг/кг/сут (2 раза в день).
У детей с ЖЭС на фоне патологии сердца показано лечение основного заболевания, коррекция метаболических нарушений в миокарде. При частой ЖЭС, рефрактерной к ААТ, осложненной развитием аритмогенной кардиомиопатии, целесообразно рассмотреть вопрос о проведении РЧА. Имеются следующие международные рекомендации по проведению РЧА у детей с желудочковыми аритмиями [6]:
Показания класса I:
Наличие аритмогенной дисфункции миокарда, развившейся на фоне частой ЖЭС. РЧА может быть проведена при неэффективности ААТ либо может быть первой линией терапии.
Показания класса IIА:
Наличие симптомов заболевания, которые коррелируют с частой ЖЭС или ускоренным идиовентрикулярным ритмом.
Класс III (противопоказания):
- Бессимптомная ЖЭС, когда не прогнозируется развитие аритмогенной дисфункции миокарда.
- ЖЭС, обусловленная преходящими причинами: острый миокардит, токсическое влияние медикаментов и т. д.
Таким образом, в большинстве случаев идиопатическая желудочковая экстрасистолия у детей имеет благоприятное течение и не требует антиаритмической терапии. В тех редких случаях, когда частая желудочковая экстрасистолия носит устойчивый характер, плохо переносится ребенком или приводит к развитию аритмогенной кардиомиопатии, приходится прибегать к назначению антиаритмической терапии, которая требует настороженности врача в отношении побочных и проаритмогенных эффектов препаратов. Еще в более редких случаях детям с желудочковой экстрасистолией требуется проведение радиочастотной аблации источника аритмии, что является более эффективным методом лечения, чем антиаритмическая терапия, но имеются риск осложнений из-за инвазивности процедуры и возрастные ограничения по проведению у детей первых лет жизни.
Литература
- Клинические рекомендации по детской кардиологии и ревматологии / Под ред. проф. М. А. Школьниковой, проф. Е. А. Алексеевой. М., 2011. 503 с.
- Воробьев А. С. Электрокардиография. СПб: СпецЛит, 2011. 456 с.
- Макаров Л. М., Комолятова В. Н., Зевальд С. В. и др. Холтеровское мониторирование у здоровых детей первых дней жизни // Кардиология. 2009; 49 (10): 27–30.
- Молочникова К. Б., Кручина Т. К., Новик Г. А., Гордеев О. Л., Егоров Д. Ф. Идиопатическая желудочковая экстрасистолия у детей: факторы, определяющие прогноз заболевания // Вестник аритмологии. 2017; 88: 52–56.
- Dabbagh G. S., Bogun F. Predictors and Therapy of Cardiomyopathy Caused by Frequent Ventricular Ectopy // Curr Cardiol Rep. 2017 Sep; 19 (9): 80.
- Crosson J. E., Callans D. J., Bradley D. J. et.al. PACES/HRS Expert Consensus Statement on the Evaluation and Management of Ventricular Arrhythmias in the Child With a Structurally Normal Heart // Heart Rhythm. 2014; 11 (9): e55–78.
- Бокерия Л. А., Ревишвили А. Ш., Голицын С. П. и др. Клинические рекомендации по проведению электрофизиологических исследований, катетерной аблации и применению имплантируемых антиаритмических устройств. М.: Новая редакция, 2013. 595 с.
Т. К. Кручина* , 1 , доктор медицинских наук, профессор
Е. С. Васичкина**, доктор медицинских наук
К. Б. Алексеева*
Г. А. Новик*, доктор медицинских наук, профессор
* ГБОУ ВПО СпбГПМУ МЗ РФ, Санкт-Петербург
** ФГБУ НМИЦ им. В. А. Алмазова МЗ РФ, Санкт-Петербург
Желудочковая экстрасистолия у детей: классификация, принципы наблюдения и лечения/ Т. К. Кручина, Е. С. Васичкина, К. Б. Алексеева, Г. А. Новик
Для цитирования: Лечащий врач № 1/2018; Номера страниц в выпуске: 35-37
Теги: желудочковая экстрасистолия, дети, антиаритмическая терапия, радиочастотная аблация
Забирают в армию с синдромом ВПВ? Мы вам поможем!
Развитие врожденного синдрома WPW провоцирует преждевременное возбуждение желудочков сердца. Неправильная работа сердечной мышцы становится причиной учащенного сердцебиения, проблем с дыханием, обморочных состояний и других неприятных симптомов. В армии контролировать состояние больного и купировать приступы аритмии очень сложно. В связи с опасностью последствий данной патологии для здоровья призывника, сомнений по поводу того, берут ли в армию с синдромом ВПВ, быть не должно.
С врожденными болезнями на службу не призывают, но в случае с аномалией WPW не все так просто. Чтобы добиться освобождения, очень важно получить максимально точный диагноз и подтвердить его медицинскими заключениями.

Категории годности при синдроме WPW
В медицине применяются 2 понятия: синдром и феномен WPW. По симптоматике и характеру течения это разные патологии. В большинстве случаев военнообязанных с синдромом WPW (синдром Вольфа Паркинсона Уайта) освобождают от службы. Это связано с условиями армейской жизни. Больным нужен качественных уход и своевременное лечение.
Постоянные физические нагрузки и стрессовые состоянияпротивопоказаны. Любая форма заболевания может привести к серьезным последствиям для здоровья, вплоть до смертельного исхода.
На вопрос, берут ли в армию с феноменом ВПВ, врачи не дают однозначного ответа. Сама по себе аномалия не является болезнью. Термин используют при отклонениях, которые регистрируют на электрокардиограмме сердца. Ритм имеет все признаки возбуждения желудочков, но у обследуемого не наблюдается симптоматика, характерная для синдрома ВПВ.
Феномен WPW сердца на качество жизни не влияет, не требует лечения и не является препятствием для призыва. Однако, риск осложнений и вероятность развития синдрома на фоне феномена очень высок. Спровоцировать трансформацию способны физические нагрузки, стрессы, смена климата, алкоголь и другие неблагоприятные факторы.
Решение о негодности к армейской службе сотрудники военкомата выносят с учетом результатов освидетельствования.
- I класс – скрытая форма, не предполагающая ограничений физической активности.
- II класс – форма заболевания, сопровождающаяся появлением симптоматики при обычной нагрузке. Предусмотрены незначительные ограничения физической активности.
- III и IV – выраженная симптоматика в состоянии покоя и при минимальных нагрузках. Рекомендовано серьезное ограничение физической активности.
Какие еще есть диагнозы в Расписании болезней, которые освобождают от армии, читайте в нашей статье.
Негодными к службе с присвоением категории Д признают молодых людей с сердечной недостаточностью III и IV функционального класса. Категория В утверждается для I и II ФК.
Для получения непризывной категории в военкомат необходимо предоставить объективные данные о функционировании сердца. Записи кардиолога в медицинской книжке бывает недостаточно, так как сбои в работе сердца и стойкое нарушение сердечного ритма могут характеризовать другие заболевания. Чтобы подтвердить синдром Вольфа Паркинсона Уайта призывнику предстоит пройти дополнительное обследование от военного комиссариата.
Среди диагностических процедур назначают пробы с нагрузками, электрофизиологическое исследование, УЗИ, круглосуточную регистрацию ЭКГ, электрокардиографию и др.
Гарантированное освобождение от армии предоставляется при наличии медицинских заключений, подтверждающих большинство проявлений синдрома WPW.
Заключение
В случае с синдромом и феноменом ВПВ определяющую роль играет точность и своевременность диагноза. Для доказательства его несовместимости с армейской жизнью в военкомат необходимо принести все медицинские документы, в которых отражены факты обращения к специалистам и результаты диагностических мероприятий.
Если сотрудники не признают заболевание непризывным и будут настаивать на прохождении срочной службы, решение всегда можно оспорить в досудебном и судебном порядке. Юридические дела с военным комиссариатом лучше доверить профессионалам “Военно-врачебной коллегии”. Вам помогут серьезно подготовиться к призывной комиссии и грамотно аргументировать законное право на освобождение. Записывайтесь на бесплатную консультацию в форме ниже.
Что такое феномен WPW, берут ли в армию с синдромом ВПВ, чем опасна аномалия при прохождении военной службы, какую категорию выставят, читайте в нашей статье.
Читайте также:
- Кондиционер потребляет больше чем в паспорте
- Как выплачиваются отпускные врачам
- Что понимается под прикосновенностью к преступлению влечет ли она уголовную ответственность
- Что значит ваша фамилия в списке должников
- Когда британские детективы впервые использовали отпечатки пальцев для раскрытия преступления