Кто осуществляет транспорт аминокислот в клетке
Обновлено: 01.06.2024
Транспортные белки — это группа белков, переносящие различные лиганды через клеточную мембрану и внутрь клетки, если организм одноклеточный, и между различными клетками (если организм многоклеточный).
Особенности транспортных белков
Есть несколько функций, которые белки выполняют в клетках. Это:
- каталитическая;
- строительная;
- ферментативная;
- энергетическая и др.
Все белковые молекулы приравниваются к гетерополимерам и отличаются различной длиной. Мономеры белков — это аминокислоты. Белок состоит из таких веществ как кислород, водород, углерод, азот. Практически во всех белках есть в составе сера, так как она считается основной составляющей аминокислот цистеина и метионина.
Транспортные белки могут внедряться в мембрану или секретироваться из клетки в виде растворов из ядра и органелл эукариотического организма.
Основные группы транспортных белков:
- хелатирующие;
- ионные;
- транспортирующие.
Транспортная функция белков — это процесс участия белков в переносе веществ в клетки и за пределы клеток, а также внутри клеточного пространства.
В организме человека функция белков находит реализацию в транспорте крови и прочих жидкостей организма, имеющих в составе белковые молекулы.
Транспортная функция каждой группой упомянутых белков выполняется по-своему: в зависимости от скорости и направления транспорта. Принято считать, что белковая молекула может укладываться разнообразными способами, а также принимать разные формы и конформации. Все это зависит от:
- условий pH;
- уровня температуры;
- наличия конкретных ионов.
Кроме того, структура определяется способом сворачивания полипептидной цепи внутри раствора — на это влияет последовательность аминокислот.
Специфика видов транспорта
Белки помогают осуществлять различные виды транспорта. Степень прохождения веществ через билипидный мембранный слой определяет перенос веществ через клеточную мембрану, который протекает в несколько этапов.
Чтобы клетка полноценно функционировала, в нее должны поступать:
- углеводы;
- аминокислоты;
- ионы щелочных металлов.
Слои липидов для различных веществ являются практически непроницаемыми. Поэтому внутри мембраны есть специализированные транспортные белки — они переносят полярно заряженные соединения.
Такой транспорт веществ бывает:
- активным. Он реализуется с помощью специализированных каналов внутри мембраны против градиента концентрации — в ходе процесса происходят определенные затраты энергии. Активный транспорт предполагает активное участие белков-переносчиков. Чтобы такой перенос состоялся, нужна энергия — транспортные белки ее получают в результате расщепления АТФ;
- пассивным. Реализуется из области высокой концентрации в область низкой концентрации. При этом затрат энергии не наблюдается. Такой путь имеет вид диффузии, которая может быть простой и облегченной.
Облегченная и простая диффузия
Белки-переносчики обеспечивают облегченную диффузию. Этот вариант транспорта реализуют различные конформации белка — в процессе могут участвовать несколько белков или один.
При участии одной лишь транслоказы, то белок связывает вещество и сближается с другой стороной мембраны. После чего он отдает связанное вещество и возвращается в исходное положение.
Если участвует несколько белков, то один из них связывается с исходным веществом, передает его другому белку до того времени, пока вещество не доходит по цепи до другой стороны мембраны.
Пассивный транспорт может осуществляться по белкам-каналам. Эти каналы образуют водные поры — они находятся в открытом состоянии в определенный момент времени. Каналы служат средством транспортировки белков из одной клетки в другую.
Также вещества могут попасть в клетку с помощью эндоцитоза: в этом процессе принимают участие только специализированные транспортные белки.
Простая диффузия обеспечивает попадание в клетку разнообразных гидрофобных веществ вроде кислорода, азота, бензола, а также полярных молекул вроде воды и углекислого газа. Аминокислоты и моносахариды с помощью простой диффузии попасть в клетку не могут.
Что касается воды, то она диффундирует в клетку путем осмоса.
Осмос — односторонняя диффузия воды через полупроницаемую мембрану в раствор с более высокой концентрацией.
В растворе с высокой концентрацией есть молекулы растворителя, но в минимальной концентрации. В этот раствор при помощи диффузии просачивается растворитель из области вещества с меньшей концентрацией.
Основные функции транспортных белков
Внутри клетки между ядром и другими органоидами через клеточную мембрану осуществляется перенос веществ. Этот перенос возможен за счет ядерных пор, которые пронизывают два слоя белковой оболочки. В свою очередь, оболочки тоже состоят из белков.
Перенос веществ из цитоплазмы в ядро клетки происходит вместе со специальными белками, которые называются транспортинами. Именно они распознают вещества, которые нужно транспортировать, и образуют с ними связь. Белок-транспортин соединяется с белками ядерной поры, а затем распадается. После этого транспортные белки снова возвращаются в цитоплазму.
В процессе переноса белков из цитоплазмы к другим органоидам участвуют белки-переносчики. Вещества внутри организма также переносятся при помощи белков.
Гемоглобин переносит кислород.
Плазма крови всегда содержит транспортные белки.
Транспортные белки плазмы крови — сывороточные альбумины.
Транспортировка жирных кислот происходит при помощи альбуминов сыворотки крови, а гормонов щитовидной железы — при помощи транстиретина.
Альбумины помимо прочего переносят билирубин, разнообразные лекарства, ионы и прочие вещества.
Есть и другие примеры транспортных белков.
Миоглобин, белок скелетных мышц, переносит кислород, а глобулин — гормоны и витамины.
Каждая клетка содержит тысячи белков. Свойства белков зависят от их первичной структуры , т. е. порядка соединения аминокислотных остатков в молекулах.
Информация о первичной структуре всех белков организма закодирована последовательностью нуклеотидов, образующих молекулы ДНК. В молекулах ДНК выделяют гены . Каждый ген соответствует одному белку.
Ген — это единица наследственности, представляющая собой участок ДНК, в котором закодирована первичная структура молекул одного белка.

Биосинтез происходит в клетках с огромной скоростью. В организме высших животных в одну минуту образуется до \(60\) тыс. пептидных связей.
Транскрипция — это процесс переписывания наследственной информации с молекулы ДНК на информационную (матричную) РНК.

Информационная (матричная) РНК одноцепочечная, она собирается на одной из нитей ДНК по правилу комплементарности.
Образуется молекула иРНК, которая является копией второй цепочки ДНК, только в ней тимин заменён на урацил. Закодированная в ДНК информация о первичной структуре белка таким образом переписывается на иРНК.
Молекула ДНК содержит большое количество генов. В начале каждого гена располагается промотор — особая последовательность нуклеотидов ДНК, которую определяет РНК-полимераза, и с этого места начинает сборку молекулы иРНК.
В клетках прокариот иРНК образуется в цитоплазме, поэтому образовавшиеся молекулы могут сразу принимать участие в синтезе белков на рибосомах.
В клетках эукариот транскрипция происходит в ядре, поэтому иРНК сначала через поры в ядерной мембране выходит в цитоплазму.
Для сборки белковой молекулы в цитоплазме клетки должны присутствовать все необходимые аминокислоты. Они образуются при расщеплении белков, поступающих с пищей, или синтезируются в самом организме.
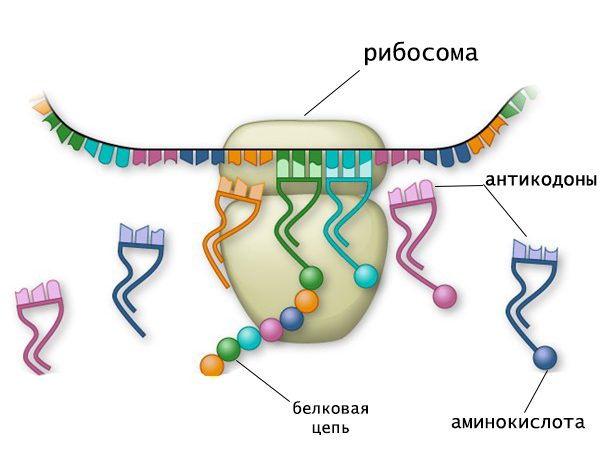
Аминокислоты доставляются к рибосомам транспортными РНК (тРНК). Аминокислота попадает в рибосому только в комплексе с сответствующей тРНК.
К кодону, расположенному в активном центре рибосомы, присоединяется тРНК с комплементарным антикодоном. Соединённая с ней аминокислота образует пептидную связь к растущей полипептидной цепочкой. Затем рибосома перемещается на следующий кодон иРНК. В рибосоме оказывается тРНК с антикодоном, комплементарным следующему триплету в иРНК, и к образующейся молекуле белка присоединяется следующая аминокислота.

Рибосома постепенно сдвигается по иРНК, задерживаясь на следующих триплетах. Так поэтапно собирается молекула белка.
Синтез полипептидной цепи заканчивается, когда в активном центре рибосомы оказывается стоп-кодон (УАА, УАГ или УГА). Молекула белка отсоединяется от рибосомы, выходит в ЭПС или цитоплазму и усложняется, образуя характерную вторичную, третичную и четвертичную структуры.
На одной иРНК одновременно находятся несколько рибосом и происходит синтез нескольких молекул белка. Рибосомы, которые связаны с одной иРНК и синтезируют один и тот же белок, образуют полисому .
Когда синтез данного белка окончен, рибосома может найти другую иРНК и начать синтезировать другой белок.

последовательность нуклеотидов матричной цепи ДНК: ААГ ГЦТ ТАГ.
При транскрипции на этой цепи по принципу комплементарности образуется участок иРНК с нуклеотидами УУЦ ЦГА АУЦ, на котором в результате трансляции образуется цепочка из аминокислот: фенилаланин — аргинин — серин.
Если в одном из триплетов произойдёт замена нуклеотидов или они поменяются местами, то может случиться так, что триплет станет кодировать какую-нибудь другую аминокислоту. Значит, произойдут изменения и в строении белка, закодированного данным геном, что может оказать влияние на процессы обмена веществ и изменить признаки организма.
Транспортные РНК (тРНК) представляют собой небольшие молекулы с количеством нуклеотидов от 70 до 90. На долю тРНК приходится примерно 15 % всех РНК клетки. Функция тРНК зависит от ее строения. Изучение структуры молекул тРНК показало, что они свернуты определенным образом и имеют вид клеверного листа (рис. 20). В молекуле выделяются петли и двойные участки, соединенные за счет взаимодействия комплементарных оснований. Наиболее важной является центральная петля, в которой находится антикодон — нуклеотидный триплет, соответствующий коду определенной аминокислоты. Своим антикодоном тРНК способна соединяться с соответствующим кодоном на иРНК по принципу комплементарности.
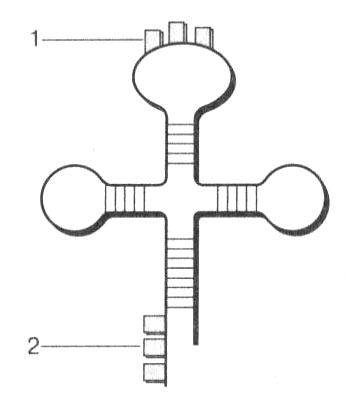
Рис. 20. Строение молекулы тРНК: 1 — антикодон; 2 — место присоединения аминокислоты
Каждая тРНК может переносить только одну из 20 аминокислот. Значит, для каждой аминокислоты имеется по меньшей мере одна тРНК. Так как аминокислота может иметь несколько триплетов, то и количество видов тРНК равно числу триплетов аминокислоты. Таким образом, общее число видов тРНК соответствует числу кодонов и равно 61. Трем стоп-кодам не соответствует ни одна тРНК.
На одном конце молекулы тРНК всегда находится нуклеотид гуанин (5'-конец), а на другом (3'-конце) всегда три нуклеотида ЦЦА. Именно к этому концу идет присоединение аминокислоты (рис. 21). Каждая аминокислота присоединяется к своей специфической тРНК с соответствующим антикодоном. Механизм этого присоединения связан с работой специфических ферментов — аминоацил-тРНК-синтетазами, которые присоединяют каждую аминокислоту к соответствующей тРНК. Для каждой аминокислоты имеется своя синтетаза. Соединение аминокислоты с тРНК осуществляется за счет энергии АТФ, при этом макроэргическая связь переходит в связь между тРНК и аминокислотой. Так происходит активирование и кодирование аминокислот.
Этапы биосинтеза белка. Процесс синтеза полипептидной цепи, осуществляемый на рибосоме, называется трансляцией. Информационная РНК (иРНК) является посредником в передаче информации о первичной структуре белка, тРНК переносит закодированные аминокислоты к месту синтеза и обеспечивает последовательность их соединений. В рибосомах осуществляется сборка полипептидной цепи.
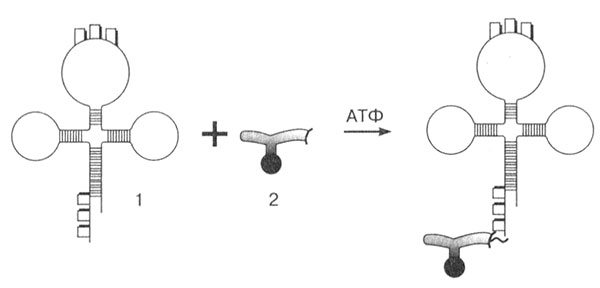
Рис. 21. Активирование и кодирование аминокислоты: 1 — тРНК; 2 — аминокислота
В рибосоме имеются три центра, с которыми связываются молекулы РНК: один центр для иPHК и два — для тРНК. Одна тРНК с аминокислотой удерживается в аминоацильном центре, а другая — в пептидном центре, где идет рост полипептидной цепи.
Первый этап — инициация. Синтезированная в процессе транскрипции иPHК выходит из ядра и направляется в цитоплазму к месту синтеза белка — рибосоме. За счет различных белковых факторов и энергии АТФ происходит соединение иPHК и двух субъединиц рибосом, которые до этого момента находились в диссоциированном состоянии. Прежде чем рибосома начнет синтез полипептидной цепи, к иРНК должна присоединиться особая молекула — инициаторная тРНК с аминокислотой. С нее всегда начинается синтез белка. По принципу комплементарности тРНК своим антикодоном соединяется с кодоном на иРНК и входит в рибосому. Этот кодон на иPHК называется старт-кодоном.
В результате взаимодействия всех компонентов образуется комплекс: рибосома — иРНК — тРНК-инициатор — аминокислота.
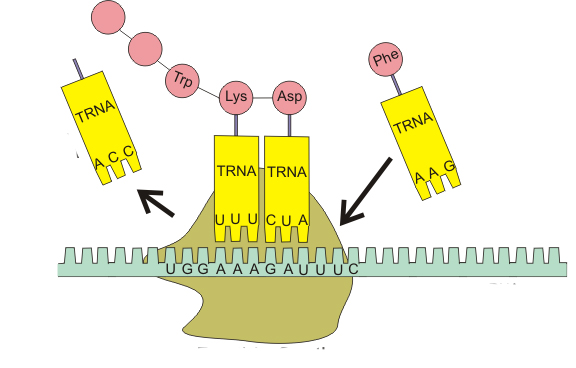
Вторая стадия — элонгация. Это стадия роста полипептидной цепи. Далее начинается сборка полипептидной цепи. Следующая тРНК с аминокислотой по принципу комплементарности антикодона с кодоном соединяется с иPHК и входит в рибосому. Первая тРНК закрепляется в пептидном центре, а вторая тРНК — с аминокислотой в аминоацильном центре. Аминокислоты сближаются друг с другом, между ними возникает пептидная связь, и образуется дипептид. При этом первая тРНК освобождается и, покидая рибосому, тянет за собой иPHК, которая продвигается на один триплет.
Вторая тРНК с дипептидом перемещается в пептидный центр, а в рибосому входит третья тРНК с аминокислотой (рис. 22). Весь процесс далее вновь и вновь повторяется. иРНК, последовательно продвигаясь через рибосому, каждый раз вносит новую тРНК с аминокислотой и выносит освободившуюся тРНК. Постепенно идет наращивание полипептидной цепи. Весь процесс обеспечивается деятельностью ферментов и энергией макроэргических соединений (АТФ и др.).
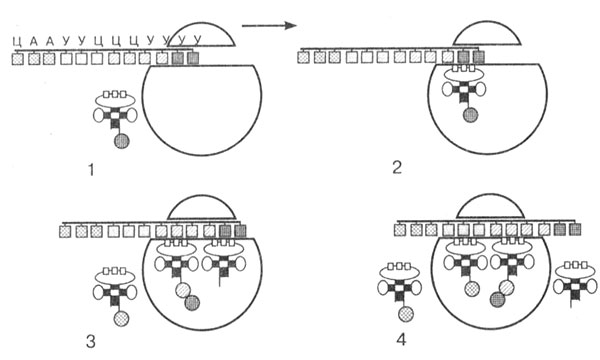
Рис. 22. Схема биосинтеза полипептидной цепи. Стрелкой показано направление движения иPHК
Последний этап — терминация. Как только в аминоацильный центр попадает стоп-кодон, синтез прекращается. Место тРНК занимает в этом случае специфический белок-фермент, который осуществляет гидролиз связи между последней тРНК и синтезированным белком. Рибосома снимается с иPHК и распадается на две субъединицы, последняя тРНК также освобождается и попадает вновь в цитоплазму. Синтезированная молекула белка поступает в ЭПС или цитоплазму, где претерпевает изменения и приобретает соответствующие структуры.
Процесс трансляции обычно осуществляется многократно. Одна иPHК может соединяться с несколькими рибосомами, образуя поли рибосому.; или полисому, на которой идет одновременно синтез многих молекул одного белка (рис. 23).
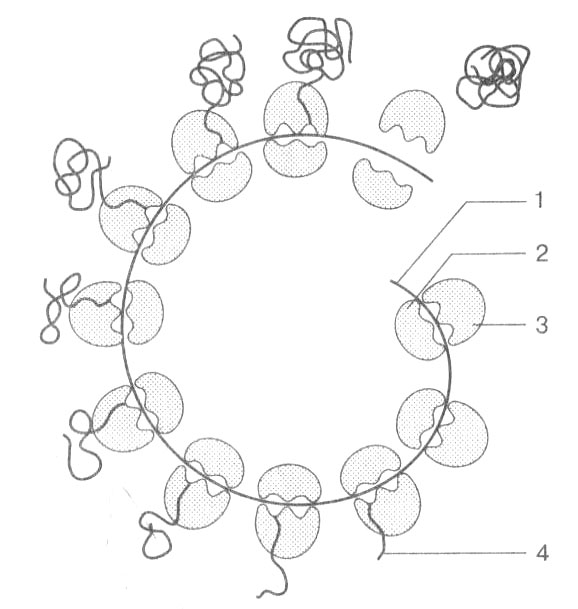
Рис. 23. Полисома: 1 — иPHК; 2 — малая субъединица рибосомы; 3 — большая субъединица рибосомы; 4 — синтезируемая полипептидная цепь
Если синтез происходит на гранулярной эндоплазматической сети, то поли пептидная цепь поступает в канальца эндоплазматической сети. Здесь она приобретает свою окончательную структуру и превращается в молекулу белка. Далее белок поступает в аппарат Гольджи и выносится из клетки. Если синтез происходит на рибосомах в цитоплазме, то синтезированные молекулы остаются и используются клеткой.
Весь процесс синтеза одного белка длится от 20 до 500 с и зависит от длины полипептида. Например, в рибосоме кишечной палочки белок из 300 аминокислот синтезируется приблизительно за 20 с.

Вторым этапом реализации генетической информации является синтез белковой молекулы на основе матричной РНК (трансляция). Однако в отличие от транскрипции нуклеотидная последовательность не может быть переведена в аминокислотную напрямую, так как эти соединения имеют разную химическую природу. Поэтому для осуществления трансляции требуется посредник в виде транспортной РНК (тРНК), функция которого состоит в переводе генетического кода на "язык" аминокислот.
Общая характеристика транспортной РНК
Транспортные РНК или тРНК - это небольшие молекулы, которые доставляют аминокислоты к месту синтеза белка (в рибосомы). Количество этого вида рибонуклеиновой кислоты в клетке составляет примерно 10 % от общего пула РНК.
Как и другие разновидности рибонуклеиновых кислот, тРНК состоит из цепочки рибонуклеозидтрифосфатов. Длина нуклеотидной последовательности насчитывает 70-90 звеньев, и около 10 % состава молекулы приходится на минорные компоненты.
Из-за того, что каждой аминокислоте соответствует свой переносчик в виде тРНК, клетка синтезирует большое количество разновидностей этой молекулы. В зависимости от вида живого организма этот показатель варьирует от 80 до 100.
Функции тРНК
Транспортная РНК является поставщиком субстрата для белкового синтеза, который происходит в рибосомах. За счет уникальной способности связываться и с аминокислотами, и с матричной последовательностью тРНК выполняет функцию смыслового адаптера при переводе генетической информации из формы РНК в форму белка. Взаимодействие такого посредника с кодирующей матрицей, как в транскрипции, основано на принципе комплементарности азотистых оснований.
Главная функция тРНК заключается в акцептировании аминокислотных звеньев и их транспортировке в аппарат белкового синтеза. За этим техническим процессом стоит огромный биологический смысл - реализация генетического кода. Осуществление этого процесса основано на следующих особенностях:
- все аминокислоты кодируются триплетами нуклеотидов;
- для каждого триплета (или кодона) существует антикодон, входящий в состав тРНК;
- каждая тРНК может связаться только с определенной аминокислотой.
Таким образом, аминокислотная последовательность белка определяется тем, какие тРНК и в каком порядке будут комплементарно взаимодействовать с матричной РНК в процессе трансляции. Это возможно благодаря наличию в транспортной РНК функциональных центров, один из которых отвечает за избирательное присоединение аминокислоты, а другой - за связывание с кодоном. Поэтому функции и структура тРНК тесно взаимосвязаны.
Строение транспортной РНК
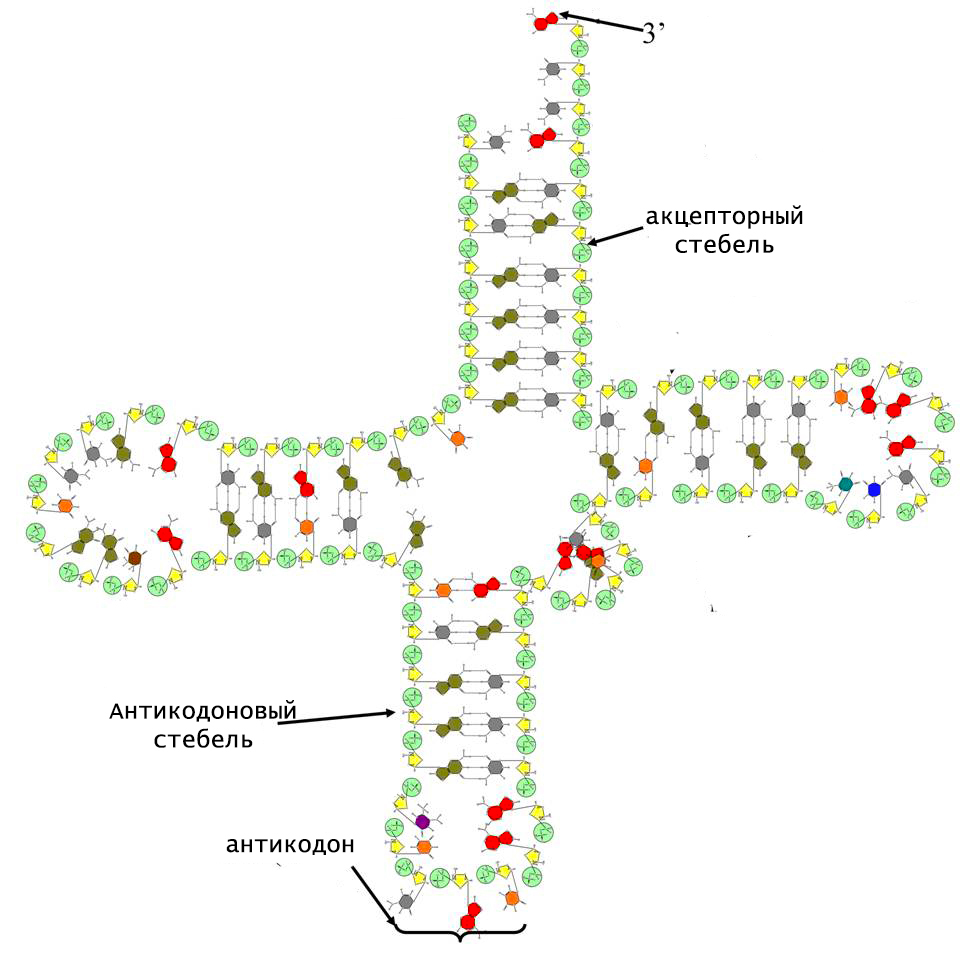
Уникальность тРНК заключается в том, что ее молекулярная структура не линейна. Она включает в себя спиральные двуцепочечные участки, которые называют стеблями, и 3 одноцепочечные петли. По форме такая конформация напоминает клеверный лист.
В структуре тРНК различают следующие стебли:
- акцепторный;
- антикодоновый;
- дигидроуридиловый;
- псевдоуридиловый;
- добавочный.
Двойные спирали стеблей содержат от 5 до 7 Уотсон-Криксоновских пар. На конце акцепторного стебля расположена небольшая цепочка неспаренных нуклеотидов, 3-гидроксил которой является местом прикрепления соответствующей молекулы аминокислоты.
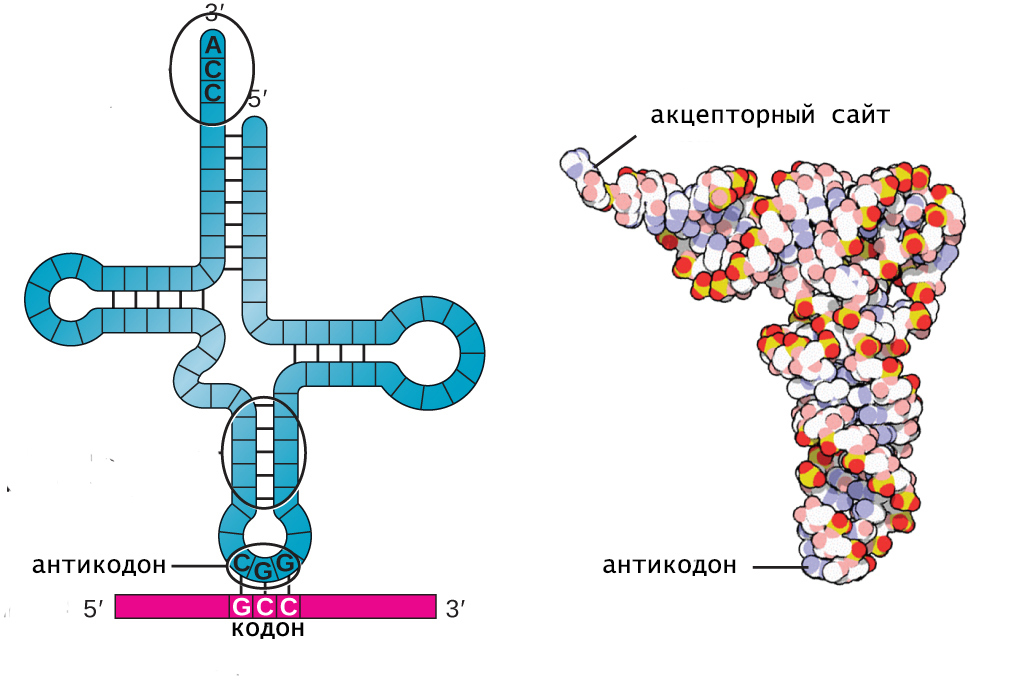
Структурной областью для соединения с мРНК служит одна из петель тРНК. Она содержит антикодон, комплементарный смысловому триплету в матричной РНК. Именно антикодон и акцептирующий конец обеспечивают адапторную функцию тРНК.
Третичная структура молекулы
"Клеверный лист" является вторичной структурой тРНК, однако за счет фолдинга молекула приобретает L-образную конформацию, которая скрепляется дополнительными водородными связями.
L-форма представляет собой третичную структуру тРНК и состоит из двух практически перпендикулярных А-РНК спиралей, имеющих длину 7 нм и толщину 2 нм. Такая форма молекулы имеет всего 2 конца, на одном из которых расположен антикодон, а на другом - акцепторный центр.
Особенности связывания тРНК с аминокислотой
Активацию аминокислот (их присоединение к транспортной РНК) осуществляет аминоацил-тРНК-синтетаза. Этот фермент одновременно выполняет 2 важных функции:
- катализирует образования ковалентной связи между 3`-гидроксильной группой акцепторного стебля и аминокислотой;
- обеспечивает принцип избирательного соответствия.
Для каждой из 20 аминокислот есть своя аминоацил-тРНК-синтетаза. Она может взаимодействовать только с соответствующим видом транспортной молекулы. Это означает, что антикодон последней должен быть комплементарен триплету, кодирующему именно эту аминокислоту. Например, синтетаза лейцина будет соединяться только с предназначеным для лейцина тРНК.
В молекуле аминоацил-тРНК-синтетазы есть три нуклеотид-связывающих кармана, конформация и заряд которых комплементарны нуклеотидам соответствующего антикодона в тРНК. Таким образом, фермент определяет нужную транспортную молекулу. Гораздо реже фрагментом опознавания служит нуклеотидная последовательность акцепторного стебля.
Читайте также:

