Какой вид рнк осуществляет перенос аминокислот к рибосомам
Обновлено: 17.05.2024
Дезоксирибонуклеиновая кислота (ДНК) является биополимером, который состоит из мономеров – нуклеотидов. Каждый нуклеотид состоит из трёх компонентов: азотистого основания, сахара (дезоксирибозы), остатка фосфорной кислоты.
Соединение нуклеотидов в цепь происходит при участии фермента ДНК-полимеразы, которая обеспечивает присоединение каждого последующего нуклеотида через его фосфатную группу к гидроксилу в 3’ положении предыдущего нуклеотида. В результате полинуклеотидная цепь образуется путём образования фосфодиэфирных связей. На одном конце цепи находится фосфатная группа в положении 5’ и на другом – гидроксильная группа в положении 3’.
Полинуклеотидная цепь включает в себя 4 разновидности нуклеотидов, содержащие разные азотистые основания – пуриновые (аденин и гуанин) или пиримидиновые (тимин и цитозин).Название нуклеотида является производным от названия соответствующего азотистого основания. Нуклеотиды и азотистые основания обозначаются заглавными буквами:
Молекула ДНК состоит из двух цепей, закрученных спирально вокруг общей оси. Цепи в молекуле ДНК соединены по принципу комплементарности и антипараллельности.
Принцип комплементарности подразумевает установление водородных связей между строго определенными азотистыми основаниями двух цепей. Аденин соединяется двумя водородными связями с тимином, а гуанин – тремя водородными связями с цитозином. Таким образом, в молекуле ДНК количество пуриновых азотистых оснований всегда соответствует количеству пиримидиновых азотистых оснований (правило Чаргаффа): А+Г = Т+Ц, причём А=Т, а Г=Ц.
Принцип антипараллельности подразумевает, что две полинуклеотидные цепи соединены так, что 5’ конец одной из них соединён с 3’ концом другой и наоборот.
Таким образом, в соответствии с моделью Уотсона и Крика две полинуклеотидные цепочки, соединённые водородными связями между комплементарными азотистыми основаниями, спирально закручены вокруг общей оси. Диаметр такой спирали составляет 2 нм. Длина одного витка – 3,4 нм и он включает в себя 10 пар нуклеотидов. Рассотяние между парами нуклеотидов составляет 0,34 нм. Эти параметры относятся к В-форме (правосторонняя) ДНК.
В любой живой системе ДНК выполняет следующие функции:
1. хранение наследственной информации в виде последовательности нуклеотидов (генетический код), которая определяет последовательность аминокислот в полипептидной цепи и свойства белка;
2. передача наследственного материала происходит путем репликации ДНК;
3. реализация наследственной информации в процессе синтеза белка.
внимательно прочитайте содержание работы № 1;
изучите и зарисуйте схему строения нуклеотида.

Нуклеозид = пентоза + азотистое основание
Нуклеотид = нуклеозид + фосфорная кислота = азотистое основание+ пентоза+фосфорная кислота.
В РНК пентоза - рибоза
В ДНК пентоза - дезоксирибоза
Рис. 1. Схема строения нуклеотида
изучите и зарисуйте схему соединения нуклеотидов в полинуклеотидную цепь.

Нуклеотиды соединяются друг с другом в полимерную цепочку с помощью фосфодиэфирных связей. Азотистые основания не принимают участия в соединении нуклеотидов одной цепи.
Рис. 2. Схема соединения нуклеотидов в полинуклеотидную цепь
изучите и зарисуйте схему строения молекулы ДНК.


Рис. 3. Схема строения ДНК
РАБОТА № 2. РЕПЛИКАЦИЯ (РЕДУПЛИКАЦИЯ) ДНК
Репликация ДНК — процесс самоудвоения, главное свойство молекулы ДНК. Репликация относится к категории реакций матричного синтеза, идет с участием ферментов. Под действием ферментов молекула ДНК раскручивается, и около каждой цепи, выступающей в роли матрицы, по принципам комплементарности и антипараллельности достраивается новая цепь. Таким образом, в каждой дочерней ДНК одна цепь является материнской, а вторая — вновь синтезированной. Такой способ синтеза называется полуконсервативным.
В репликации участвуют следующие ферменты:
ДНК-топоизомеразы (разрезают ДНК);
ДНК-полимеразы (подбирают дезоксирибонуклеозидтрифосфаты и комплементарно присоединяют их к матричной цепи ДНК);
РНК-праймазы (образуют РНК-затравки, праймеры);
ДНК-лигазы (сшивают фрагменты ДНК).
С помощью геликаз в определенных участках ДНК расплетается, одноцепочечные участки ДНК связываются дестабилизирующими белками, образуется репликационная вилка. При расхождении 10 пар нуклеотидов (один виток спирали) молекула ДНК должна совершить полный оборот вокруг своей оси. Чтобы предотвратить это вращение ДНК-топоизомераза разрезает одну цепь ДНК, что дает ей возможность вращаться вокруг второй цепи.
ДНК-полимераза может присоединять нуклеотид только к 3'-углероду дезоксирибозы предыдущего нуклеотида, поэтому данный фермент способен передвигаться по матричной ДНК только в одном направлении: от 3'-конца к 5'-концу этой матричной ДНК. Так как в материнской ДНК цепи антипараллельны, то на ее разных цепях сборка дочерних полинуклеотидных цепей происходит по-разному и в противоположных направлениях. На цепи 3'–5' синтез дочерней полинуклеотидной цепи идет без перерывов; эта дочерняя цепь будет называться лидирующей. На цепи 5'–3' - прерывисто, фрагментами (фрагменты Оказаки), которые после завершения репликации ДНК-лигазами сшиваются в одну цепь; эта дочерняя цепь будет называться запаздывающей (отстающей).
Репликация протекает сходно у прокариот и эукариот. Скорость синтеза ДНК у прокариот на порядок выше (1000 нуклеотидов в секунду), чем у эукариот (100 нуклеотидов в секунду). Репликация начинается одновременно в нескольких участках молекулы ДНК. Фрагмент ДНК от одной точки начала репликации до другой образует единицу репликации — репликон.
Репликация происходит перед делением клетки, в S-период интерфазы. Благодаря этой способности ДНК осуществляется передача наследственной информации от материнской клетки дочерним.
внимательно изучите содержание работы № 2;
зарисуйте и обозначьте схему репликации ДНК.

Рис. 4. Схема репликации ДНК
РАБОТА № 3. СТРОЕНИЕ И ФУНКЦИИ РНК.
Наследственная информация, записанная с помощью генетического кода, хранится в молекуле ДНК. Процессы жизнедеятельности осуществляются в клетке на основе полученной информации, однако в этих процессах участвует не сама ДНК, а РНК, выполняющая роль посредника.
Рибонуклеиновые кислоты (РНК), присутствующие в клетках как прокариот, так и эукариот, бывают трёх основных типов: информационная (матричная) РНК, транспортная РНК, рибосомная РНК. В ядре клеток эукариот также содержится гетерогенная ядерная РНК.
В отличие от молекулы ДНК, РНК представляет собой одну полинуклеотидную цепь, включающую 4 разновидности нуклеотидов, содержащих остаток фосфорной кислоты, сахар – рибозу и одно из четырёх азотистых оснований – аденин, гуанин, цитозин и урацил (вместо тимина).
Все виды РНК представляют собой неразветвленные полинуклеотиды, имеют специфическую пространственную конформацию и принимают участие в процессах синтеза белка. Информация о строении всех видов РНК хранится в ДНК. Процесс синтеза РНК на матрице ДНК называется транскрипцией.
Транспортные РНК содержат обычно 76 (от 75 до 95) нуклеотидов; молекулярная масса — 25 000–30 000. На долю тРНК приходится около 10% от общего содержания РНК в клетке.
Рибосомные РНК содержат 3000–5000 нуклеотидов; молекулярная масса — 1 000 000–1 500 000. На долю рРНК приходится 80–85% от общего содержания РНК в клетке. В комплексе с рибосомными белками рРНК образует рибосомы — органоиды, осуществляющие синтез белка. В эукариотических клетках синтез рРНК происходит в ядрышках.
Функции рРНК: 1) необходимый структурный компонент рибосом и, таким образом, обеспечение функционирования рибосом; 2) обеспечение взаимодействия рибосомы и тРНК; 3) первоначальное связывание рибосомы и кодона-инициатора иРНК и определение рамки считывания, 4) формирование активного центра рибосомы.
Информационные РНК разнообразны по содержанию нуклеотидов и молекулярной массе (от 50 000 до 4 000 000). На долю иРНК приходится до 5% от общего содержания РНК в клетке.
Функции иРНК: 1) перенос генетической информации от ДНК к рибосомам, 2) матрица для синтеза молекулы белка, 3) определение аминокислотной последовательности первичной структуры белковой молекулы.
изучите и зарисуйте схему строения нуклеотида РНК (рис. 5);
изучите и зарисуйте схему строения молекулы тРНК (рис. 6).

Нуклеотиды РНК содержат остаток фосфорной кислоты, сахар – рибозу и одно из четырёх азотистых оснований – аденин, гуанин, цитозин и урацил (вместо тимина).
70-90Н | вторичная стр-ра- клеверный лист | CCA 3' const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле - защита от рибонуклеаз ? долгоживущие | Разнообразие первичных структур tРНК - 61+1 - по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по кол-ву аминокислот) | рекогниция - образование ковалентной связи м-у tРНК и актой | аминоацил-тРНК-синтетазы присоединяют акты к тРНК
Функция тРНК заключается в переносе аминокислот из цитоплазмы в рибосомы, в которых происходит синтез белков.
тРНК связывающие одну аминокислоту называются изоакцепторными.
Всего в клетке одновременно существует 64 различных тРНК.
Каждая тРНК спаривается только со своим кодоном.
Каждая тРНК распознает свой собственный кодон без участия аминокислоты. Связавшиеся с тРНК аминокислоты химически модифицировали, после чего анализировали получившийся полипептид, который содержал модифицированную аминокислоту. Цистеинил-тРНКCys (R=CH2-SH) восстанавливали до аланил-тРНКCys (R=CH3).
Большинство тРНК, не зависимо от их нуклеотидной последовательности, имеют вторичную структуру в форме клеверного листа из-за наличия в ней трех шпилек.
Особенности структуры тРНК
На 3'-конце молекулы всегда находятся четыре неспаренных нуклеотида, причем три из них – это обязательно ССА. 5'- и 3'-концы цепи РНК образуют акцепторный стебель. Цепи удерживают-ся вместе благодаря комплементарному спарива-нию семи нуклеотидов 5'-конца с семью нуклеотида-ми, находящимися вблизи 3'-конца. 2. У всех моле-кул имеется шпилька T?C, обозначаемая так пото-му, что она содержит два необычных остатка: рибо-тимидин (Т) и псевдоуридин (?). Шпилька состоит из двухцепочечного стебля из пяти спаренных осно- ваний, включая пару G-C, и петли длиной семь нуклеотидов. Тринуклеотид Т?С всегда расположен
в одном и том же месте петли. 3. В антикодоновой шпильке стебель всегда представлен семью спарен-
ными основаниями. Триплет, комплементарный родственному кодону,– антикодон – находится в пет-
ле, состоящей из семи нуклеотидов. С 5'-конца антикодон фланкируют инвариантный остаток ура-
цила и модифицированный цитозин, а к его 3'-концу примыкает модифицированный пурин, как правило
аденин. 4. Еще одна шпилька состоит из стебля длиной три-четыре пары нуклеотидов и петли варь-
ирующего размера, часто содержащей урацил в вос-становленной форме – дигидроурацил (DU). Наиболее сильно варьируют нуклеотидные по-следовательности стеблей, число нуклеотидов меж-ду антикодоновым стеблем и стеблем Т?С (вариа-бельная петля), а также размер петли и локализация остатков дигидроурацила в DU-петле.
[Сингер, 1998].
Третичная структура тРНК
Присоединение аминокислот к тРНК
Для того чтобы аминокислота могла образовывать полипептидную цепь она должна присоединиться к тРНК с помощью фермента аминоацил-тРНК-синтетазы. Этот фермент образует ковалентную связь между карбоксильной группой аминокислоты и гидроксильной группой рибозы на 3’-конце тРНК при участии АТФ. Аминоацил-тРНК-синтетаза узнает специфический кодон не из-за наличия антикодона на тРНК, а по наличию специфического сайта узнавания на тРНК.
Всего в клетке имеется 21 различных аминоацил-тРНК-синтетаз.
Присоединение происходит в две стадии:
1. Карбоксильная группа аминокислоты присоединяется к а-фосфату АТФ. Полученный нестабильный аминоацил-аденилат стабилизируется связываясь с ферментом.
2. Перенос аминоацильной группы аминоацил-аденилата на 2’ или 3’-OH-группу концевой рибозы тРНК
Некоторые аминоацил-тРНК-синтетазы состоят из одной полипептидной цепи, другие – из двух или четырех идентичных цепей, каждая молекулярной массой от 35 до 115 кДа. Некоторые димерные и тетрамерные ферменты состоят из субъединиц двух типов. Четкой корреляции между размером молекулы фермента или характером его субъединичной структуры и специфичностью не существует.
Специфичность фермента определяется его прочным связыванием с акцепторным концом тРНК, DU-участком и вариабельной петлей. Некоторые ферменты, по-видимому, не распознают антикодоновый триплет и катализируют реакцию аминоацетилирования даже при измененном антикодоне. Однако отдельные ферменты проявляют пониженную активность по отношению к таким модифицированным тРНК и при замене антикодона присоединяют не ту аминокислоту.
70-90н | вторичная стр-ра- клеверный лист | CCA 3' const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле - защита от рибонуклеаз ? долгоживущие | Разнообразие первичных структур tРНК - 61+1 - по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по кол-ву аминокислот)
Имеются два вида тРНК связывающие метионин тРНКFMet и тРНКMMet у прокариот и, тРНКIMetи тРНКMMet - у эукариот. К каждой тРНК добавляется метионин с помощью соответствующих аминоацил-тРНК-синтетез. метионин присоединенный к тРНКFMet и тРНКIMet формилируется ферментом метионил-тРНК-трансформилазой до Fmet-тРНКFMet. тРНК нагруженные формилметионином узнают инициаторный кодон AUG.
Транспортные РНК (тРНК) представляют собой небольшие молекулы с количеством нуклеотидов от 70 до 90. На долю тРНК приходится примерно 15 % всех РНК клетки. Функция тРНК зависит от ее строения. Изучение структуры молекул тРНК показало, что они свернуты определенным образом и имеют вид клеверного листа (рис. 20). В молекуле выделяются петли и двойные участки, соединенные за счет взаимодействия комплементарных оснований. Наиболее важной является центральная петля, в которой находится антикодон — нуклеотидный триплет, соответствующий коду определенной аминокислоты. Своим антикодоном тРНК способна соединяться с соответствующим кодоном на иРНК по принципу комплементарности.
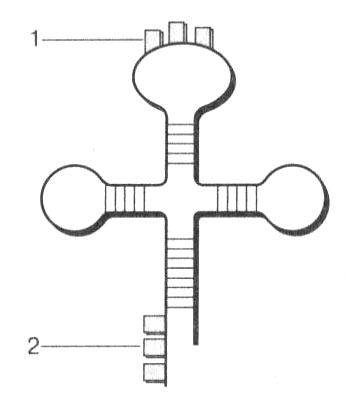
Рис. 20. Строение молекулы тРНК: 1 — антикодон; 2 — место присоединения аминокислоты
Каждая тРНК может переносить только одну из 20 аминокислот. Значит, для каждой аминокислоты имеется по меньшей мере одна тРНК. Так как аминокислота может иметь несколько триплетов, то и количество видов тРНК равно числу триплетов аминокислоты. Таким образом, общее число видов тРНК соответствует числу кодонов и равно 61. Трем стоп-кодам не соответствует ни одна тРНК.
На одном конце молекулы тРНК всегда находится нуклеотид гуанин (5'-конец), а на другом (3'-конце) всегда три нуклеотида ЦЦА. Именно к этому концу идет присоединение аминокислоты (рис. 21). Каждая аминокислота присоединяется к своей специфической тРНК с соответствующим антикодоном. Механизм этого присоединения связан с работой специфических ферментов — аминоацил-тРНК-синтетазами, которые присоединяют каждую аминокислоту к соответствующей тРНК. Для каждой аминокислоты имеется своя синтетаза. Соединение аминокислоты с тРНК осуществляется за счет энергии АТФ, при этом макроэргическая связь переходит в связь между тРНК и аминокислотой. Так происходит активирование и кодирование аминокислот.
Этапы биосинтеза белка. Процесс синтеза полипептидной цепи, осуществляемый на рибосоме, называется трансляцией. Информационная РНК (иРНК) является посредником в передаче информации о первичной структуре белка, тРНК переносит закодированные аминокислоты к месту синтеза и обеспечивает последовательность их соединений. В рибосомах осуществляется сборка полипептидной цепи.
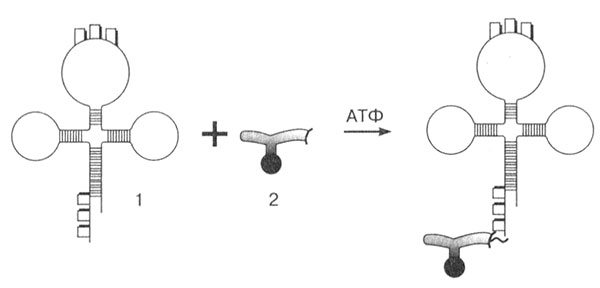
Рис. 21. Активирование и кодирование аминокислоты: 1 — тРНК; 2 — аминокислота
В рибосоме имеются три центра, с которыми связываются молекулы РНК: один центр для иPHК и два — для тРНК. Одна тРНК с аминокислотой удерживается в аминоацильном центре, а другая — в пептидном центре, где идет рост полипептидной цепи.
Первый этап — инициация. Синтезированная в процессе транскрипции иPHК выходит из ядра и направляется в цитоплазму к месту синтеза белка — рибосоме. За счет различных белковых факторов и энергии АТФ происходит соединение иPHК и двух субъединиц рибосом, которые до этого момента находились в диссоциированном состоянии. Прежде чем рибосома начнет синтез полипептидной цепи, к иРНК должна присоединиться особая молекула — инициаторная тРНК с аминокислотой. С нее всегда начинается синтез белка. По принципу комплементарности тРНК своим антикодоном соединяется с кодоном на иРНК и входит в рибосому. Этот кодон на иPHК называется старт-кодоном.
В результате взаимодействия всех компонентов образуется комплекс: рибосома — иРНК — тРНК-инициатор — аминокислота.
Вторая стадия — элонгация. Это стадия роста полипептидной цепи. Далее начинается сборка полипептидной цепи. Следующая тРНК с аминокислотой по принципу комплементарности антикодона с кодоном соединяется с иPHК и входит в рибосому. Первая тРНК закрепляется в пептидном центре, а вторая тРНК — с аминокислотой в аминоацильном центре. Аминокислоты сближаются друг с другом, между ними возникает пептидная связь, и образуется дипептид. При этом первая тРНК освобождается и, покидая рибосому, тянет за собой иPHК, которая продвигается на один триплет.
Вторая тРНК с дипептидом перемещается в пептидный центр, а в рибосому входит третья тРНК с аминокислотой (рис. 22). Весь процесс далее вновь и вновь повторяется. иРНК, последовательно продвигаясь через рибосому, каждый раз вносит новую тРНК с аминокислотой и выносит освободившуюся тРНК. Постепенно идет наращивание полипептидной цепи. Весь процесс обеспечивается деятельностью ферментов и энергией макроэргических соединений (АТФ и др.).
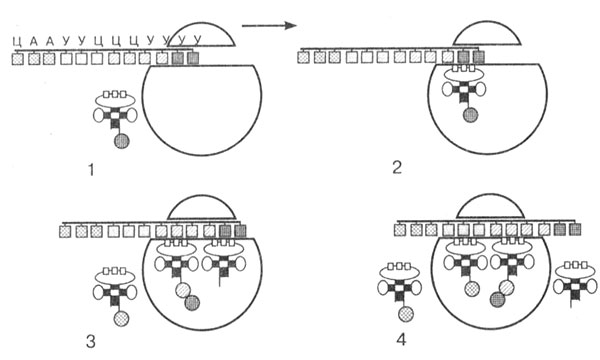
Рис. 22. Схема биосинтеза полипептидной цепи. Стрелкой показано направление движения иPHК
Последний этап — терминация. Как только в аминоацильный центр попадает стоп-кодон, синтез прекращается. Место тРНК занимает в этом случае специфический белок-фермент, который осуществляет гидролиз связи между последней тРНК и синтезированным белком. Рибосома снимается с иPHК и распадается на две субъединицы, последняя тРНК также освобождается и попадает вновь в цитоплазму. Синтезированная молекула белка поступает в ЭПС или цитоплазму, где претерпевает изменения и приобретает соответствующие структуры.
Процесс трансляции обычно осуществляется многократно. Одна иPHК может соединяться с несколькими рибосомами, образуя поли рибосому.; или полисому, на которой идет одновременно синтез многих молекул одного белка (рис. 23).
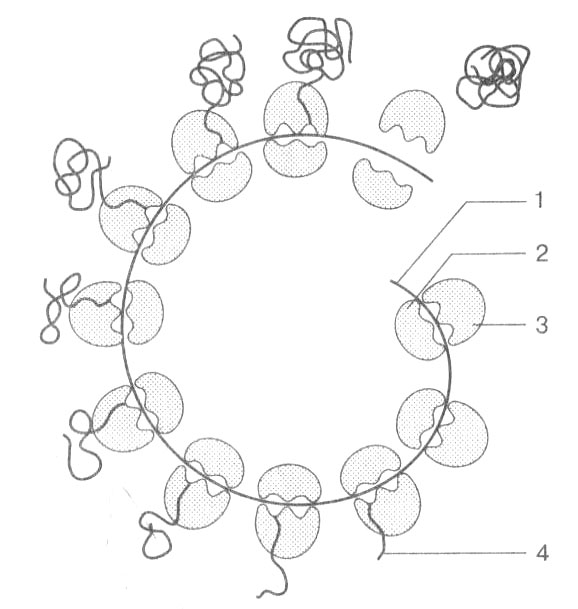
Рис. 23. Полисома: 1 — иPHК; 2 — малая субъединица рибосомы; 3 — большая субъединица рибосомы; 4 — синтезируемая полипептидная цепь
Если синтез происходит на гранулярной эндоплазматической сети, то поли пептидная цепь поступает в канальца эндоплазматической сети. Здесь она приобретает свою окончательную структуру и превращается в молекулу белка. Далее белок поступает в аппарат Гольджи и выносится из клетки. Если синтез происходит на рибосомах в цитоплазме, то синтезированные молекулы остаются и используются клеткой.
Весь процесс синтеза одного белка длится от 20 до 500 с и зависит от длины полипептида. Например, в рибосоме кишечной палочки белок из 300 аминокислот синтезируется приблизительно за 20 с.
Читайте также:
- Относится ли дознание и предварительное следствие к процессуальной деятельности тест
- Кто имеет право законодательной инициативы в законодательном собрании республики карелия
- Что нужно учитывать при составлении меню для обеспечения организма витаминами
- Как получить выписку из пзз через госуслуги пошаговая инструкция
- Обмен женами сколько платят за участие

