Какие двигательные белки осуществляют мышечное сокращение
Обновлено: 30.06.2024
Ткань как совокупность клеток и межклеточного вещества. Типы и виды тканей, их свойства. Межклеточные взаимодействия.
В организме взрослого человека различают около 200 типов клеток. Группы клеток, имеющие одинаковое или сходное строение, связанные единством происхождения и приспособленные к выполнению определенных функций, образуют ткани. Это следующий уровень иерархической структуры организма человека – переход с клеточного уровня на тканевой (смотри рисунок 1.3.2).
Любая ткань представляет собой совокупность клеток и межклеточного вещества, которого может быть много (кровь, лимфа, рыхлая соединительная ткань) или мало (покровный эпителий).
Клетки каждой ткани (и некоторых органов) имеют собственное название: клетки нервной ткани называются нейронами, клетки костной ткани – остеоцитами, печени – гепатоцитами и так далее.
Межклеточное вещество химически представляет собой систему, состоящую из биополимеров в высокой концентрации и молекул воды. В нем расположены структурные элементы: волокна коллагена, эластина, кровеносные и лимфатические капилляры, нервные волокна и чувствительные окончания (болевые, температурные и другие рецепторы). Это обеспечивает необходимые условия для нормальной жизнедеятельности тканей и выполнения ими своих функций.
Всего выделяют четыре типа тканей: эпителиальную, соединительную (включая кровь и лимфу), мышечную и нервную (смотри рисунок 1.5.1).
Эпителиальная ткань, или эпителий, покрывает тело, выстилает внутренние поверхности органов (желудка, кишечника, мочевого пузыря и других) и полостей (брюшной, плевральной), а также образует большинство желез. В соответствии с этим различают покровный и железистый эпителий.
Покровный эпителий (вид А на рисунке 1.5.1) образует пласты клеток (1), тесно – практически без межклеточного вещества – прилегающие друг к другу. Он бывает однослойным или многослойным. Покровный эпителий является пограничной тканью и выполняет основные функции: защита от внешних воздействий и участие в обмене веществ организма с окружающей средой – всасывание компонентов пищи и выделение продуктов обмена (экскреция). Покровный эпителий обладает гибкостью, обеспечивая подвижность внутренних органов (например, сокращения сердца, растяжение желудка, перистальтику кишечника, расширение легких и так далее).
Железистый эпителий состоит из клеток, внутри которых находятся гранулы с секретом (от латинского secretio – отделение). Эти клетки осуществляют синтез и выделение многих веществ, важных для организма. Путем секреции образуются слюна, желудочный и кишечный сок, желчь, молоко, гормоны и другие биологически активные соединения. Железистый эпителий может образовывать самостоятельные органы – железы (например, поджелудочная железа, щитовидная железа, железы внутренней секреции, или эндокринные железы, выделяющие непосредственно в кровь гормоны, выполняющие в организме регулирующие функции и другие), а может являться частью других органов (например, железы желудка).
Соединительная ткань (виды Б и В на рисунке 1.5.1) отличается большим разнообразием клеток (1) и обилием межклеточного субстрата, состоящего из волокон (2) и аморфного вещества (3). Волокнистая соединительная ткань может быть рыхлой и плотной. Рыхлая соединительная ткань (вид Б) присутствует во всех органах, она окружает кровеносные и лимфатические сосуды. Плотная соединительная ткань выполняет механическую, опорную, формообразующую и защитную функции. Кроме того, существует еще очень плотная соединительная ткань (вид В), из нее состоят сухожилия и фиброзные мембраны (твердая мозговая оболочка, надкостница и другие). Соединительная ткань не только выполняет механические функции, но и активно участвует в обмене веществ, выработке иммунных тел, процессах регенерации и заживления ран, обеспечивает адаптацию к меняющимся условиям существования.
К соединительной ткани относится и жировая ткань (вид Г на рисунке 1.5.1). В ней депонируются (откладываются) жиры, при распаде которых высвобождается большое количество энергии.
Важную роль в организме играют скелетные (хрящевая и костная) соединительные ткани. Они выполняют, главным образом, опорную, механическую и защитную функции.
Хрящевая ткань (вид Д) состоит из клеток (1) и большого количества упругого межклеточного вещества (2), она образует межпозвоночные диски, некоторые компоненты суставов, трахеи, бронхов. Хрящевая ткань не имеет кровеносных сосудов и получает необходимые вещества, поглощая их из окружающих тканей.
Костная ткань (вид Е) состоит их костных пластинок, внутри которых лежат клетки. Клетки соединены друг с другом многочисленными отростками. Костная ткань отличается твердостью и из этой ткани построены кости скелета.
Разновидностью соединительной ткани является и кровь. В нашем представлении кровь – это нечто очень важное для организма и, в то же время, сложное для понимания. Кровь (вид Ж на рисунке 1.5.1) состоит из межклеточного вещества – плазмы (1) и взвешенных в ней форменных элементов (2) – эритроцитов, лейкоцитов, тромбоцитов (на рисунке 1.5.2 даны их фотографии, полученные при помощи электронного микроскопа). Все форменные элементы развиваются из общей клетки-предшественницы. Подробнее свойства и функции крови рассматриваются в разделе 1.5.2.3.
Клетки мышечной ткани (рисунок 1.3.1 и виды З и И на рисунке 1.5.1) обладают способностью сокращаться. Так как для сокращения требуется много энергии, клетки мышечной ткани отличаются повышенным содержанием митохондрий.
Различают два основных типа мышечной ткани – гладкую (вид З на рисунке 1.5.1), которая присутствует в стенках многих, и, как правило полых, внутренних органов (сосуды, кишечник, протоки желез и другие), и поперечно-полосатую (вид И на рисунке 1.5.1) , к которой относятся сердечная и скелетная мышечные ткани. Пучки мышечной ткани образуют мышцы. Они окружены прослойками соединительной ткани и пронизаны нервами, кровеносными и лимфатическими сосудами (смотри рисунок 1.3.1).
Нервная ткань (вид К на рисунке 1.5.1) состоит из нервных клеток (нейронов) (1) и межклеточного вещества (2) с различными клеточными элементами (3), называемыми в совокупности нейроглией (от греческого glia – клей). Основным свойством нейронов (нейрон обозначен цифрой 7 на рисунке 1.3.4) является способность воспринимать раздражение, возбуждаться, вырабатывать импульс и передавать его далее по цепи. Они синтезируют и выделяют биологически активные вещества – посредники (медиаторы).
Нервная система регулирует функции всех тканей и органов, объединяет их в единый организм путем передачи информации по всем звеньям и осуществляет связь с окружающей средой.
Обобщающие сведения по тканям приведены в таблице 1.5.1.
Таблица 1.5.1. Ткани, их строение и функции
Сохранение формы и выполнение специфических функций тканью генетически запрограммировано: дочерним клеткам посредством ДНК передается способность к выполнению специфических функций и к дифференцированию. О регуляции экспрессии генов, как основе дифференцировки, было сказано в разделе 1.3.4.
Дифференцировка – это биохимический процесс, при котором относительно однородные клетки, возникшие из общей клетки-предшественницы, превращаются во все более специализированные, специфические типы клеток, формирующие ткани или органы. Большинство дифференцированных клеток обычно сохраняет свои специфические признаки даже в новом окружении.
В 1952 году ученые из Чикагского университета осуществили разделение клеток куриного эмбриона, выращивая (инкубируя) их в растворе фермента при осторожном помешивании. Однако клетки не оставались разделенными, а начинали объединяться в новые колонии. Более того, при смешивании печеночных клеток с клетками сетчатки глаза образование клеточных агрегатов происходило так, что клетки сетчатки всегда перемещались во внутреннюю часть клеточной массы.
Взаимодействия клеток. Что же позволяет тканям не рассыпаться при малейшем внешнем воздействии? И чем обеспечивается слаженная работа клеток и выполнение ими специфических функций?
Множество наблюдений доказывает наличие способности у клеток распознавать друг друга и соответствующим образом реагировать. Взаимодействие – это не только способность передавать сигналы от одной клетки к другой, но и способность действовать совместно, то есть синхронно. На поверхности каждой клетки располагаются рецепторы (смотри раздел 1.3.2), благодаря которым каждая клетка распознает другую себе подобную. И функционируют эти “детекторные устройства” согласно правилу “ключ – замок” – этот механизм неоднократно упоминается в книге.
Давайте немного поговорим о том, как клетки взаимодействуют друг с другом. Известно два основных способа межклеточного взаимодействия: диффузионное и адгезивное. Диффузионное – это взаимодействие на основе межклеточных каналов, пор в мембранах соседних клеток, расположенных строго напротив друг друга. Адгезивное (от латинского adhaesio – прилипание, слипание) – механическое соединение клеток, длительное и стабильное удерживание их на близком расстоянии друг от друга. В главе, посвященной строению клетки, описаны различные виды межклеточных соединений (десмосомы, синапсы и другие). Это является основой для организации клеток в различные многоклеточные структуры (ткани, органы).
Каждая клетка ткани не только соединяется с соседними клетками, но и взаимодействует с межклеточным веществом, получая с его помощью питательные вещества, сигнальные молекулы (гормоны, медиаторы) и так далее. Посредством химических веществ, доставляемых ко всем тканям и органам тела, осуществляется гуморальный тип регуляции (от латинского humor – жидкость).
Другой путь регуляции, как уже упоминалось выше, осуществляется с помощью нервной системы. Нервные импульсы всегда достигают цели в сотни или тысячи раз быстрее доставки к органам или тканям химических веществ. Нервный и гуморальный способы регуляции функций органов и систем тесно между собой взаимосвязаны. Однако само образование большинства химических веществ и выделение их в кровь находятся под постоянным контролем нервной системы.
Клетка, ткань – это первые уровни организации живых организмов, но и на этих этапах можно выделить общие механизмы регуляции, обеспечивающие жизнедеятельность органов, систем органов и организма в целом.
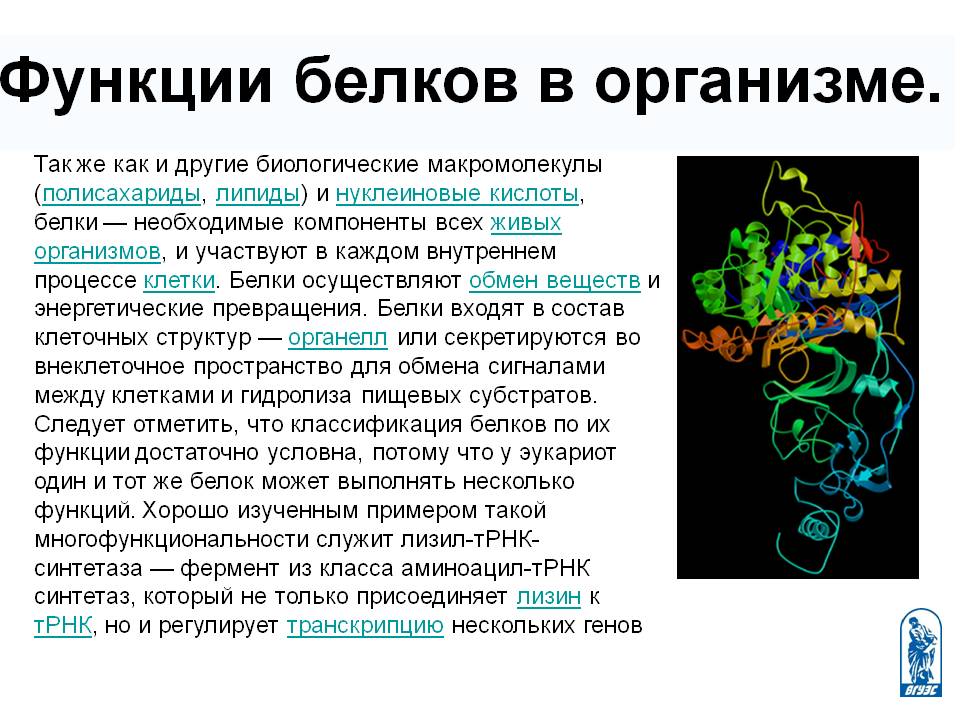
Наш организм на 80% состоит из воды. А 85% оставшейся сухой массы составляют белки.
Они выполняют огромное количество жизненно важных функций в организме. Поэтому они по праву считаются одним их важнейших компонентов питания.
С диетической точки зрения обеспечение организма адекватным количеством белка является одной из ключевых оценок любой диеты и определяет ее эффективность, переносимость и влияние на здоровье. В то же время не нужно забывать, что для правильного и здорового функционирования организма одних только белков мало. Любое питание должно быть сбалансировано и включать все необходимые компоненты.
Что происходит с белком в организме?
В большинстве тканей и органов постоянно происходят два процесса: синтез и распад белка. Оба процесса происходят одновременно, хотя в физиологическом плане регулируются разными факторами.
В мышечной ткани, если синтез белка преобладает над разрушением, происходит рост мышц за счёт увеличения количества миофибрилл, появления новых митохондрий или объема внутриклеточный жидкости (саркоплазмы). Иными словами, для того, что мышцы росли нужно или увеличить синтез, или уменьшить распад, или и то и другое. То же самое касается белков плазмы и других органов. Понижение их уровня может приводить к снижению иммунитета, сопротивляемости инфекционным заболеваниям.

В разных тканях скорость обмена белка сильно отличается. В плазме белки разрушаются и восстанавливаются за часы, в связках - за месяцы или годы.
Процесс обмена довольно затратен для организма. Он составляет примерно 15-20% от всего базового метаболизма человека. Поэтому силовые тренировки и питание, насыщенное белками, увеличивают расход калорий. В литературе это называют "ускорением метаболизма".
Одним из факторов, которые влияют на синтез белка, является питание. Попадая в кровь, аминокислоты положительно влияют на процессы синтеза и подавляют распад. Избыток белка в организме нужно куда-то использовать, и в некоторых пределах он идет на построение мышечной ткани.
Однако одно лишь увеличение потребления белка не приводит к росту мышц. Поскольку мышечная ткань, в отличие от жировой, не склонна к накопительству. Большие запасы жира позволяют организму пережить тяжелые времена, тогда как мышечная ткань сама по себе энергозатратна и при расщеплении дает меньше энергии. Поэтому насыщение организма "лишним" белком через некоторое (короткое) время приводит к запуску процессов расщепления этого белка. Сигналом для накопле ния белка (не только снижения распада, но и увеличения синтеза) служат силовые нагрузки.
Кардио тренировки и тренировки на выносливость не обладают таким свойством.
При таком виде нагрузки стимулируется увеличение митохондрий и ферментов, отвечающих за энергетическое снабжение клеток. Кроме того, при длительные тренировки приводят к тому, что белок начинает использоваться в качестве источника энергии. Что в свою очередь приводит к потере мышечной массы.
Еще одним фактором, который влияет на процессы синтеза и распада белка, является инсулин. Это гормон, который выделяется в ответ на повышение в крови уровня углеводов. Инсулин затормаживает процесс разрушения белка (белково сберегающая функция углеводов).
Сколько белка нужно в день?
Согласно текущим рекомендациям (ВОЗ) потребность в белке составляет 0. 6 - 0. 8 г на кг веса. Тем не менее ряд исследований показывает, что для людей сидячих профессий (минимальная активность) минимальным количеством нужно считать 1 - 1. 2 г на кг веса.
У спортсменов потребности в белке выше. В видах спорта, где акцент делается на выносливость, это связано с тем, что при продолжительных тренировках белок используется для получения энергии, за их счет может покрываться до 10% калорий.
В силовых видах спорта повышенные потребности белка требуется для восстановления мышечной ткани. На основе исследований можно утверждать, что для силовых спортсменов потребность в белке 1. 2 - 1. 7 г, для видов спорта, ориентированных на выносливость - 1. 2 - 1. 3 г на кг массы тела. Но при этом следует учитывать, что данные цифры применимы для профессиональных спортсменов, которые занимаются 5-7 раз в неделю.
Расчет необходимого количества белка ведется относительно "идеального" веса. "Идеальный" вес - это ориентировочный вес, при котором у мужчин будет около 10 - 12% жира, а у женщин - 18 - 20%, что является неплохим ориентиром для фигуры. Для того, чтоб вычислить это значение, следует из роста вычесть 110 для новичков, которые только начинают заниматься спортом. Для продвинутых любителей - 105.
Для людей, которые не занимаются спортом или только начинают заниматься, разумно потреблять 1 - 1. 2 г белка на кг "идеального" веса.
Если при этом планируется похудение, то количество белка следует увеличить до 1. 5 - 1. 8 г.
Для тех, кто занимается спортом для личных, не профессиональных целей достаточно потреблять 1. 5 - 1. 8 г белка на кг "идеального" веса. При похудении можно поднять планку до 1. 5 - 2 г белка на кг "идеального" веса.
Потреблять выше 2 - 2. 2 г белка не только не имеет смысла, но и вредно для здоровья.
В статье изложен обзор некоторых литературных данных о механизмах работы мышц во время различных по интенсивности нагрузок. Проведён анализ адаптивности, пластичности и степени изменения мышц на разных уровнях под влиянием различных факторов. Эти изменения связаны с увеличением мускульной силы и сопровождаются трансформацией одних типов мышечных волокон в другие, изменением метаболических процессов и увеличением синтеза сократительных белков, что в основном и обуславливает процессы мышечной гипертрофии. Главным пусковым механизмом данных процессов является синтез ростовых факторов, которые выполняют, по сути, основополагающую роль. Кроме усиления синтеза белка, данные факторы способны влиять и на миосателлиты. Именно эти клетки, располагающиеся на периферии симпласта, способны делиться в постнатальном периоде. В условиях наличия нагрузки и как следствия появления развивающихся микротравм происходит их активация. Они составляют основу регенерации поврежденного мышечного участка. За счёт своего деления они формируют новые мышечные волокна. Данный процесс очень напоминает воспалительный ввиду участия провоспалительных клеток. Их цитокины также влияют на пролиферацию. Поэтому при мышечной работе происходит множество процессов, которые способствуют к непосредственному увеличению мышечного волокна путём как за счёт гипертрофии, так и гиперплазии.

3. Lin Y. et al. PGC-1? is associated with C2C12 Myoblast differentiation // Central European Journal of Biology. 2014. Т. 9. № 11. Р. 1030–1036.
4. Scharf M. et al. Mitogen-activated protein kinase-activated protein kinases 2 and 3 regulate SERCA2a expression and fiber type composition to modulate skeletal muscle and cardiomyocyte function // Molecular and cellular biology. 2013. Т. 33. № 13. Р. 2586–2602.
5. Meissner J.D. et al. The p38?/? mitogen-activated protein kinases mediate recruitment of CREB-binding protein to preserve fast myosin heavy chain IId/x gene activity in myotubes // Journal of Biological Chemistry. 2007. Т. 282. № 10. Р. 7265–7275.
6. Potthoff M.J., Olson E.N. MEF2: a central regulator of diverse developmental programs // Development. 2007. Т. 134. № 23. Р. 4131–4140.
На протяжении многих лет изучение процессов синтеза белков в скелетных мышцах при выполнении различных физических нагрузок остаётся актуальной проблемой биохимии и физиологии. Мышцы и их силовые характеристики очень важная составляющая организма каждого спортсмена, которая позволяет достигать результатов. В связи с прогрессивным развитием спорта и вовлечением большого количества людей в физическую культуру, тема здоровья спортсменов становится все более актуальной, интересной и увлекательной. Учитывая существующую сильную корреляцию между площадью поперечного сечения мышц и мышечной силой, стремление увеличить мышечную массу тела есть у каждого человека, занимающегося спортом. Кроме этого, необходимо помнить, что преобладание мышечной массы в организме благоприятно влияет на метаболические процессы.
Скелетная мышца – одна из наиболее пластичных структур в организме млекопитающих. При повышенной активности и нагрузке часто происходит увеличение её размеров, объёмов миофибриллярного аппарата, повышение сократительных возможностей (силы, мощности). Процесс прироста мышечной массы зависит от различных факторов: наследственных, конституциональных, а также пола, возраста, метаболизма, гормонального фона. Кроме того, с приобретением опыта тренировок становится все труднее увеличить мышечную массу, поэтому важно понимать и активно использовать все возможные механизмы этого процесса.
Клетки поперечно-полосатой мускулатуры отличаются от гладкомышечных миоцитов. Клетки скелетных мышц образуют многоядерный синцитий, основное вещество которого формируют миофибриллы, состоящие из толстых и тонких миофиламентов. Первый тип образуют молекулярные единицы и миозин, а второй тип содержит тропомиозин с тропонином и F-актин. Многие авторы считают скелетную мускулатуру гетерогенной системой относительно устройства и выполняемых функций, несмотря на её строгую организацию. Данное свойство помогает мышцам соответствовать возлагаемой на них функции. Так путём изменения количества саркомеров и миофибрилл обеспечивается их функциональная реорганизация [1].
Работа мышц проявляется их сокращением, которое начинается с появления очага возбуждения на нейромышечных окончаниях. Наружная мембрана деполяризуется, открываются кальциевые каналы, и концентрация кальция внутри клетки возрастает. Ионы кальция связываются с тропонином, при этом конформируется тропониновый комплекс. Участки цепей миозина связываются с актином, что сопровождается высвобождением энергии вследствие расщепления АТФ до АДФ и остатка фосфорной кислоты. Угол между лёгкой и тяжёлой цепями миозина изменяется и актиновый филамент перемещается к центру саркомера, что приводит к изменению длины мышцы, её сокращению [1, 2].
Клетки скелетных мышц подразделяются на два типа:
А) Миосателлиты – взрослые стволовые клетки мышечной ткани. Представляют собой основу для обновления мышц и прироста их массы;
Б) Миосимпласты – формируют многоядерный синцитий. Сами по себе являются мышечными тубами с миофибриллами внутри, по периферии которых располагаются ядра.
Нагрузки, оказываемые на мышцы, и само мышечное сокращение имеют некую зависимость. Предполагается, что первое будет напрямую соответствовать второму. Это достигается за счёт усиления экспрессии генов сократительных белков и энзимов обменных процессов. Мышечная активность сопровождается количественными и качественными изменениями в миоцитах того типа, которые необходимы для наиболее эффективного осуществления выполняемой работы [2].
Мышечные волокна делятся на медленные (I тип) и быстрые (II тип). Оба этих типа имеют различный состав, включающий в себя сократительные белки, ферменты энергетического обмена и внутриклеточный кальций.
Увеличение силы мышц проявляется структурными перестройками, которые затрагивают нервную и мышечные системы. Изменения в нервной системе проявляются трансформацией величины кортикальных полей, которые регулируют выполнение определённого вида движения, влиянием на синхронизацию моторных единиц и на обучение определенных мышц, отвечающих за выполнение данного вида движений. Таким образом, наибольшая активность мышц наблюдается именно тогда, когда она необходима для достижения максимального эффекта (активность мышц агонистов при одновременной пассивности антагонистов). Также наблюдается изменение частоты и устойчивости генерируемых импульсов и порога возбудимости мотонейронов. Изменения в мышечной системе могут быть связаны с гипертрофией скелетных мышц (увеличение размеров мышечного волокна) и с их гиперплазией (увеличение количества миоцитов) [3].
Но прежде чем переходить к последним двум процессам, необходимо разобраться с изменениями, происходящими в самих мышцах. В момент выполнения работы миоцит подвергается действию физических и гуморальных факторов (пассивные механические силы, гипоксемия, факторы роста, и т.д.). Они являются причиной запуска путей передачи сигнала внутри клеток, опосредуя транскрипцию и трансляцию генов, ответственных за синтез белков [2]. Изменения данных путей сопровождаются реорганизацией мышечных волокон, точнее их типов.
Одним из основных исходных сигналов является повышенная концентрация кальция внутри клетки и кальцинейрина. Кальцинейрин дефосфорилирует факторы транскрипции – NFAT (nuclear factor of activated T-cells), которые находятся в фосфорилированном состоянии [4]. Данные факторы в дефосфорилированной форме активируют гены-мишени, что способствует перестроению быстрых волокон в медленные.
По мере приспособления мышц к нагрузкам изменяются и процессы метаболизма в них. Существуют различные параметры, влияющие на формирование адаптивных механизмов в миоцитах при выполнении работы. Важнейшим является гипоксия, которая, в свою очередь активирует ферментные системы (фумараза, цитратсинтаза, ЛДГ) и запускает работу факторов транскрипции (PGC1). При недостатке кислорода происходит активация одной изоформы семейства гипоксия-индуцированных факторов (HIF; hypoxia inducible factor), которая проникает в ядро, связывается с определенным участком ДНК и активирует гены, отвечающие за гликолиз, потребление кислорода и ангиогенез, увеличивая данные процессы. Некоторые гормоны также способны влиять на экспрессию генов в мышечных клетках. Это такие гормоны, как инсулин, гормон роста, которые вместе с кортизолом запускают катаболические реакции в условиях метаболического и энергетического истощения [3].
Стоит напомнить, что мышцы не являются постоянными клетками, а заменяются в течение жизни. Пролиферация необходима для предотвращения апоптоза клеток (регулируемый процесс клеточной гибели) и поддержания массы скелетных мышц. Это осуществляется через динамический баланс между синтезом белков в мышцах и их распадом. Мышечная гипертрофия возникает тогда, когда синтез белков превышает их распад.
Что же наблюдается при гипертрофии и гиперплазии мышечного волокна? При растяжении и сокращении мышц происходит образование факторов роста IGF и MGF, которые могут действовать как паракринно, так и аутокринно. С одной стороны, их действие проявляется в увеличении синтеза сократительных белков мышечных волокон. Основным участником данного механизма является фосфорилированная PKB [5]. Её активация начинается с влияния на мышцу нагрузки, которая приводит к синтезу гена, запускающего путь IGF/PI3K. В ткани имеется несколько изоформ, некоторые из них (IGF-1 и MGF), взаимодействуя с рецепторами приводят к конформационным изменениям. Через фосфорилирование ряда рецепторов и происходит активация PKB, способствующая развитию анаболических реакций [6].
С другой же стороны, происходит усиление пролиферации миосателлитов, их митотическая активность приводит к формированию новых клеток, а также сопровождается слиянием их с имеющимися мышечными волокнами или даёт возможность формировать новые. Миосателлиты расположены между базальной мембраной и сарколеммой. Покоящиеся клетки активируются непосредственно травмированием мышцы и в ответ на это начинают активно делиться и соединяться с частями поврежденного волокна. Под влиянием тяжёлой изнурительной работы происходит также активация данных клеток из-за образования многочисленных микротравм мышечного волокна. Вследствие этого наблюдается явление подобное процессам, происходящим при воспалении. В зону повреждения активно мигрируют нейтрофилы и макрофаги, которые активируют синтез ранее упомянутых факторов роста, регулирующих пролиферацию и дифференцировку миосателлитов. Мышечная гипертрофия отличается от мышечной гиперплазии. При гипертрофии мышц, увеличиваются сократительные элементы, и межклеточный матрикс расширяется для поддержки роста. Гиперплазия приводит к увеличению количества мышечных волокон. Гипертрофия сократительных элементов может происходить путем добавления саркомеров либо последовательно или параллельно.
В отечественной литературе не утихают споры о патогенетических аспектах мышечного роста. Чаще всего гипертрофию скелетных мышц человека рассматривают как их долговременную адаптацию к физическим нагрузкам различной направленности. Но существует понятие о кратковременной гипертрофии скелетных мышц – то есть изменение объема мышцы в результате одной силовой тренировки. Спортсмены, выступающие в соревнованиях по бодибилдингу или бодифитнесу хорошо знают, что объем мышц можно немного увеличить за счет собственной крови и осмотического давления, если использовать специальный метод тренировки – пампинг.
Неоспоримым является факт увеличения объёма мышечных волокон. Это так называемая миофибриллярная гипертрофия, при которой происходит изменение объёма миофибрилл и плотность их укладки. Механизм связан с увеличением количества саркомеров в миофибриллах. Значительная роль при этом отводится активированным клеткам-сателлитам. Миогенные стволовые клетки начинают пролифелировать, а затем сливаются с существующими клетками или взаимодействуют между собой для формирования новых мышечных волокон. Этот механизм актуален при восстановлении травмированных клеток и при спортивной гипертрофии.
Существует множество данных, доказывающих идущий параллельно с этим процесс увеличения объёма несократительной части мышцы – саркоплазматическая гипертрофия. Это тонкие перестройки на биохимическом уровне клетки, а так же увеличение количества митохондрий. Многие авторы считают, что трансформации в саркоплазме повышают выносливость мышц. Ряд исследователей утверждает, что увеличение различных неконтрактильных элементов и жидкости действительно может привести к приросту мышечной массы, но без сопутствующего увеличения силы. Саркоплазматическая гипертрофия достигается специальными тренировками и часто описывается как нефункциональная. Однако ряд специалистов предполагают, что отек мышечных волокон вызывает увеличение синтеза белка и таким образом способствует росту сократительной ткани.
Эти процессы редко бывают сбалансированными и зависят от характера и интенсивности нагрузки. В скелетных мышцах при этом синтез мышечных белков преобладает над их распадом. Причиной такого метаболизма сторонники гипотезы ацидоза считают накопление молочной кислоты. С точки зрения другой теории – временная гипоксия запускает реперфузию мышц и активирует деление клеток-сателлитов. Последнее время широкое распространение получила гипотеза механического повреждения мышечных волокон. Микроразрывы сократительных белков и повреждения саркоплазмы сопровождается увеличением концентрации ионов кальция, что и стимулирует пролиферацию сателлитов.
Из этого следует, что механизмы мышечной гипертрофии известны и неоспоримы. Очень дискутабельным остается вопрос о наличии процесса гиперплазии мышц. Большинство авторов сходится во мнении, что увеличение количества мышечных волокон у человека не доказано, но при этом описывается возможность получения гиперплазии мышц в экспериментальных условиях у животных (млекопитающих и птиц). Некоторые исследователи допускают частичное увеличения числа волокон. На основании проведенного мета-анализа экспериментальных работ отмечено, что количество мышечных элементов увеличилось в экспериментах на птицах значительнее, чем при использовании в качестве подопытных млекопитающих. Примечательно также, что эффект гиперплазии наблюдался там, где использовались постоянные растяжения, а не упражнения, сочетающие его с расслаблением. Ряд исследователей (Kraemer, William J. и MacDougall J.) утверждают, что этот механизм может осуществляться под влиянием силовых тренировок. Однако доказательств увеличения мышечных волокон у людей недостаточно. Длительных исследований (более года) добровольцев и спортсменов не проводилось. Высказывается мнение, что это слишком короткий период для этого процесса. Гиперплазия подтверждается в биопсийном материале, а погрешность этого метода составляет около 10 %, что делает результат очень сомнительным.
Общее число волокон предопределяется генетически и практически не меняется в течение жизни без применения специальных стимуляторов. Российские ученые подтверждают, что вклад гиперплазии в процесс увеличения объема мышц составляет не более 5 % и, как правило, потенцирован использованием анаболических стероидов. Также гиперплазию могут вызывать блокаторы миостатина. Гормон роста при этом не вызывает гиперплазии.
Таким образом, при мышечной работе происходит множество процессов на разных уровнях. Начиная с изменений интенсивности обменных процессов и заканчивая изменениями механизмов нервной и гуморальной регуляции. Реорганизация мышц, лежащая в основе этих процессов, приводит к изменению многочисленных характеристик деятельности спортсменов.
Проанализировав все данные и изучив все возможные гипотезы, становится очевидным, что в увеличении мышечных волокон играют некую роль всё-таки два процесса. Первый – гипертрофия с ёе подвидами для сократительной и несократительной части мышцы (миофибриллярная и саркоплазматическая), которая, по мнению многих исследователей, занимает основополагающую роль. И второй это гиперплазия с её минимальным, но существенным вкладом.
Мы́шечное сокраще́ние — реакция мышечных клеток на воздействие нейромедиатора, реже гормона, проявляющаяся в уменьшении длины клетки. Эта жизненно важная функция организма, связанная с оборонительными, дыхательными, пищевыми, половыми, выделительными и другими физиологическими процессами.
Все виды произвольных движений — ходьба, мимика, движения глазных яблок, глотание, дыхание и т. п. осуществляются за счёт скелетных мышц. Непроизвольные движения (кроме сокращения сердца) — перистальтика желудка и кишечника, изменение тонуса кровеносных сосудов, поддержание тонуса мочевого пузыря — обусловлены сокращением гладкой мускулатуры. Работа сердца обеспечивается сокращением сердечной мускулатуры.
Содержание
Введение

Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц). Миофибриллы — структуры толщиной 1 — 2 мкм, состоящие из саркомеров — структур длиной около 2,5 мкм, состоящих из актиновых и миозиновых (тонких и толстых) филаментов и Z-дисков, соединённых с актиновыми филаментами. Сокращение происходит при увеличении концентрации в цитоплазме ионов Ca 2+ в результате скольжения миозиновых филаментов относительно актиновых. Источником энергии сокращения служит АТФ. КПД мышечной клетки около 50 %.
Скольжение миозина относительно актина
Головки миозина расщепляют АТФ и за счет высвобождающейся энергии меняют конформацию, скользя по актиновым филаментам. Цикл можно разделить на 4 стадии:
- Свободная головка миозина связывается с АТФ и гидролизует его до АДФ и фосфата и остаётся связанной с ними. (Обратимый процесс — энергия, выделившаяся в результате гидролиза, запасается в изменённой конформации миозина).
- Головки слабо связываются со следующей субъединицей актина, фосфат отделяется, и это приводит к прочному связыванию головки миозина с актиновым филаментом. Эта реакция уже необратима.
- Головка претерпевает конформационное изменение, производящее подтягивание толстого филамента к Z-диску (или, что эквивалентно, свободных концов тонких филаментов друг к другу).
- Отделяется АДФ, за счёт этого головка отделяется от актинового филамента. Присоединяется новая молекула АТФ.
Далее цикл повторяется до уменьшения концентрации ионов Ca 2+ или исчерпании запаса АТФ (в результате смерти клетки). Скорость скольжения миозина по актину ≈15 мкм/сек. В миозиновом филаменте много (около 500) молекул миозина и, следовательно, при сокращении цикл повторяется сотнями головок сразу, что и приводит к быстрому и сильному сокращению. Следует заметить, что миозиин ведёт себя как фермент — актин-зависимая АТФаза. Так как каждое повторение цикла связано с гидролизом АТФ, а следовательно, с положительным изменением свободной энергии, то процесс однонаправленный. Миозин движется по актину только в сторону плюс-конца.

Источник энергии для сокращения
Для сокращения мышцы используется энергия гидролиза АТФ, но мышечная клетка имеет крайне эффективную систему регенерации запаса АТФ, так что в расслабленной и работающей мышце содержание АТФ примерно равно. Фермент фосфокреатинкиназа катализирует реакцию между АДФ и креатинфосфатом, продукты которой — АТФ и креатин. Креатинфосфат содержит больше запасённой энергии, чем АТФ. Благодаря этому механизму при вспышке активности в мышечной клетке падает содержание именно креатинфосфата, а количество универсального источника энергии — АТФ — не изменяется. Механизмы регенерации запаса АТФ могут различаться в зависимости от парциального давления кислорода в окружающих тканях (см. Анаэробные организмы).
Механизм регуляции
В основном в регуляции мышечной активности участвуют нейроны, но есть случаи, когда сокращением гладкой мускулатуры управляют и гормоны (например, адреналин и окситоцин). Сигнал о сокращении можно разделить на несколько этапов:
От клеточной мембраны до саркоплазматического ретикулума
Воздействие медиатора, выделившегося из мотонейрона, вызывает потенциал действия на клеточной мембране мышечной клетки, который передаётся далее с помощью специальных впячиваний мембраны, называемых Т-трубочками, которые отходят от мембраны внутрь клетки. От Т-трубочек сигнал передаётся саркоплазматическому ретикулуму — особому компартменту из уплощенных мембранных пузырьков (эндоплазматической сети мышечной клетки), окружающих каждую миофибриллу. Этот сигнал вызывает открытие Ca 2+ -каналов в мембране ретикулума. Обратно ионы Ca 2+ попадают в ретикулум с помощью мембранных кальциевых насосов — Ca 2+ -АТФазы.
От выделения ионов Ca 2+ до сокращения миофибрилл


Для того, чтобы контролировать сокращение, к актиновому филаменту прикрепляется белок тропомиозин и комплекс из трёх белков — тропонин (субъединицы этого комплекса называются тропонинами T,I и C). Тропонин C — близкий гомолог другого белка, кальмодулина. Через каждые семь субъединиц актина расположен только один тропониновый комплекс. Связь актина с тропонином I перемещает тропомиозин в положение, мешающее связи миозина с актином. Тропонин C связывается с четырьмя ионами Ca 2+ и ослабляет действие тропонина I на актин, и тропомиозин занимает положение, не препятствующее связи актина с миозином.
Основные белки миофибрилл
| Белок | Доля белка % | Его мол. масса, kDa | Его функция |
|---|---|---|---|
| Миозин | 44 | 510 | Главный компонент толстых филаментов. Образует связи с актином. Движется по актину за счёт гидролиза АТФ. |
| Актин | 22 | 42 | Главный компонент тонких филаментов. Во время сокращения мышцы по нему движется миозин. |
| Титин | 9 | 2500 | Большой гибкий белок, образующий цепь для связывания миозина с Z-диском. |
| Тропонин | 5 | 78 | Комплекс из трёх белков, регулирующий сокращение при связывании с ионами Ca 2+ . |
| Тропомиозин | 5 | 64 | Связанный с актиновыми филаментами стержневидный белок, блокирующий движение миозина. |
| Небулин | 3 | 600 | Длинный нерастяжимый белок, связанный с Z-диском и идущий параллельно актиновым филаментам. |
Литература
- Б. Альбертс, Д. Брей, Дж. Льюис, М. Рефф, К. Робертс, Дж. Уотсон, Молекулярная биология клетки — В 3-х т. — Пер. с англ. — Т.2. — М.: Мир, 1994. — 540 с.
- М. Б. Беркинблит, С. М. Глаголев, В. А. Фуралев, Общая биология — В 2-х ч. — Ч.1. — М.:МИРОС, 1999. — 224 с.: ил.
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Мышечное сокращение" в других словарях:
МЫШЕЧНОЕ СОКРАЩЕНИЕ — укорочение или напряжение мышц в ответ на раздражение, вызываемое разрядом двигат. нейронов. Принята модель М. с, согласно к рой при возбуждении поверхности мембраны мышечного волокна потенциал действия распространяется сначала по системе… … Биологический энциклопедический словарь
мышечное сокращение — raumens susitraukimas statusas T sritis Kūno kultūra ir sportas apibrėžtis Raumens ilgio kitimas cheminei energijai virstant mechanine ir šilumine. Skiriamas ↑auksotoninis, ↑izometrinis, ↑izotoninis, ↑maksimalusis ir ↑pavienis raumens… … Sporto terminų žodynas
мышечное сокращение — raumens susitraukimas statusas T sritis Kūno kultūra ir sportas apibrėžtis Raumenį sudarančių skaidulų patrumpėjimas arba įtampos kitimas atliekant judesį (veiksmą). atitikmenys: angl. muscle contraction vok. Muskelkontraktion, f rus. мышечное… … Sporto terminų žodynas
мышечное сокращение — см. Сокращение … Большой медицинский словарь
Мышечное сокращение — укорочение мышцы, в результате которого она производит механическую работу. М. с. обеспечивает способность животных и человека к произвольным движениям. Наиболее важная составная часть мышечной ткани (См. Мышечная ткань) белки (16,5… … Большая советская энциклопедия
МЫШЕЧНОЕ СОКРАЩЕНИЕ — основная функция мышечной ткани укорочение или напряжение мышц в ответ на раздражение, вызываемое разрядом двигательных нейронов. М. с. лежит в основе всех движений человеческого тела. Различают М. с. изометрическое, когда мышца развивает усилие… … Психомоторика: cловарь-справочник
Изометрическое мышечное сокращение — сокращение мышцы, выражающееся в усилении её напряжения при неизменной длине (например, сокращение мышцы конечности, оба конца которой закреплены неподвижно). В организме к И. м. с. приближается напряжение, развиваемое мышцей при попытке… … Большая советская энциклопедия
Изотоническое мышечное сокращение — сокращение мышцы при неизменном напряжении, выражающееся в уменьшении её длины и увеличении поперечного сечения. В организме И. м. с. в чистом виде не наблюдается. К чисто И. м. с. приближается движение ненагруженной конечности; при… … Большая советская энциклопедия
концентрическое мышечное сокращение — koncentrinis raumens susitraukimas statusas T sritis Kūno kultūra ir sportas apibrėžtis Raumens darbas, kurio metu raumuo įgyja jėgą trumpėdamas. atitikmenys: angl. concentric muscle contraction vok. koncentrische Muskelkontraktion, f rus.… … Sporto terminų žodynas
эксцентрическое мышечное сокращение — ekscentrinis raumens susitraukimas statusas T sritis Kūno kultūra ir sportas apibrėžtis Raumens darbas, kurio metu raumuo įgyja jėgą ilgėdamas. atitikmenys: angl. eccentric muscle contraction vok. excentrische Muskelkontraktion, f rus.… … Sporto terminų žodynas
Читайте также:


