Как обеспечить условия замедляющие гидролиз как ускорить гидролиз
Обновлено: 30.06.2024
Бинарные соединения – соединения, образованные двумя химическими элементами.
Бинарные соединения делят на ионные и ковалентные.
Ионными называют такие бинарные соединения, которые образованы атомами металла и неметалла.
Ковалентными называют бинарные соединения, образованные двумя неметаллами.
Общая информация по гидролизу бинарных соединений
Многие бинарные соединения способны разлагаться под действием воды. Такая реакция бинарных соединений с водой называется необратимым гидролизом.
Необратимый гидролиз практически всегда протекает с сохранением степеней окисления всех элементов. В результате взаимодействия бинарных соединения с водой всегда:
✓ элемент в отрицательной степени окисления переходит в состав водородного соединения;
✓ элемент в положительной степени окисления переходит в состав соответствующего гидроксида.
Напомним, что гидроксид неметалла – это ни что иное, как соответствующая кислородсодержащая кислота. Так, например, гидроксид серы (VI) — это серная кислота H2SO4.
Так, например, попробуем записать уравнение необратимого гидролиза фосфида кальция Ca3P2, опираясь на информацию, представленную выше.
Также сказано, что в результате реакции гидролиза практически всегда сохраняются степени окисления элементов.
Таким образом, без расстановки коэффициентов реакция будет описываться следующей схемой:
Расставив коэффициенты получаем уравнение:
Используя аналогичный алгоритм, запишем уравнение гидролиза пентахлорида фосфора PCl5.
При условии, что вы знаете формулы всех неорганических кислот, несложно догадаться, что данным гидроксидом является фосфорная кислота H3PO4.
Само уравнение при этом после расстановки коэффициентов будет иметь вид:
Как видите, если вам дали формулу бинарного соединения и попросили записать уравнения его гидролиза, то ничего сложного в этом нет.
Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
Для успешной сдачи ЕГЭ нужно запомнить, что из ионных бинарных соединений в реакцию необратимого гидролиза водой вступают:
1) нитриды щелочных металов (ЩМ), щелочноземельных металлов (ЩЗМ) и магния:
2) фосфиды ЩМ, ЩЗМ и магния:
3) силициды ЩМ, ЩЗМ и магния:
4) карбиды ЩМ, ЩЗМ и магния. Знать нужно формулы только двух карбидов — Al4C3 и CaC2 и, соответственно, уметь записывать уравнения их гидролиза:
5) сульфиды алюминия и хрома:
6) гидриды ЩМ, ЩЗМ, Mg, Al:
Гидролиз гидридов металлов – редкий пример окислительно-восстановительного гидролиза. Фактически, в данной реакции объединяются ионы водорода H + и анионы водорода H — , в следствие чего образуются нейтральные молекулы H2 с водородом в степени окисления, равной 0.
Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
Из ковалентных бинарных соединений, способных вступать в реакцию необратимого гидролиза, нужно знать про:
1) галогениды фосфора III и V.
2) галогениды кремния:
Гидролиз бинарных соединений действием растворов кислот и щелочей
Помимо обычного гидролиза водой существует также вариант гидролиза, при котором бинарное соединение обрабатывают водным раствором щелочи или кислоты.
Как в таком случае записать уравнение гидролиза?
Для того, чтобы записать уравнение гидролиза бинарного соединения водным раствором щелочи или кислоты, нужно:
1) в первую очередь, представить, какие продукты образовались бы при обычном гидролизе водой.
Например, мы хотим записать уравнение щелочного гидролиза соединения PCl5 действием водного раствора KOH.
Тогда, согласно этому пункту, мы должны вспомнить какие продукты образуются при обычном гидролизе. В нашем случае это HCl и H3PO4
2) посмотреть на отношение этих продуктов к средообразователю (кислоте или щелочи) – реагируют они или нет. Если продукты обычного гидролиза реагируют со средообразователем, то запомнить продукты этого взаимодействия.
Возвращаясь к нашему случаю с PCl5, мы должны посмотреть на то, как относятся к щелочи продукты обычного гидролиза, т.е. HCl и H3PO4. Оба данных соединения в водном растворе являются кислотами, в связи с чем существовать в щелочной среде не могут. В частности, с гидроксидом калия они прореагируют, образуя соответственно соли KCl и K3PO4
3) в конечном уравнении в качестве продуктов записать то, что получается при взаимодействии со средообразователем. Воду при этом мы пока не пишем, вывод о том, писать ее или нет, делаем после попытки уравнивания реакции без нее.
Таким образом, следуя этому принципу, запишем:
Уже до начала расстановки коэффициентов очевидно, что есть необходимость в записи в качестве одного из продуктов реакции воды, поскольку в левой части присутствует водород, а в правой его нет.
Таким образом, суммарная схема реакции будет иметь вид:
А само уравнение после расстановки коэффициентов будет выглядеть так:
Следует отметить, что щелочной гидролиз ионных соединений чаще всего не отличается от обычного гидролиза действием воды, поскольку чаще всего ни один продукт обычного гидролиза с щелочью не взаимодействует.
Аналогично, можно сказать, что кислотный гидролиз ковалентных бинарных соединений не будет отличаться от водного.
В связи с этим имеет смысл более детально рассмотреть кислотный гидролиз ионных бинарных соединений и щелочной гидролиз ковалентных бинарных соединений.
Кислотный гидролиз ионных бинарных соединений
Со всеми перечисленными ионными бинарными соединениями, участвовавшими в реакциях обычного гидролиза водой, можно записать соответствующие уравнения их кислотного гидролиза. Возьмем в качестве примера водный раствор соляной кислоты:
Обратите внимание, что вместо водородного соединения в случае нитридов металлов образуется продукт его взаимодействия с соляной кислотой (NH3 + HCl = NH4Cl). Следует отметить, что нитриды металлов – единственный случай, когда при кислотном гидролизе ионного бинарного соединения не выделяется газообразное водородное соединение. Связано это с тем, что по сравнению с другими водородными соединениями неметаллов, только у аммиака основные свойства выражены в значительной степени.
Как можно заметить, кислотный гидролиз гидридов металлов также относится к окислительно-восстановительным реакциям. В результате этой реакции образуется простое вещество водород. Связано это с тем, что водород с кислотами не реагирует.
Щелочной гидролиз ковалентных бинарных соединений
Щелочному гидролизу среди ковалентных соединений подвержены все те же бинарные соединения, что и обычному гидролизу водой, то есть галогениды фосфора и кремния:
Щелочной гидролиз галогенидов фосфора III в ЕГЭ не встретится из-за специфических свойства фосфористой кислоты.
Тем не менее, для тех, кто хочет, ниже предоставляю пример такого рода уравнений с пояснением:
Поскольку фосфористая кислота является двухосновной, то несмотря на наличие трех атомов водорода, при ее реакции с щелочью на атомы металла способны заместиться только два атома водорода.
I. Механизм гидролиза
Гидролиз – это обменная реакция вещества с водой, приводящая к его разложению.
Попробуем разобраться в причине данного явления.
Электролиты делятся на сильные электролиты и слабые. См. Табл. 1.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Степень диссоциации при 180С в растворах с концентрацией электролита 0,1 моль/л близка к 100%. Диссоциируют практически необратимо.
Степень диссоциации при 180С в растворах с концентрацией электролита 0,1 моль/л значительно меньше 100%. Диссоцииация необратима.
- Щелочи
- Соли
- Некоторые неорганические кислоты (НNO3, HClO4,HI, HCl, HBr, H2SO4)
- Гидроксиды металлов, кроме IA и IIA групп, раствор аммиака
- Многие неорганические кислоты (H2S, HCN, HClO, HNO2)
- Органические кислоты (HCOOH, CH3COOH)
- Вода
Вода относится к слабым электролитам и поэтому диссоциирует на ионы лишь в незначительной степени
Н2О ↔ Н + + ОН -
Ионы веществ, попадающие в раствор, гидратируются молекулами воды. Но при этом может происходить и другой процесс. Например, анионы соли, которые образуются при её диссоциации, могут взаимодействовать с катионами водорода, которые, пусть и в незначительной степени, но все-таки образуются при диссоциации воды. При этом может происходить смещение равновесия диссоциации воды. Обозначим анион кислоты Х-.
Предположим, что кислота сильная. Тогда она по определению практически полностью распадается на ионы. Если кислота слабая, то она диссоциирует неполностью. Она будет образовываться при прибавлении в воду из анионов соли и ионов водорода, получающихся при диссоциации воды. За счет её образования, в растворе будут связываться ионы водорода, и их концентрация будет уменьшаться. Н + + Х - ↔ НХ
Но, по правилу Ле Шателье, при уменьшении концентрации ионов водорода равновесие смещается в первой реакции в сторону их образования, т. е. вправо. Ионы водорода будут связываться с ионами водорода воды, а гидроксид ионы – нет, и их станет больше, чем было в воде до прибавления соли. Значит, среда раствора будет щелочная. Индикатор фенолфталеин станет малиновым. См. рис. 1.
Аналогично можно рассмотреть взаимодействие катионов с водой. Не повторяя всю цепочку рассуждений, подытоживаем, что если основание слабое, то в растворе будут накапливаться ионы водорода, и среда будет кислая.
II. Классификация катионов и анионов
Катионы и анионы солей можно разделить на два типа. Рис. 2.
Рис. 2. Классификация катионов и анионов по силе электролитов
К сильным кислотам относятся:
- H2SO4 (серная кислота),
- HClO4 (хлорная кислота),
- HClO3 (хлорноватая кислота),
- HNO3 (азотная кислота),
- HCl (соляная кислота),
- HBr (бромоводородная кислота),
- HI (иодоводородная кислота).
Ниже приведен список слабых кислот:
- H2SO3 (сернистая кислота),
- H2CO3 (угольная кислота),
- H2SiO3 (кремниевая кислота),
- H3PO3 (фосфористая кислота),
- H3PO4 (ортофосфорная кислота),
- HClO2 (хлористая кислота),
- HClO (хлорноватистая кислота),
- HNO2 (азотистая кислота),
- HF (фтороводородная кислота),
- H2S (сероводородная кислота),
- большинство органических кислот, напр., уксусная (CH3COOH).
Слабые основания - это:
- все нерастворимые в воде гидроксиды (напр., Fe(OH)3, Cu(OH)2 и т. д.),
- NH4OH (гидроксид аммония).
III. Отношение к гидролизу солей разных типов
Поскольку и катионы и анионы, согласно данной классификации, бывают двух типов, то всего существует 4 разнообразных комбинации при образовании их солей. Рассмотрим, как относится к гидролизу каждый из классов этих солей.
1. Гидролиз не возможен (гидролиз соли, образованной сильным основанием и сильной кислотой)
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается нейтральной.
2. Гидролиз по катиону (в реакцию с водой вступает только катион, т.е. это гидролиз соли, образованной слабым основанием и сильной кислотой)
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3,MgSO4) гидролизу подвергается катион:
FeCl2 + HOH Fe(OH)Cl + HCl
Fe 2+ + 2Cl - + H + + OH - FeOH + + 2Cl - + Н +
В результате гидролиза образуется слабый электролит, ион H + и другие ионы.
Подведем итог тому, что вы узнали о гидролизе по катиону:
1) по катиону соли, как правило, гидролизуются обратимо;
2) химическое равновесие реакций сильно смещено влево;
3) реакция среды в растворах таких солей кислотная (рН
4) при гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
3. Гидролиз по аниону (в реакцию с водой вступает только анион, т.е. это гидролиз соли, образованной сильным основанием и слабой кислотой)
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3,CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН - и другие ионы.
K2SiO3 + НОH KHSiO3 + KОН
2K + +SiO3 2- + Н + + ОH - НSiO3 - + 2K + + ОН -
рН таких растворов > 7 (раствор приобретает щелочную реакцию).
Подведем итог тому, что вы узнали о гидролизе по аниону:
1) по аниону соли, как правило, гидролизуются обратимо;
2) химическое равновесие в таких реакциях сильно смещено влево;
3) реакция среды в растворах подобных солей щелочная (рН > 7);
4) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
4. Совместный гидролиз: и по катиону, и по аниону (в реакцию с водой вступает и катион и анион, т.е. это гидролиз соли, образованной слабым основанием и слабой кислотой)
Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3,Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Гидролиз - процесс обратимый.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота
Видео - Эксперимент: "Гидролиз солей"
IV. Алгоритм составления уравнений гидролиза солей
Ход рассуждений
Пример
1. Определяем силу электролита – основания и кислоты, которыми образована рассматриваемая соль.
Помните!
Гидролиз всегда протекает по слабому электролиту, сильный электролит находится в растворе в виде ионов, которые не связываются водой.
Кислота
Основания
Слабые – все нерастворимые в воде основания и NH4OH
Na2CO3 – карбонат натрия, соль образованная сильным основанием (NaOH) и слабой кислотой (H2CO3)
2. Записываем диссоциацию соли в водном растворе, определяем ион слабого электролита, входящий в состав соли
2Na + + CO3 2- + H + OH - ↔
Это гидролиз по аниону
От слабого электролита в соли присутствует анион CO3 2- , он будет связываться молекулами воды в слабый электролит – происходит гидролиз по аниону.
3. Записываем полное ионное уравнение гидролиза – ион слабого электролита связывается молекулами воды
2Na + + CO3 2- + H + OH - ↔ (HCO3) - + 2Na + + OH -
В продуктах реакции присутствуют ионы ОН - , следовательно, среда щелочная pH>7
4. Записываем молекулярное гидролиза
V. Практическое применение гидролиза
На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной.
В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
VI. Задания для закрепления
Задание №1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза:
Na2SiO3 , AlCl3, K2S.
Задание №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
Задание №3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ:
сульфид калия - K2S, бромид алюминия - AlBr3, хлорид лития – LiCl, фосфат натрия - Na3PO4, сульфат калия - K2SO4, хлорид цинка - ZnCl2, сульфит натрия - Na2SO3, сульфат аммония - (NH4)2SO4, бромид бария - BaBr2
Свидетельство и скидка на обучение каждому участнику
Данное пособие предназначено для учащихся 11 класса.
Составлены задания для самостоятельной работы учащихся. Пособие поможет ученикам при выполнении лабораторной работы, по выполнению домашней работы; позволит более полно усвоить тему.
1.Необходимо повторить правила пользования таблицей растворимости:

Чтобы определить,растворима ли соль,по вертикале в таблице находим катион,образовавший соль.По горизонтали соответствующий анион. Если на их пересечении стоит буква Р-соль растворима,следовательно в водном растворе диссоциирует на ионы.Если –буква Н- вещество нерастворимо,на ионы не диссоциирует.
Электролиты- это вещества растворы или расплавы которых проводят электрический ток. NaCl , H 2 SO 4 , NaOH
Неэлектролиты -это вещества, водные растворы или расплавы которых не проводят электрический ток. Кислород O 2 , азот N 2 , водород H 2, многие органические вещества – спирты, глюкоза, сахароза, бензол и др.
Сильные электролиты-полность диссоциируют на ионы
Сильные электролиты ( α → 1 или 100%)
1) сильные кислоты ( H 2 SO 4 , HCl , HNO 3 , HClO 4 , HClO 3 , HBr , HI и др.)
2) щелочи ( NaOH , KOH , LiOH , Ba ( OH )2, Ca ( OH )2 и др.)
Слабые электролиты -неполность диссоциируют на ионы
Слабые электролиты ( α → 0)
2) нерастворимые в воде основания ( Cu ( OH )2, Fe ( OH )3 и др.)
3) гидроксид аммония NH 4 OH
3.Следует знать цвет индикаторов в различных средах
Окраска индикатора в среде
Нейтральная
Фенолфталеин
4.Знания о том,как диссоциируют вещества ,относящиеся к различным классам неорганических соединений помогут в написании уравнений гидролиза
Кислоты – электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н + Уравнение электролитической диссоциации сильных кислот:
Слабые многоосновные кислоты диссоциируют ступенчато.
Основания - электролиты, которые при диссоциации образуют только один вид анионов - гидроксид-ионы ОН Уравнение диссоциации сильных оснований (щелочей)
Слабые многокислотные основания диссоциируют ступенчато.
FeOH + ↔ Fe 2+ + OH -
Средние (нормальные) соли – сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН-.
Fe(OH)Cl ↔ Fe(OH) + + Cl - (α = 1)
Fe ( OH ) + ↔ Fe 2+ + OH - (α
Соли – это соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода и гидроксид-ионы. В водном растворе эти ионы гидратированы – окружены молекулами воды.
Водные растворы многих солей имеют кислую или щелочную среду. Причиной этого явления является гидролиз –это взаимодействие ионов соли с водой,приводящее к образованию слабого электролита
Причина гидролиза – электролитическая диссоциация соответствующих солей и воды.
По отношению к воде соли можно разделить на 4 группы:
1.Соли, образованные катионом сильного основания и анионом слабой кислоты.
Гидролиз такого типа называют гидролизом по аниону. Среда раствора щелочная,лакмус синий. Пример:гидролиз соли фосфата натрия( Na 3 PO 4 ). Соль образована сильным основанием-гидроксидом калия и слабой кислотой-фосфорной.
3 Na + + PO 4 3- + Н2О ⇄ НРО4 2- +ОН - +3 Na +
2.Соли, образованные катионом слабого основания и анионом сильной кислоты.
Гидролиз такого типа называют гидролизом катиону.Среда кислая,лакмус красный Пример: гидролиз соли сульфата меди(2)- CuSO 4
Cu 2+ + SO 4 2- + Н2О ⇄ CuOH + + H +
3.Соли, образованные катионом сильного основания и анионом сильной кислоты. Соль гидролизу не подвергается, диссоциирует на ионы в водном растворе. В этом случае. среда нейтральная, лакмус фиолетовый.
4.Соли, образованные катионом слабого основания и анионом слабой кислоты.
Гидролиз такого типа называют гидролизом по катиону и аниону. В этом случае характер среды определяют по степени диссоциации кислоты и основания, образовавших соль. Если степень диссоциации кислоты больше степени диссоциации основания, то среда будет слабокислой. И ,наоборот ,если степень диссоциации основания больше степени диссоциации кислоты, то среда-слабощелочная.
Пример необратимого гидролиза: Al 2 S 3 + H 2 O à Al ( OH )3 ¯ + H 2 S
Особого внимания заслуживает совместный гидролиз.
Соли в водном растворе полностью гидролизованы.
Алгоритм составления уравнений реакций гидролиза:
1. Определить какой по силе кислотой и каким основанием по силе образована соль.
2. Записать уравнение диссоциации соли,затем уравнение диссоциации молекулы воды.
3. Выписать формулу иона слабого электролита и написать уравнение взаимодействия его с одной молекулой воды; в результате получится краткое ионно-молекулярное уравнение гидролиза
4. Записать уравнение реакции гидролиза в молекулярном виде. Указать характер среды и цвет индикатора лакмуса
Рассмотрим ,как пользуясь алгоритмом составления уравнения гидролиза, выполнить задание.
Составить уравнение реакции гидролиза соли, образованной сильным основанием и слабой кислотой-сульфида натрия( Na 2 S )
1.Соль образована гидроксидом натрия-сильным основанием и слабой кислотой-сероводородной.
2.Определить тип гидролиза, среду и цвет индикатора.
Гидролиз по аниону Среда щелочная ,лакмус синий.
3.Записать уравнение диссоциации соли и воды
Na2 S ⇄ → 2Na + + S 2-
4.Записать ионное уравнение гидролиза
2 Na + + S 2- + H 2 O ⇄ HS - +2 Na + + OH -
5.Составить молекулярное уравнение
Na 2 S + H 2 O ⇄ NaHS + Na OH
Составить уравнение реакции гидролиза хлорида меди (2).
1.Рассмотрим состав соли: соль образована слабым основанием гидроксидом меди(2) и сильной кислотой –соляной.
2.Определить тип гидролиза, среду и цвет индикатора.
Гидролиз по катиону, среда кислая, лакмус красный.
3.Записать уравнение диссоциации соли и воды
CuCl2 ⇄ Cu 2+ +2Cl - H2O ⇄ H + + OH -
4.Записать ионное уравнение гидролиза
Cu 2+ +2 Cl - + H 2 O ⇄ Cu OH + +2 Cl - + H +
5.Составить молекулярное уравнение
CuCl 2 + H 2 O ⇄ Cu OHCl + HCl
В тестовых заданиях или в заданиях на соответствие, составленных по типу заданий ЕГЭ встречаются обозначения среды посредством использования значений водородного показателя. Необходимо помнить:
PH > 7- среда щелочная, концентрация ионов гидроксогруппы больше концентрации ионов водорода ; PH PH = 7- среда нейтральная; концентрация ионов водорода равна концентрации гидроксид-ионов.
Количественно гидролиз характеризуется степенью гидролиза. Она показывает сколько молекул вещества от общего числа молекул подвергается гидролизу. Степень гидролиза зависит от температуры, природы вещества, концентрации раствора. Если повысить температуру-это усилит гидролиз, так как это эндотермическая реакция .При разбавлении водой гидролиз усиливается.
Если гидролиз по аниону-повышение концентрации гидроксид-ионов будет ослаблять гидролиз.
Если гидролиз по катиону-повышение концентрации ионов водорода ослабит гидролиз.
Предположим соль- хлорид меди (2).Она гидролизуется по катиону, так как образована слабым основанием –гидроксидом меди(2) и сильной кислотой-соляной. Чтобы усилить гидролиз этой соли ,нужно нагреть раствор; добавить воды; добавить щелочь-раствор(делаем выбор).
Определить формулу соли, если значение PH =7 : хлорид магния, сульфат натрия; бромид алюминия.
1. MgCl 2 –соль образована слабым основанием и сильной кислотой; гидролиз по катиону, среда кислая PH 7;
2. Na 2 SO 4 - соль образована сильным основанием и сильной кислотой; среда нейтральная PH =7.
3. AlBr 3 - соль образована сильной кислотой и слабым основанием; гидролиз по катиону; PH 7
Задания для самостоятельной работы :
1.Задания для закрепления знаний, умений определять характер среды и цвет индикатора
Гидролиз соли усиливается, если связать один из ионов, образующийся в результате гидролиза, в слабый электролит. В результате гидролиза соли слабого основания и сильной кислоты в растворе образуются свободные ионы Н + (рН - (рН>7). Но ионы Н + и ОН - связываются в слабый электролит Н2О. Поэтому степень гидролиза солей увеличивается, то есть гидролиз одной соли усиливает гидролиз другой (необратимый гидролиз). В результате гидролиз таких солей доходит до конца. Так, если смешать растворы Al2(SO4)3 и Na2CO3, то в результате образуется осадок Al(ОН)3 и выделится СО2, но не образуется Al2(CO3)3.
Al 3+ + НОН = AlОН 2+ + Н +
При взаимодействии растворов: Н + + OН - = Н2О
В соответствии с принципом Ле Шателье это усиливает гидролиз каждого из ионов:
AlОН 2+ + НОН = Al(ОН)2 + + Н +
В результате всех этих процессов идет полный взаимный гидролиз соли:
Порядок выполнения опыта.
К пяти каплям раствора сульфата алюминия прибавить 5-6 капель раствора карбоната натрия. Доказать, что образуется осадок Al(ОН)3, а не Al2(CO3)3. Для этого разделить образовавшийся осадок на две пробирки и проверить его растворимость в HCl (2н) и NaOH (2н). Записать наблюдения и уравнения реакций.
Вопросы для самоподготовки
1. Диссоциация молекулы воды. Ионное произведение воды. Водородный показатель (рН).
2. Значение рН для кислых, нейтральных и щелочных растворов, рН биологических жидкостей.
3. Гидролиз солей. Основные случаи гидролиза солей. Ступенчатый гидролиз.
4. Константа гидролиза. Степень гидролиза. Факторы, влияющие на степень гидролиза. Смещение равновесия гидролиза.
5. Особые случаи гидролиза. Полный гидролиз, взаимный гидролиз.
Задачи и упражнения
1. Вычислить рН в растворах сильных электролитов: а) 0,01 М раствор HNO3; б) 0,05 М раствор H2SO4; в) 0,004 М раствор HI; г) 0,1 М раствор HClO3; д) 0,01 М раствор Ва(ОН)2; е) 0,002 М раствор КОН; ж) 0,005 М раствор NаOН.
2. Учитывая только первую ступень диссоциации, вычислить степень диссоциации (a), [H + ] или [OH - ] и рН в растворах слабых кислот и оснований: а) 0,005 М раствор H2S; б) 0,1 М раствор NH4OH; в) 0,02 М раствор HF; г) 0,1 М раствор HCOH; д) 0,05 М раствор H3PO4.
3. Вычислить рН 0,01 моль раствора HNO2, содержащего еще 0,05 моль KNO2. Написать уравнения диссоциации.
4. Вычислить рН 0,005 М раствора HF, содержащего еще 0,015 М NaF. Написать уравнения диссоциации.
5. Вычислить рН 0,05 М раствора NH4OH, содержащего еще 0,1 М NH4Cl. Написать уравнения диссоциации.
6. Рассчитать рН растворов, полученных смешением: а) 25 мл 0,05 М раствора HCl и 15 мл 0,1 М раствора NaOH; б) 50 мл 0,02 М раствора NH4OH и 50 мл 0,1 М раствора NH4Cl; в) 100 мл 0,1 М раствора H2С2O4 и 230 мл 0.4 М раствора Na2С2O4.
7. Написать в молекулярном и ионном виде уравнения первой ступени гидролиза, указать рН раствора для следующих солей: а) KF и Al(NO3)3; б) NaHCO3 и CrCl3; в) Na3PO4 и NaCl; г) CH3COONH4 и Fe2(SO4)3; д) MnBr2 и BaS, е) Na2SiO3 и CuI2.
8. Написать уравнения реакций взаимодействия растворов солей: а) FeBr3 с Na2CO3 , б) CuSO4 с KNO2. Объяснить, полученный результат.
9. Какие факторы усиливают гидролиз? Показать на примерах гидролиза солей: а) Zn(NO3)2, б) NH4NO2; в)BaS.
10. Какие факторы подавляют гидролиз? Показать на примерах гидролиза солей: а) Na2SiO3, б) FeCl3; в) (NH4)2S.
11. Написать в молекулярном и ионном виде уравнения первой ступени гидролиза и вычислить константу гидролиза (Кг), степень гидролиза (h) и рН в растворах следующих солей: а) 0,1 М раствор NaHS; б) 0,05 М раствор NH4NO3; в) 0,05 М раствор K2SO3; г) раствор NH4F; д) 0,02 М раствор Na2HPO4.
ЛАБОРАТОРНАЯ РАБОТА 5
Комплексные соединения.
Теоретическая часть
Комплексными соединениями называются соединения, состоящие из центрального атома и лигандов.
В живых организмах присутствуют комплексные соединения биогенных металлов с белками, аминокислотами, порфиринами, нуклеиновыми кислотами, углеводами, макроциклическими соединениями. Важнейшие процессы жизнедеятельности протекают с участием комплексных соединений. Некоторые из них (гемоглобин, хлорофилл, гемоцианин, витамин В12 и др.) играют значительную роль в биохимических процессах. Многие лекарственные препараты содержат комплексы металлов. Например, инсулин (комплекс цинка), витамин В12 (комплекс кобальта), платинол (комплекс платины) и т.д.
Особенность комплексных соединений заключается в наличии координационной связи, возникающей по донорно-акцепторному механизму.
По координационной теории Вернера в комплексном соединении различают внутреннюю и внешнюю сферы. Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса. Ее обычно заключают в квадратные скобки. Все остальное в комплексном соединении составляет внешнюю сферу и пишется за квадратными скобками. Вокруг центрального атома размещается определенное число лигандов, которое определяется координационным числом (КЧ). Число координированных лигандов чаще всего равно 6 или 4. Лиганд занимает около центрального атома координационное место. При координации изменяются свойства как лигандов, так и центрального атома. Более прочно связанные частицы внутренней сферы называются комплексным ионом. Между центральным атомом и лигандами действуют силы притяжения (образуется ковалентная связь по обменному и (или) донорно-акцепторному механизму), между лигандами – силы отталкивания. Если заряд внутренней сферы равен 0, то внешняя координационная сфера отсутствует.
Центральный атом (комплексообразователь) – атом или ион, который занимает центральное положение в комплексном соединении. Роль комплексообразователя чаще всего выполняют частицы, имеющие свободные орбитали и достаточно большой положительный заряд ядра, т. е. могут быть акцепторами электронов. Это катионы переходных элементов. Наиболее сильные комплексообразователи - элементы I B и VIII B групп. Редко в качестве комплексообразователей выступают нейтральные атомы d-элементов [Fe(CO)5] и атомы неметаллов в различной степени окисления [BH4] - . Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число. Величина координационного числа зависит от многих факторов, но обычно она равна удвоенному заряду иона-комплексообразователя.
Комплексный ион или внутренняя сфера, в зависимости от степени окисления может быть комплексным катионом, комплексным анионом, электронейтральным комплексом.
Анионные – комплексные соединения, в которых комплексный ион имеет отрицательную степень окисления: K3[Fe(CN)6], Na3[Co(NO2)6].
Катионные – комплексные соединения, в которых комплексный ион имеет положительную степень окисления: [Сu(H2O)4]SO4, [Ag(NH3)2]Cl.
К нейтральным комплексным соединениям относятся те, в которых комплексный ион не имеет заряда, то есть комплексы, не имеющие внешней сферы: [Co(NH3)4SO4].
В зависимости от числа донорных атомов лиганда, различают моно-, би- и полидентантные лиганды. Лиганды, координирующиеся через два или более донорных атомов к одному центральному атому, называются хелатными.
Монодентатные лиганды – молекулы воды, аммиака, молекулы СО, молекулы O2, молекулы NO, все галогенид-ионы (F - ; Cl - ; Br - ; I - ); цианид-ионы СN - , тиоцианат (или роданид) - ионы SCN - ; нитрогруппа NO2 - ; гидроксид-ион ОН - .
Бидентатные лиганды (образуют две связи с комплексообразователем) – сульфат-ионы SO4 2- , тиосульфат-ионы S2O3 2- , оксалат-ионы С2О4 2- , многие органические лиганды.
Сумма дентатностей всех лигандов в данном комплексном ионе всегда равна координационному числу комплексообразователя.
Например, комплексный ион [Ag(NH3)2] + . В составе иона две молекулы аммиака. Каждая молекула аммиака - монодентатный лиганд. Следовательно, координационное число (КЧ) комплексообразователя в данном соединении равно 2.
В комплексном соединении состава [Co(H2O)2(NH3)2SO4] три вида лигандов: две молекулы воды, две молекулы аммиака, сульфат-ион. Каждая молекула воды и аммика - монодентатный лиганд, сульфат-ион ˗ бидентатный лиганд. Таким образом, КЧ комплексообразователя равно 2∙1 + 2∙1 + 2 = 6.
Если комплекс катионный, название всегда начинается с аниона: сульфат, хлорид, гидроксид и.т.д. Если комплекс анионный или нейтральный, название начинается с комплексного иона. Первыми перечисляются лиганды с обязательным указанием их количества, если число данного лиганда больше одного, затем название комплексообразователя. Лиганды перечисляются в следующем порядке: первыми ˗ гидроксид-ионы, затем остальные лиганды и в последнюю очередь нейтральные молекулы.
Названия нейтральных молекул, которые входят в состав комплексных ионов: Н2О – аква, NH3 – аммин, СО – карбонил, NO – нитрозил.
Названия анионов, входящих в комплексный ион: Cl - ˗ хлоро, Br - ˗ бромо, I - ˗ йодо, SO4 2- ˗ сульфато, С2О4 2- ˗ оксалато, СN - ˗ циано, SCN - ˗ тиоцианато (или родано), NO3 - ˗ нитрато, NO2 - ˗ нитро.
При названии комплексного катиона используется название металла в родительном падеже с указанием степени окисления в скобках римской цифрой.
Если комплекс нейтральный, то название комплексообразователя дается в именительном падеже.
Если комплекс анионный, то название комплексообразователя дается как солеобразующего металла, то есть берется название металла и обычно добавляется суффикс "ат".
Для большинства металлов используют латинские названия, совпадающие с русскими, исключение составляют: медь - купрат, железо - феррат, золото - аурат, серебро - аргентат, ртуть - меркурат (гидраргират).
Название комплексного иона дается слитно. Название внутренней сферы идет отдельным словом.
В пространстве комплексные ионы имеют форму многогранников (в соответствии с моделью Кеперта атом металла лежит в центре многогранника, а лиганды располагаются в вершинах многогранника). Возможны следующие конфигурации:
1. линейное расположение – комплексы с координационным числом 2 − [CuCl2] − , [Ag(CN)2] − .
2. Плоский равносторонний треугольник – комплексы с координационным числом 3 − [HgI3] − .
3. Тетраэдрическая конфигурация – комплексы с координационным числом 4 − [BF4] − .
4. Плоский квадрат – комплексы с координационным числом 4 − [Pt(NH3)2Cl2].
5. Тригонально-бипирамидальная конфигурация – комплексы с координационным числом 5 − [Fe(CO)5].
6. Октаэдрическая конфигурация − комплексы с координационным числом 6 − [PtCl6] 2− .
Координационные соединения при растворении подвергаются диссоциации. Комплексы, у которых есть внешняя сфера, ведут себя в растворе как сильные электролиты. Данный процесс называется первичной диссоциацией. Комплексы, у которых внешняя сфера отсутствует, являются комплексными неэлектролитами. Комплексные ионы, а также комплексные неэлектролиты в растворе диссоциируют как очень слабые электролиты. Данный процесс называется вторичной диссоциацией. В этом случае процесс диссоциации характеризуется константой нестойкости:
Для характеристики устойчивости комплексных соединений можно использовать величину, обратную константе нестойкости, называемую константой устойчивости:
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса.
Чем меньше концентрация продуктов распада, т.е. чем устойчивее комплекс, тем меньше его константа нестойкости. Наиболее устойчивые в растворах комплексные частицы имеют наименьшие константы нестойкости.
Различают парамагнитные вещества – втягиваются во внешнее магнитное поле (взаимодействуют) и диамагнитые – слабо из него выталкиваются (не взаимодействуют). Различия в магнитных свойствах комплексных веществ, связаны с электронным строением центральных атомов. Если в частице, образующей комплекс все электроны спарены, то их магнитные моменты взаимно компенсируются и комплексный ион является диамагнитным. В случае парамагнитного комплексного иона частица имеет один или несколько неспареных электронов.
Экспериментальная часть
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
В водном растворе частицы растворённого вещества взаимодействуют с молекулами воды. Такое взаимодействие нередко приводит к реакции гидролиза (от др.-греч. hydro — вода + lysis — разложение).
Гидролиз — это химическая реакция взаимодействия вещества с водой, при которой происходит разложение молекул этого вещества и воды с образованием новых соединений.
Гидролиз соединений различных классов — солей, углеводов, галогеналканов, белков, сложных эфиров (в том числе жиров) и др. существенно различается. С гидролизом галогеналканов, белков (полипептидов), ди- и полисахаридов (на примере сахарозы, крахмала и целлюлозы), а также сложных эфиров вы познакомились в курсе органической химии. В этом разделе мы рассмотрим гидролиз неорганических веществ — солей.
Гидролиз солей — это обменное взаимодействие между молекулами воды и катионами или анионами соли, приводящее к образованию слабых электролитов.
Анионы слабых кислот, взаимодействуя с катионами водорода, могут образовывать слабо диссоциирующие молекулы кислоты. Катионы слабых оснований, взаимодействуя с гидроксид-ионами, могут образовывать малодиссоциирующие основания.
Среда в водных растворах гидролизующихся солей может быть кислой ( pH ) или щелочной ( pH > 7,0 ) потому, что в растворе соли в результате гидролиза появляется избыток ионов Н + или ОН – .
Отличие среды раствора соли от нейтральной — один из признаков гидролиза соли. Насколько велико это отличие, а также кислым или щелочным является раствор соли, зависит от силы основания и кислоты, из которых эта соль образуется по реакции нейтрализации.
Классификация солей по их подверженности реакции гидролиза
Любая соль может быть представлена как продукт реакции нейтрализации (от лат. neuter — ни тот, ни другой) при взаимодействии кислоты и основания. Кислоты и основания могут быть как сильными, так и слабыми электролитами.
Реакция нейтрализации — это реакция обмена между кислотой и основанием с образованием соли и воды:
KOH + HF = KF + H2O.
Кислоты и основания как электролиты различаются по своей силе. Например, соли аммония можно рассматривать как образованные в реакции с участием слабого основания — гидрата аммиака NH3 · H2O . Соль KF образована сильным основанием KОН и слабой кислотой HF, сульфид аммония — слабым основанием и слабой кислотой.
В зависимости от силы основания и кислоты можно выделить четыре типа солей (рис. 60.1).
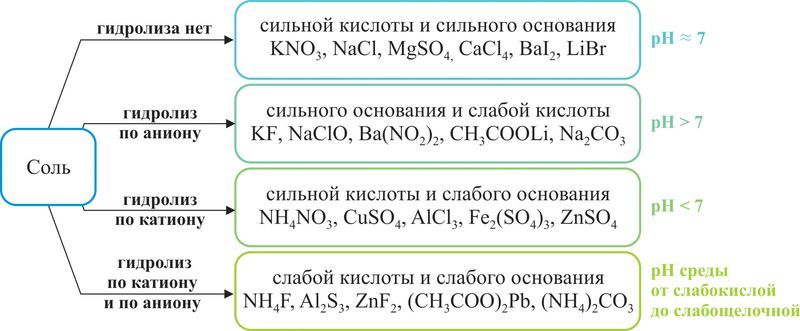
Рис. 60.1. Классификация солей по их подверженности реакции гидролиза
Рассмотрим гидролиз солей всех четырёх типов.
Соли, образованные сильным основанием и слабой кислотой. В качестве примера можно привести ацетат натрия CH3COONa. Эта соль образована сильным основанием NaОН и слабой кислотой CH3COOH:
В водном растворе ацетата натрия происходят два процесса:
а) полная диссоциация сильного электролита — соли CH3COONa на катион и анион:
б) взаимодействие ацетат-ионов с молекулами воды с образованием слабого электролита — уксусной кислоты:
Избыток анионов ОН – накапливается в растворе и создаёт слабощелочную среду, что свидетельствует о протекании гидролиза по аниону CH3COO – .
Уравнение гидролиза ацетата натрия показывает, что:
- а) в растворе концентрация гидроксид-анионов больше, чем в чистой воде, поэтому раствор СH3COONa имеет слабощелочную среду ( pH > 7 );
- б) в реакции обмена с водой и в образовании слабой кислоты участвуют только анионы СH3COO – , поэтому говорят, что гидролиз идёт по аниону.
Равновесие гидролиза в данном примере сильно смещено влево — в сторону образования исходных веществ, так как вода — значительно более слабый электролит, чем уксусная кислота СH3COOH.
Гидролиз является реакцией, обратной нейтрализации.
Примеры анионов слабых кислот, соли которых гидролизуются водой:
- а) анионы слабых одноосновных кислот: HCOO – , , F – ;
- б) анионы слабых многоосновных кислот: S 2– , , , , .
Рассмотрим гидролиз карбоната натрия Na2СO3 — соли сильного основания NaOH и слабой двухосновной кислоты H2CO3. Гидролиз протекает по аниону в соответствии с уравнением в полной ионной форме:
2Na + + + H2O 2Na + + + OH – .
Уравнение в сокращённой ионной форме выглядит так:
В растворе Na2СO3 образуется избыток гидроксид-анионов и создаётся щелочная среда. Раствор Na2CO3 с концентрацией 0,1 моль/дм 3 имеет рН около 11,5.
Соли, образованные сильной кислотой и слабым основанием. Рассмотрим гидролиз хлорида аммония NH4Cl. Это соль сильной кислоты — HCl и слабого основания — гидрата аммиака NH3 · H2O.
В водном растворе соли происходят два процесса:
а) полная диссоциация сильного электролита — соли NH4Cl:
б) взаимодействие ионов аммония с молекулами воды с образованием слабого электролита — гидрата аммиака NH3 · H2O:
Это уравнение показывает, что:
- а) в растворе накапливаются катионы водорода Н + и их концентрация становится больше, чем в чистой воде, поэтому раствор NH4Cl имеет кислую среду (pH , поэтому говорят, что идёт гидролиз по катиону.
В реакцию с водой могут вступать и многозарядные катионы: двухзарядные Ni 2+ , Cu 2+ , Zn 2+ , Mn 2+ , Fe 2+ , Co 2+ , Pb 2+ (кроме катионов Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+ ), трёхзарядные Fe 3+ , Al 3+ , Сr 3+ .
Рассмотрим гидролиз нитрата меди(II) Сu(NO3)2. Это соль сильной кислоты — HNO3 и слабого основания — Cu(OH)2.
В этом случае принято говорить, что гидролиз протекает по катиону Cu 2+ . Уравнение гидролиза в полной ионной форме:
Cu 2+ + + H2O Cu(OH) + + + H + .
Уравнение гидролиза в сокращённой ионной форме:
Продуктами гидролиза являются основная соль Cu(OH)NO 3 и азотная кислота HNO 3 .
Среда водного раствора нитрата меди(II) кислая ( pH ≈ 4,5 ), поскольку в растворе имеется избыток катионов Н + .
Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу и по катиону, и по аниону. При этом появляющиеся при гидролизе по катиону ионы Н + связываются образующимися при гидролизе по аниону ионами ОН – , что усиливает гидролиз. Нередко эта реакция необратима. Например, сульфид алюминия Al2S3 в воде подвергается необратимому гидролизу с образованием нерастворимого гидроксида алюминия и газообразного сероводорода:
Поэтому сульфид алюминия Al2S3 нельзя получить реакцией обмена между водными растворами двух солей, например, нитрата алюминия Al(NO3)3 и сульфида калия K2S.
Возможны и другие случаи необратимого гидролиза. Их нетрудно предсказать, ведь для необратимости процесса необходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции. Приведём пример совместного необратимого гидролиза катионов Al 3+ и анионов :
Подведём итог тому, что вы узнали о гидролизе и по катиону, и по аниону:
- а) если соли гидролизуются по катиону и аниону одновременно, то равновесие в этой реакции больше смещено вправо, чем для гидролиза этих ионов по отдельности;
- б) положение равновесия реакции гидролиза по катиону и аниону не зависит от концентрации соли (докажите это самостоятельно);
- в) реакция среды при этом виде гидролиза может быть нейтральной, слабокислой или слабощелочной, что зависит от силы образующихся основания и кислоты (слабокислая среда свидетельствует о том, что основание является более слабым электролитом, чем кислота, а слабощелочная среда — наоборот);
- г) соли могут необратимо гидролизоваться по катиону и аниону при условии, что хотя бы один из продуктов гидролиза уходит из сферы реакции.
Обобщим информацию о гидролизе различных катионов и анионов в составе средних солей по катионам и анионам в таблице 19.1.
Таблица 19.1. Гидролиз катионов и анионов
| Состав соли | Ионы, по которым не идёт гидролиз | Ионы, по которым идёт гидролиз в порядке усиления | Ионы, по которым идёт сильный гидролиз |
| Катионы | K + , Na + , Li + , Ba 2+ , Sr 2+ , Ca 2+ , Mg 2+ , Ag + | Mn 2+ , Co 2+ , Zn 2+ , Ni 2+ , Fe 2+ , Pb 2+ , Cu 2+ , Be 2+ | Al 3+ , Cr 3+ , Sn 2+ , Fe 3+ |
| Анионы | Cl – , Br – , I – , , , , | F – , , HCOO – , CH3COO – , , ClO – | , , , S 2– |
Не гидролизуются: растворимые галогениды (кроме фторидов), нитраты, перхлораты, сульфаты и перманганаты щелочных и щёлочноземельных металлов.
Отметим, что реакции обратимого гидролиза подчиняются принципу Ле Шателье, поэтому гидролиз соли можно как усилить, так и ослабить.
Гидролиз солей обусловлен протеканием реакций ионного обмена с участием молекул воды и ионов соли с образованием слабого электролита.
Гидролиз по аниону, как правило, обратим и протекает в небольшой степени. При разбавлении растворов солей равновесие гидролиза смещается вправо, реакция среды в растворах солей слабых кислот слабощелочная, изредка сильнощелочная.
Гидролиз по катиону, как правило, обратим и протекает в небольшой степени. При разбавлении растворов солей равновесие гидролиза смещается вправо, реакция среды в растворах солей слабых оснований слабокислая, изредка сильнокислая.
Гидролиз одновременно по катиону и аниону протекает в значительно большей степени, чем гидролиз этих ионов по отдельности. Положение равновесия реакции гидролиза по катиону и аниону не зависит от концентрации соли, а реакция среды раствора не сильно отклоняется от нейтральной.
Соли слабых кислот и оснований необратимо гидролизуются по катиону и аниону при удалении из раствора одного из продуктов реакции в виде газа.
Вопросы, задания, задачи
1. Соли каких типов подвержены гидролизу?
2. Какие из солей, формулы которых: K3PO4, Al2(SO4)3, MgSO4, NH4NO3, Pb(NO3)2, Na2CO3, подвергаются гидролизу по катиону? Составьте уравнения гидролиза этих солей, укажите реакцию среды.
3. Какие из солей, формулы которых: Na2S, AlCl3, K2SO3, Cr2(SO4)3, (CH3COO)2Ba, AgF, Mg(NO3)2, Na2SiO3, KMnO4, Na3PO4, подвергаются гидролизу по аниону? Составьте уравнения гидролиза этих солей, укажите реакцию среды и окраску лакмуса в растворе.
4. Реакция нейтрализации сильных кислот или оснований протекает с выделением теплоты. Используя принцип Ле Шателье, обоснуйте, почему при нагревании равновесие гидролиза смещается вправо.
5. Степень диссоциации воды возрастает в 7,5 раза при её нагревании от 25 °С до 100 °С и уменьшается в 3 раза при охлаждении воды от 25 °С до 0 °С. Дайте объяснение этим фактам с учётом того, что диссоциация воды — эндотермическая реакция. Куда смещается равновесие гидролиза при повышении и понижении температуры и как оно зависит от степени диссоциации воды?
6. Какие из приведённых солей подвергаются гидролизу и по катиону, и по аниону: NH4F, (CH3COO)3Al, (CH3COO)2Cu, (NH4)2CO3, KNO2, AgNO3, Na3PO4, CrCl3? Составьте уравнения гидролиза этих солей (все реакции обратимы) в полной ионной форме.
7. Добавление каких из указанных веществ к раствору сульфата железа(III) усилит гидролиз соли: НСl, NH3, HNO3, Н2O, K2CO3? Дайте объяснение.
8. Стеарат натрия C17H35COONа (твёрдое мыло) гидролизуется в воде по аниону. Составьте уравнение гидролиза в полной и сокращённой ионной формах и укажите, какую среду имеет раствор. Как влияют температура и разбавление раствора мыла на равновесие реакции гидролиза? Почему сода Na2CO3 препятствует гидролизу мыла?
9. Очистка питьевой воды от взвешенных нерастворимых примесей проводится методом коагуляции — слипания мелких частиц с образованием более крупных хлопьев, которые выпадают в осадок. Коагуляция включает три стадии: смешение реагентов с очищаемой водой, образование хлопьев и осаждение хлопьев вместе с загрязнителем. Для проведения коагуляции воду подщелачивают содой и добавляют растворимую соль алюминия. В воде соль алюминия превращается в Al(OH)3 по схеме одновременного гидролиза по катиону Al 3+ и аниону . Образующийся Al(OH)3 представляет собой белые хлопья с большой поверхностью. Хлопья захватывают взвешенные частички, бактерии, ионы тяжёлых металлов, затем укрупняются и оседают вместе с загрязнениями на дно отстойника. Напишите уравнение реакции между сульфатом алюминия и карбонатом натрия в молекулярной, полной и сокращённой ионной формах.
10. При сливании растворов FeCl3 и Na2CO3 выпадает осадок бурого цвета и наблюдается выделение газа. Какое вещество выпадает в осадок и какой газ выделяется? Напишите уравнение протекающей реакции и рассчитайте объём (н. у.) выделившегося газа, если к раствору Na2CO3 объёмом 100 см 3 с массовой долей растворённого вещества 7,85 % и плотностью 1,080 г/см 3 прилили избыток раствора FeCl3.
Читайте также:

