Чем угрожает наличие дилатации левого предсердия в сочетании с частой предсердной экстрасистолией
Обновлено: 16.05.2024
Актуальность. Определение дилатации левого предсердия (ЛП) эхокардиографическим методом (ЭхоКГ) является одним из критериев диагностики сердечной недостаточности с сохраненной фракцией выброса.
Цель исследования — определение возможных причин занижения площади ЛП по ЭхоКГ у пациентов с гипертонической болезнью.
Материалы и методы. В проспективном исследовании у 89 амбулаторных пациентов (57 пациентов с длительность зубца P (з. P) > 0,1 мм и 32 пациента с з. Р ≤ 0,1 мм во II стандартном отведении ЭКГ) проведена эхокардиография с определением площади левого предсердия в 4- и 2-камерных позициях из апикального доступа с оптимизацией выведения ЛП и без нее, а также в 4-камерной позиции из субкостального доступа.
Результаты. Выявлена сильная положительная корреляционная связь между продолжительностью з. Р по ЭКГ и площадью ЛП по эхокардиографии (r = 0,74). У пациентов с длительностью з. Р более 0,1 мм выявлены различия в площади ЛП в 4-камерной позиции из апикального доступа с оптимизацией выведения ЛП и без нее (22,33 ± 0,68 и 19,02 ± 0,56 см 2 соответственно). Максимальная площадь ЛП выявлена в 4-камерной позиции из субкостального доступа (24,41 ± 0,78 см 2 ).
Заключение. Таким образом, использование соответствия площади/объема ЛП и продолжительности з. Р во II стандартном отведении по ЭКГ, оптимизация выведения ЛП, дополнительное измерение размеров ЛП из субкостального доступа позволят избежать врачам ультразвуковой диагностики занижения размеров ЛП.
Ключевые слова
Об авторе
ул. Карла Маркса, д. 22 а, Екатеринбург, 620026
Список литературы
2. Perez De Isla L, Feltes G, Moreno J, et al. Quantification of left atrial volumes using three-dimensional wall motion tracking echocardiographic technology: comparison with cardiac magnetic resonance. Eur Heart J Cardiovasc Imaging. 2014;15(7):793–799. DOI: 10.1093/ehjci/jeu001.
3. Avelar E, Durst R, Rosito GA, et al. Comparison of the accuracy of multidetector computed tomography versus two-dimensional echocardiography to measure left atrial volume. Am J Cardiol. 2010;106(1):104–109. DOI: 10.1016/j.amjcard.2010.02.021.
4. Gweon HM, Kim SJ, Kim TH, et al. Evaluation of left atrial volumes using multidetector computed tomography: comparison with echocardiography. Korean J Radiol. 2010;11(3):286–294. DOI: 10.3348/kjr.2010.11.3.286.
5. Agner BFR, Kühl JT, Linde JJ, et al. Assessment of left atrial volume and function in patients with permanent atrial fibrillation: comparison of cardiac magnetic resonance imaging, 320-slice multi-detector computed tomography, and transthoracic echocardiography. Eur Heart J Cardiovasc Imaging. 2014;15(5):532–540. DOI: 10.1093/ehjci/jet239.
6. Maceira AM, Cosín-Sales J, Roughton M, et al. Reference left atrial dimensions and volumes by steady state free precession cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2010;12(1):65. DOI: 10.1186/1532-429X-12-65.
7. Hazen MS, Marwick TH, Underwood DA. Diagnostic accuracy of the resting electrocardiogram in detection and estimation of left atrial enlargement: an echocardiographic correlation in 551 patients. Am Heart J. 1991;122(3 Pt 1):823–828. DOI: 10.1016/0002-8703(91)90531-l.
8. Truong Q A, Charipar EM, Ptaszek LM, et al. Usefulness of electrocardiographic parameters as compared with computed tomography measures of left atrial volume enlargement: From the ROMI C AT trial. J Electrocardiol. 2011;44(2):257–264. DOI: 10.1016/j.jelectrocard.2010.04.011.
9. Tsao CW, Josephson ME, Hauser T H, et al. Accuracy of electrocardiographic criteria for atrial enlargement: validation with cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2008;10(1):7. DOI: 10.1186/1532-429X-10-7.
10. Whiteman S, Saker E, Courant V, et al. An anatomical review of the left atrium. Translational Research in Anatomy. 2019;17:1000523. DOI: 10.1016/j.tria.2019.100052.
11. Anderson RH, Razavi R, Taylor AM. Cardiac anatomy revisited. J Anat. 2004; 205(3):159–177. DOI: 10.1111/j.0021-8782.2004.00330.x.
13. Lester SJ, Ryan EW, Schiller NB, et al. Best method in clinical practice and in research studies to determine left atrial size. Am J Cardiol. 1999;84(7):829–832. DOI: 10.1016/s0002-9149(99)00446-4.
Для цитирования:
For citation:
Контент доступен под лицензией Creative Commons Attribution 4.0 License.

Представлен случай исхода миксомы левого предсердия больших размеров у пожилой женщины, осложненный синкопальными состояниями, с последующим удалением миксомы.
Ключевые слова
Полный текст
Введение
На сегодняшний день в связи с улучшением диагностических возможностей частота выявляемости новообразований сердца ежегодно растет и, по данным различных авторов [1, 3, 5, 9, 10, 11], на сегодняшний день достигает от 0,5 до 2,3 случая в год на 1 млн населения.
Первичные опухоли сердца редко встречаются во всех возрастных группах – от 0,001 до 0,03 % по данным аутопсий [3, 7]. Около 75 % всех опухолей сердца являются доброкачественными. Впервые прижизненно первичную опухоль сердца – миксому – диагностировал Goldberg в 1952 г. Это наиболее распространенная первичная опухоль сердца [3]. По данным Л.А. Бокерия, А.И. Малашенко [2], миксомы составляют 50 % от числа всех первичных доброкачественных опухолей сердца, остальные представлены липомами, фибромами, гемангиомами, папиллярными фиброэластомами, рабдомиомами [2, 6, 12]. Согласно генным и иммуногистохимическим исследованиям, миксома сердца состоит из опухолевых клеток – мультипотентных мезенхимальных клеток [3].
Миксома чаще всего встречается у людей в возрасте 30–50 лет, хотя наблюдается практически во всех возрастных группах, в 2–3 раза чаще у женщин, чем у мужчин, 5–10 % составляют семейные [3, 6, 12]. Миксомы семейного характера способны рецидивировать с частотой 20 % сразу в нескольких очагах, несмотря на адекватную хирургическую резекцию. Спорадические миксомы, в отличие от семейных, чаще наблюдаются у женщин среднего возраста, являются изолированными, располагаются в левом предсердии в области межжелудочковой перегородки и редко рецидивируют (около 3 % случаев) [3]. Как правило, миксомы – одиночные опухоли (более 90 %) с ножкой, прилегающей к субэндокардиальной основе [3]. Размеры миксомы могут варьироваться от горошины до опухоли диаметром 8–16 см. Размеры ножки, соединяющей миксому с эндокардом, могут быть различными; достаточная длина ее обеспечивает подвижность опухоли и ее пролабирование в отверстия клапанов сердца [4]. Миксома бывает типичная и атипичная. Типичная миксома растет из межпредсердной перегородки рядом с мембраной овальной ямки. Может локализоваться как в левом (83 %), так и а правом предсердии (13 %), субэндокардиально [3, 7]. Атипичная миксома может расти из стенки предсердий, желудочков и створок клапанов. Часто миксома имеет нечеткие контуры, множественные выросты, напоминающие ножки амебы, неоднородную эхогенность, участки кальциноза. Миксома может иметь капсулу, четкие контуры, овальную формы, однородную эхогенность [7]. В зависимости от анатомического расположения первичные доброкачественные опухоли сердца могут вызывать разнообразные проявления, зачастую с фатальными последствиями [3]. Выделяют четыре группы клинических признаков: эмболические, кардиальные (обструкцию кровотока), системные проявления (реакцию организма на опухоль), метастатические [3]. Эмболия возникает на фоне заноса фрагментов опухоли с развитием инфаркта миокарда, острого нарушения мозгового кровообращения, эмболии легочной артерии и т.д. Обструкция кровотока имитирует стеноз левого или правого атриовентрикулярного отверстия с клинической картиной недостаточности кровообращения, систолическим или диастолическим шумом, который изменяется в зависимости от положения тела. В момент обструкции миксомой отверстия клапанов могут наблюдаться эпизоды потери сознания. Реакция организма на опухоль проявляется в виде лихорадки, утомляемости, миалгии, артралгии, мышечной слабости, снижения массы тела, увеличения скорости оседания эритроцитов, анемии, что связано с повышением уровня сывороточного интерлейкина (ИЛ) 6 [4]. У большинства пациентов с миксомами сердца отмечаются изменения на электрокардиографии (ЭКГ), указывающие на увеличение левого предсердия. Предсердные аритмии или нарушения проводимости встречаются редко.
Терапия симптоматических миксом сердца заключается в полной хирургической резекции опухоли с использованием аппарата искусственного кровообращения. Ранняя послеоперационная летальность составляет до 7,5 % [3].
Клинический случай
Больная В., 77 лет, поступила в кардиологическое отделение Городской клинической больницы № 2 имени Ф.Х. Граля в 2017 г. с диагнозом ишемической болезни сердца (ИБС). Прогрессирующая стенокардия. Постинфарктный кардиосклероз? Осложнения: хроническая сердечная недостаточность (ХСН) IIА стадии, II функционального класса (ФК) (NYHA). Синкопальные состояния. Сопутствующие заболевания: гипертоническая болезнь III ст., 3-й степени. Риск 4. Хронический пиелонефрит в стадии ремиссии.
Доставлена в приемное отделение бригадой скорой медицинской помощи с жалобами на одышку при очень медленном подъеме по лестнице на 1-й этаж, головокружение, артралгии, миалгии. Амбулаторная карта не представлена.
Из анамнеза жизни: работала воспитателем детского сада, профессиональных вредностей в течение жизни не было. Наследственность не отягощена. Одна беременность, закончившаяся родами. Аллергологический анамнез не отягощен. Перенесла острый вирусный гепатит А в молодости.
Объективный статус при поступлении: состояние средней тяжести. Кожные покровы бледные, цианоз губ. Лимфатические узлы, щитовидная железа не увеличены.
Органы кровообращения: особенностей при осмотре грудной клетке не выявлено. Относительная сердечная тупость по срединно-ключичной линии (СКЛ) слева, по окологрудинной справа. Тоны сердца приглушены, шумов не выслушивается. Частота сердечных сокращений 60 в минуту. АД 120/80 мм рт. ст.
Органы дыхания: дыхание свободное через нос. При перкуссии легких звук с коробочным оттенком. Дыхание везикулярное, рассеянные сухие хрипы.
Органы пищеварения: живот мягкий, безболезненный, увеличен в объеме за счет подкожно-жирового слоя. Печень – верхний край в 5-м межреберье, нижний край на 5 см ниже реберной дуги по срединно-ключичной линии, пальпация безболезненная. Стул регулярный, без патологических примесей.
Органы мочевыделения: почки не пальпируются. Симптом поколачивания почек безболезненный. Мочеиспускание свободное, безболезненное.
Неврологический статус: ориентирована в месте и времени, на вопросы отвечает. Зрачки одинаковые, реакция на свет прямая и содружественная сохранена. Менингеальных симптомов нет.
Данные лабораторного и инструментального обследования.
Тропониновый тест отрицательный, КФК МВ – 12,5 е/л.
Маркеры вирусных гепатитов, антитела к ВИЧ не обнаружены. RW отрицательный.
Общий анализ крови: эритроциты – 4,0·10 12 /л, концентрация гемоглобина – 122 г/л, лейкоциты – 8,2·10 9 /л, лейкоцитарная формула: нейтрофилы – 72 %, лимфоциты – 24 %, моноциты – 4 %, СОЭ – 55 мм/ч.
Общий анализ крови: эритроциты – 3,6·10 12 /л, концентрация гемоглобина – 102 г/л, лейкоциты – 7,0·10 9 /л, лейкоцитарная формула: эозинофилы – 1 %, нейтрофилы – 64 %, лимфоциты – 32 %, моноциты – 3 %, СОЭ – 55 мм/ч.
Анализ мочи: удельный вес – 1030, белка нет, лейкоциты – 6–8–10 в поле зрения, плоский эпителий – 2–3 в поле зрения, бактериурия +++.
Проба по Нечипоренко: лейкоциты – 10 500 в 1 мл, эритроциты – 750 в 1 мл, цилиндры отсутствуют.
По результатам бактериологического анализ мочи выделены Corynebacterium spp. 3·10 3 .
Анализ мочи в динамике: удельный вес – 1012, белка нет, лейкоциты – 0–1 в поле зрения.
Биохимический анализ крови: АСАТ (норма 0–31) – 21,4 ед/л, АЛАТ (норма 0–32) – 13,3 ед/л, общий холестерин (норма 3,2–5,5) – 3,75 ммоль/л, триглицериды (норма 0,5–1,8) – 1,39 ммоль/л, глюкоза (норма 3,3–6,4) – 6,5 ммоль/л, калий (норма 3,6–5,5) – 3,38 ммоль/л, мочевина (норма 1,7–8,3) – 4,90 ммоль/л, креатинин (норма 44–98) – 82,3 мкмоль/л, СКФ – 60 мл/мин/1,73 м 2 .
На обзорной рентгенограмме грудной полости: легочная ткань удовлетворительной прозрачности с деформированным за счет пневмосклероза легочным рисунком. Корни уплотнены. Диафрагма четкая. Сердце умеренно расширено в поперечнике. Аорта изогнута, склерозирована.
ЭКГ. Заключение: ритм синусовый с ЧСС 56 в 1 минуту, нарушение внутрипредсердной проводимости. Увеличение обоих желудочков, субэпикардиальная ишемия передней стенки левого желудочка в сравнении с фоновой ЭКГ без динамики.
При холтеровском мониторировании электрокардиограммы за время наблюдения в течение суток найдены следующие виды ритма: синусовый ритм, синусовая брадикардия, синусовая аритмия, частая политопная желудочковая экстрасистолия (495 экстрасистол за запись, из них днем – 478 (до 120 экстрасистол в час, ночью – 17, до 9 в час)), в дневные часы эпизоды бигеминии. Частая суправентрикулярная экстрасистолия (549 экстрасистол за запись, из них днем 360, до 95 экстрасистол в час, ночью – 189, до 69 экстрасистол в час). Ишемические изменения сегмента ST-Т не найдены.
Карта доплерэхокардиографического исследования (ЭхоКГ). Левый желудочек: конечный систолический размер – 5,6 см, конечно-систолический объем – 33 мл, конечно-диастолический объем – 83 мл, ударный объем – 50 мл, фракция выброса – 60 % (по Симпсону). Межжелудочковая перегородка – 12 мм в диастолу, задняя стенка левого желудочка – 11 мм в диастолу. Индекс массы миокарда ЛЖ – 162 г/м 2 . Левое предсердие: 4,4×4,8×5,8 см, объем – 69 мл, ИО – 42 мл/м 2 . Правый желудок – 2,8 см. Правое предсердие – 3,8×4,7 см. Митральный клапан: створки, хордальный аппарат не изменены, Vmax – 1,13 м/с, Рgmax – 5,1 мм рт. ст. Е/А – 1,0, поток отклонен к стенке левого желудочка с турбулентностью. Аортальный клапан: 3-створчатый, створки не изменены. Открытие створок – 2,4 см, ФК – 2,5 см. Аорта: синусы – 3,3 см, восходящая – 3,7 см. Трикуспидальный клапан: створки не изменены, степень регургитации – 1-я. Легочная артерия – 2,5 см. Давление в правом желудочке среднее – 20 мм рт. ст. В левом предсердии объемное образование около 6,5×3,0 см, широким основанием крепится к межпредсердной перегородке. Имеет подвижный конец, в диастолу пролабирующий в левый желудочек, суживая митральное отверстие. Заключение: дилатация левого предсердия. Объемное образование левого предсердия 6,5×3,0 см с широким основанием, которое крепится к межпредсердной перегородке (миксома), суживая митральное отверстие. Общая сократимость в норме. Зон асинергии не лоцируется. Данных о легочной гипертензии в покое не выявлено.
Ультразвуковое исследование брахеоцефальных артерий на экстракраниальном уровне: признаки стенозирующего атеросклероза, гемодинамически незначимые плоские бляшки в бифуркации общей сонной артерии с обеих сторон. S-изгибы позвоночных артерий в первом сегменте, слева с градиентом давления. Кровоток магистральный симметричный.
В отделении проводилось лечение: винпоцетин, 5 мг, внутривенно капельно, эноксапарин натрия, 0,8 мл, подкожное введение, 5 дней, цефотаксим, 1,0 г 2 раза в день, 5 дней, диклофенак, 3,0, внутримышечно при болях № 1, ацетилсалициловая кислота, 100 мг, клопидогрел, 75 мг, аторвастатин, 40 мг, вечером, периндоприл, 2 мг.
Пациентка была выписана из клиники в удовлетворительном состоянии с диагнозом: удаление миксомы левого предсердия. Гипертоническая болезнь III стадии, с достижением 1-й степени АГ. Риск 4. Фибрилляция предсердий, персистирующее течение. Осложнения: ХСН IIА стадии / II ФК (NYHA). Сопутствующие: атеросклероз брахиоцефальных артерий. Последствие мозгового инсульта в бассейне средней мозговой артерии (транзиторная ишемическая атака). Липома левой почки.
Рекомендовано наблюдение кардиолога по месту жительства. Обследование плановое: общий анализ крови и мочи, определение микроальбуминурии, биохимический анализ крови с определением глюкозы, общего белка, общего билирубина, креатинина с нахождением клиренса креатинина, АСТ, АЛТ, контрольная электрокардиограмма, ЭхоКГ, ХМЭКГ.
Рекомендован постоянный прием: варфарина, 2,5 мг, по 1 таблетке в день (с достижением целевого уровня МНО 2,0–3,0), аторвастатина, 20 мг, рамиприла, 2,5 мг, утром, спиронолактона, 25 мг.
Результаты и их обсуждение
У пациентки наблюдались три группы клинических признаков: эмболические (последствия острого нарушения мозгового кровообращения, синдром средней мозговой артерии), кардиальные (преходящая обструкция митрального клапана с клиникой недостаточности кровообращения, наблюдались эпизоды потери сознания), системные проявления (ускоренное СОЭ, утомляемость, артралгии, миалгии). Данные проявления на протяжении года интерпретировались с помощью различных диагнозов – хроническая недостаточность мозгового кровообращения, СКВ и др. Так, диагностика первичных опухолей сердца зачастую затруднена. Симптомы являются неспецифичными, большинство рутинных обследований не позволяют правильно определить причину патологии, что часто приводит к поздней диагностике заболевания. Широкое применение неинвазивных и достаточно чувствительных методов визуализации – ЭхоКГ, КТ, МРТ и позитронно-эмисионной томографии – позволяет улучшить выявление поражений сердца [3].
Данный случай является типичным клиническим примером осложненного течения спорадической миксомы сердца и стандартной терапии симптоматической миксомы сердца в виде полной хирургической резекции опухоли.
Annotation
The results of catheter ablations in 123 patients with focal atrial arrhythmias are presented; use of irrigated electrodes and electro-anatomic mapping allowed one running up to a high efficiency of ablation providing the 3-year freedom from arrhythmia in 97.1% of patients.
Характерной особенностью ПЭА является их рефрактерность к медикаментозной терапии. Осложнением эктопической тахикардии при её прогрессировании и хронизации может стать аритмогенная кардиомиопатия [20] или вторичная фибрилляция предсердий [9].
Цель исследования - оценить возможности катетерной аблации в лечении эктопических предсердных аритмий.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клиническая характеристика обследованных пациентов
Обследовано 123 пациента в возрасте от 6 до 69 лет (21,2±4,2 лет), оперированных по поводу предсердных эктопических аритмий в период с 2000 по 2006 г. Дети составляли 34,1% (n=42), пациенты старше 50 лет - 17,1% (n=21); преобладали мужчины (54,5%). Сопутствующая кардиальная патология наблюдалась у 27 пациентов (21,9%). В её структуре лидирующее место занимала артериальная гипертензия (у взрослых) или корригированные врождённые пороки сердца (у детей; n=6), а именно дефект межпредсердной перегородки (n=2), аномалия Эпштейна (n=4). Сопутствующая аритмологическая патология наблюдалась у 7 больных (5,7%) и была представлена фасцикулярными блокадами (n=6) и частой желудочковой эктопией (n=1) с количеством экстрасистол 15 тысяч в сутки, что потребовало дополнительной аблации аритмогенного фокуса в выходном отделе правого желудочка.
Большинство пациентов предъявляли жалобы на перебои в работе сердца (56,1%), учащённое сердцебиение (26,8%), одышку при физической нагрузке (30,9%). Часть пациентов (n=37; 30,1%) не предъявляли каких-либо жалоб и были выявлены случайно при скрининговых медосмотрах.
Клинические признаки сердечной недостаточности наблюдались у 38 пациентов (30,9%). Средний ФК (NYHA) составил 0,89±0,19. Конечнодиастолический размер левого желудочка превышал верхнюю границу возрастной нормы у восьми пациентов (6,5%), правого желудочка - у трёх пациентов (2,4%); в то же время фракция выброса была снижена лишь у двух больных. Дилатация левого предсердия (ЛП) отмечалась у 31,7% больных, правого предсердия (ПП) - у 17,9% больных.
Характеристика эктопических аритмий
Одиночная предсердная экстрасистолия наблюдалась у 89 (72,3%) пациентов (из них парная у 29,3%; блокированная у 16,3%), неустойчивая эктопическая тахикардия - у 27,6%, устойчивая - у 7,3%, непрерывно-рецидивирующая - у 10,6%, хроническая - у 17,1% пациентов. У пациентов с хронической тахикардией минимальная, средняя и максимальная частота сердечных сокращений (ЧСС) составила 111,4±14,8; 149,5±11,4 и 179,9±19,9 уд/мин, соответственно. У двадцати восьми больных (22,8%) документирована ФП (у 17 - неустойчивая, у 11 - устойчивая). По данным холтеровского мониторирования (ХМ), среднесуточное количество эктопических комплексов варьировало от 5180 до 116362 (среднее 29763±690) в сутки, что составило от 5,3% до 100% суточной электрической активности (среднее 28,7±2,9%). Длительность аритмического анамнеза составила 6,2±1,0 лет (Мо=4). Продолжительность хронической тахикардии была не менее 4,9±1,2 (от 2 до 10) лет. Поскольку у 12 пациентов (57%) аритмия была обнаружена случайно при медицинском осмотре и 4 пациента (19%) не предъявляли каких-либо жалоб, то установить у них точную продолжительность не представлялось возможным. Таким образом, возраст манифестации аритмии составил 8,9±2,9 (от 2 до 20 лет, Мо - 6) лет. Антиаритмическая терапия (более трёх препаратов) была неэффективной у всех пациентов.
Показаниями для хирургического лечения аритмий стали: явления хронической сердечной недостаточности аритмогенного характера (30,9%), рефрактерность к медикаментозному лечению (100%), развитие вторичной ФП (22,8%).
Методика аблации предсердной эктопии
Перед процедурой все пациенты освобождались от приёма антиаритмических препаратов на протяжении не менее пяти периодов их полувыведения, для кордарона -не менее 3 месяцев. Операция проводилась на электрофизиологическом комплексе CardioLab Version 6.0 (Pruka Engeneering, Inc).
Электроанатомическое картирование осуществляли в условиях навигационной системы CARTO XP (Biosense Webster, США). Под местной анестезией раствором новокаина (0,5%) или лидокаина (1%) пунктировали левую подключичную вену (для диагностического/референтного электрода) и правую бедренную вену (для картирующего/аблационного электрода). В качестве диагностического референтного электрода использовали 10-полюсный электрод Webster (6F), который проводился во всех случаях в коронарный синус и служил для регистрации левопредсердной электрограммы, диагностической стимуляции и в виде анатомического ориентира (фиброзное кольцо митрального клапана). Для манипуляций в полости левого предсердия проводилась транссептальная пункция (ТСП) при помощи транссептальной иглы BRK-1 (Daig, St. Jude Medical Company, США) с набором интродьюсеров по стандартной методике под контролем чреспищеводной эхокардиографии.
Левопредсердную локализацию документировали на основании двух критериев: 1) предсердная эктопическая активация (потенциал А) в отведениях дистального или среднего сегментов коронарного синуса опережала активацию его проксимального сегмента и правого предсердия; 2) наиболее ранняя активация ПП в области межпредсердной перегородки (наименьший интервал Am-Acs) при отсутствии существенного предвозбуждения (Am-P 30 мс) (рис. 1).


Непосредственным эффектом аблации считали исчезновение предсердной эктопии и её отсутствие на протяжении 30 минут, несмотря на медикаментозную провокацию (внутривенное введение растворов атропина сульфата 0,01 мг/кг, астмопента 0,01 мг/кг либо мезатона 30-100 мкг под контролем артериального давления). Всем больным для контроля эффекта воздействия проводили ХМ ЭКГ на 6-7-е сутки после операции. Повторные осмотры аритмолога проводились с интервалом в 3 месяца.
Все результаты выражены как арифметическое среднее ± стандартное отклонение. Для оценки достоверности различий между средними и долями при соответствии распределения вариант закону нормального распределения использовали t-критерий Стьюдента при значении p=0,05 (уровень достоверности для медиан - 95%) и c2-критерий для дискретных переменных. Для оценки статистических различий изменений основных характеристик внутри групп и между группами использовали непараметрический Wilcoxon-Mann-Whitney U-тест.
Антиаритмическая эффективность
Эффективность операции оценивались в трёх временных промежутках: 1) непосредственный результат - отсутствие эктопической активности на протяжении 30 минут, несмотря на медикаментозную провокацию; 2) ближайший результат - отсутствие патологической эктопической активности при ХМ на 6-7-е сутки после операции; 3) отдалённый результат - отсутствие патологической эктопической активности при ХМ через 3 месяца и далее после операции.
Непосредственный эффект был достигнут у всех пациентов. Летальных исходов и осложнений не было. В ближайшем послеоперационном периоде у 7 пациентов (5,6%) отмечен рецидив эктопии на 3-8 (4,8±1,8) сутки после вмешательства, что потребовало повторной аблации, которая была выполнена с положительным эффектом. У 18 пациентов (14,6%) констатирована резидуальная эктопия с количеством экстрасистол от 650 до 3987 (2013 ±645) в сутки, что соответствовало 10,3±3,4% от их исходного количества.

Гемодинамическая эффективность
Средний ФК (NYHA) сердечной недостаточности составил 0,05 (снижение на 97%). У пациентов с желудочковой дилатацией отмечено восстановление их размеров и фракции выброса. Регресс размеров ЛП на 5,1±0,7 мм (10%) наблюдался у 92% больных с его исходной дилатацией. Передне-задний размер ПП сокращался на 3,9±0,6 мм (5,8%) у всех пациентов с его исходной дилатацией. Наибольшая скорость уменьшения предсердных полостей отмечалась на протяжении первого месяца после операции (61% всего объёма редукции для ЛП и 63,7% для ПП), однако уменьшение передне-задних размеров происходило и далее на протяжении 3 месяцев (для ПП) и 6 месяцев (для ЛП) (рис. 5).
Статья посвящена клинической диагностике и лечению пациентки с гипертрофической кардиомиопатией во время беременности и в ранний послеродовый период. Диагноз: гипертрофическая кардиомиопатия апикальная форма с признаками некомпактного миокарда - впервые выставлен и подтвержден результатами дополнительных методов исследования в НИИ им. А.Н. Бакулева в 2015 г. Течение беременности осложнилось появлением тяжелых нарушений ритма (фибрилляция предсердий, с паузами до 3,3 сек., частая желудочковая экстрасистолия, эпизоды желудочковой тахикардии, блокада левой ножки пучка Гиса), что требовало постоянного наблюдения и коррекции медикаментозной терапии, поскольку пациентка отказывалась от проведения современных хирургических методов лечения. В первый триместр беременности пациентка получала метопролол, а в дальнейшем была переведена на соталол с постепенным увеличением дозировки. В качестве антитромбоцитарной терапии использовался эноксапарин натрия. Родоразрешение прошло без осложнений через естественные родовые пути. В ранний послеродовый период пациентке была проведена радиочастотная абляция на фоне назначения кордарона, однако через 6 мес. вновь возобновились нарушения ритма (фибрилляция предсердий). С учетом многосуточного мониторирования принято решение о повторном проведении процедуры радиочастотной абляции с возможной установкой имплантируемого устройства.

1. Диагностика и лечение сердечно-сосудистых заболеваний при беременности. Российские рекомендации // Российский кардиологический журнал. - 2013. - 4 (102), приложение 1. - 40 с.
2. Рекомендации ESC по диагностике и лечению ГКМП 2014 // Российский кардиологический журнал. - 2015. - № 5 (121). - 57 с.
3. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy // Eur. Heart J. - 2014. - 35 (39). - P. 2733-79.
4. Nimura H. Sarcomere protein gene mutations in hypertrophic cardiomyopathy of the elderly / Nimura H., Patton K.K., McKenna W.J. et al. // Circulation. – 2002. – № 105 (4). – Р. 446-451.
5. Maron B.J. Prevalence of hypertrophic cardiomyopathy in a general population of young adults. Echocardiographic analysis of 4111 subjects in the CARDIA Study. Coronary artery risk development in (young) adults. / Maron B.J., Cardin J.M., Flack J.M. et al. // Circulation. – 1995. – № 92. – Р. 785-789.
6. Заболевания сердца у беременных / С. Окли, К.А. Уорнес; пер. с англ. под ред. Ю.М. Позднякова, Л.Е. Мурашко. - М.: Бином, 2010. - 368 с.
7. Мангушева М.М. Гипертрофическая кардиомиопатия у беременных // Журнал международной медицины. - 2015. - 1 (15). - С. 53-58.
8. Рекомендации ESC по лечению пациентов с желудочковыми нарушениями ритма и профилактике внезапной сердечной смерти // Российский кардиологический журнал. - 2016. - № 7 (135). - 86 с.
9. Walker D. Hyperthrophic obstructive cardiomyopathy and pregnancy: University College London Hospital experience / [Walker D., Kaur N., Bell R., Walker F.] // Minerva Anestesial. – 2007. – № 73. – Р. 485-486.
В структуре экстрагенитальной патологии у беременных заболевания сердечно-сосудистой системы (ССС) составляют около 10% и представлены, наряду с артериальной гипертонией (АГ), врожденными и приобретенными пороками сердца (ВПС и ППС), аритмиями и другими сердечно-сосудистыми заболеваниями (ССЗ), диагностика и лечение которых в период беременности представляют определенные трудности, связанные не только с ограничением диагностических возможностей, но и с выбором медикаментозной терапии [1]. Одними из наименее изученных кардиологических заболеваний у этих пациентов являются кардиомиопатии (КМП), характеризующиеся наличием структурных и функциональных нарушений миокарда желудочков, которые не объясняются ограничением кровотока вследствие ишемической болезни сердца или повышенной нагрузки давлением [2; 3]. Причиной гипертрофических кардиомиопатий (ГКМП), по данным H. Nimura et al., является мутация одного из 10 генов, кодирующих синтез сократительных белков (тяжелых цепей миозина, тропонина Т, тропомиозина и миозинсвязывающего белка С). В результате мутации нарушается расположение мышечных волокон в миокарде, что приводит к гипертрофии [4]. B.J. Maron et al. [5] установили, что частота ГКМП в общей популяции взрослых составляет 1:500, у беременных данная патология наблюдается в 0,1-0,5% случаев [6; 7]. Чаще всего ГКМП выявляют лишь в подростковом периоде либо в возрасте 30-40 лет, и она является наиболее частой причиной внезапной смерти в молодом возрасте. Наступление беременности у больной с ГКМП всегда требует постоянного тщательного наблюдения, потому что свойственное беременности увеличение скорости кровотока и сократимости миокарда способно провоцировать рост градиента давления (ГД) и обструкцию выносящего тракта левого желудочка (ОВТ ЛЖ), а увеличение потребления кислорода - ишемические изменения в гипертрофированном левом желудочке. Кроме того, возможно появление угрожаемых нарушений ритма, что требует постоянного наблюдения и адекватной антиаритмической терапии [8]. В современной литературе накапливается все больше данных о благополучном течении беременности и самопроизвольных родов у пациенток с ГКМП [9], поэтому вопрос возможности беременности необходимо решать в индивидуальном порядке.
Цель: рассмотреть клинический случай течения гипертрофической кардиомиопатии в период беременности и ранний послеродовый период.
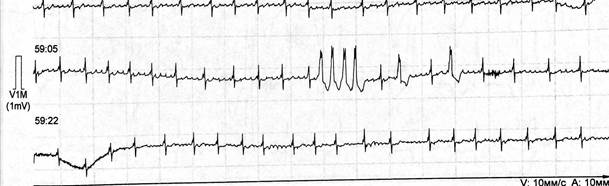
Фрагмент ХМЭКГ. Фибрилляция предсердий, ЖЭС, короткий пароксизм ЖТ
В период отдыха регистрируются поздние сокращения и паузы ритма (83/43), часть из которых обусловлена блокированными предсердными экстрасистолами (30%), часть - эпизодами сино- атриальной (СА) блокады IIст с периодикой Самойлова-Венкебаха. Одиночные, парные наджелудочковые экстрасистолы (25/2). Одиночные, парные (53/2) политопные (4 типа) ЖЭС. ЭКГ- признаки гипертрофии миокарда межжелудочковой перегородки и ЛЖ с перегрузкой. Нарушение внутрижелудочковой проводимости по левой ножке пучка Гиса с меняющейся степенью нарушения проведения. Пациентка выписана из стационара с рекомендациями последовательного снижения дозы кордарана с последующей оценкой состояния и решения вопроса о необходимости назначения терапии 1 раз в 3-6 мес. Через 6 мес. на контрольной ЭКГ: фибрилляция предсердий, ЖЭС. При многосуточном мониторировании: ФП, эпизоды ТП 2:1, 3:1, 4:1; максимальная пауза ритма - 3,1 с, одиночные, парные политопные ЖЭС, пароксизмы ЖТ (3-5 компл.). Пациентка готовится к повторной РЧА с возможной имплантацией ЭКС.
Выводы
Вопрос о возможности вынашивания беременности при наличии гипертрофической кардиомиопатии должен решаться индивидуально. Однако при правильном наблюдении специалистов и с учетом возможностей современной медицины женщины могут нормально выносить беременность и родить здорового ребенка.
Читайте также:

