Болезнь иценко кушинга берут ли в армию
Обновлено: 16.05.2024
Ключевые слова
Для цитирования:
For citation:
Введение
Болезнь Иценко—Кушинга (БИК) — тяжелое заболевание, обусловленное опухолью гипофиза (85%) или гиперплазией кортикотрофов и характеризующееся повышенной секрецией АКТГ [1, 2]. Увеличение секреции АКТГ приводит к хронической гиперпродуции кортизола корой надпочечников с развитием симптомокомплекса эндогенного гиперкортицизма (ЭГ) [3, 7].
В 65—70% случаев ЭГ обусловлен именно БИК [3], причиной которой в 80—85% случаев является аденома гипофиза (кортикотропинома) [2, 5—7].
Эпидемиология
В Европе распространенность БИК составляет 1,2—2,4 случаев на 1 млн населения [1—3]. В последнее время во всем мире отмечается значительное увеличение числа пациентов с данной патологией. Так, в 2013 г. выявлялось от 1,5 до 3,9 новых случаев БИК на 1 млн населения [2, 4].
БИК манифестирует, как правило, в молодом возрасте. У женщин заболевание диагностируется в 8 раз чаще, чем у мужчин, и развивается в возрасте от 20 до 40 лет. Заболеваемость зависит от числа беременностей и родов, а также от травм головного мозга и наличия нейроинфекций. Нередко БИК начинается в период полового созревания [6].
Клинические проявления БИК
Симптомы гиперкортицизма чрезвычайно разнообразны и могут проявляться в разной комбинации и с разной выраженностью [5, 9].
Клинические признаки заболевания можно разделить на специфические и неспецифические. При этом специфические симптомы гиперкортицизма могут отсутствовать у 50% больных.
Среди специфических симптомов принято выделять:
• матронизм (лунообразное лицо) — 75%;
• кожные проявления в виде плеторы — 70%;
• жировые отложения на шее и особенно выраженные в надключичной области и на затылке — 62%;
• мышечная слабость — 65%;
• стрии багрового цвета шириной более 1 см — 50%, геморрагии — 35% [3, 10];
• геморрагический синдром, частые синяки на коже [2, 6].
Основными неспецифическими проявлениями являются:
• избыточная масса тела или ожирение — 80—96% [3, 6, 10], в ряде случаев диспластическое ожирение;
• артериальная гипертензия — 60—88% [3, 6, 10];
• нарушения менструального цикла — 38—69% [3], импотенция, ослабление либидо — до 85% [3, 6];
• гирсутизм — 75%, акне — 37—67% [3, 6], склонность к фурункулезу, грибковое поражение кожи и ногтей;
• депрессия и/или изменения настроения (эмоциональная лабильность, эйфория, психоз) — до 85% [3, 6];
• нарушения углеводного обмена: сахарный диабет 2-го типа — 20—41%, нарушение толерантности к углеводам — 70% [3, 10];
• снижение минеральной плотности костной ткани (МПКТ): остеопения, остеопороз, переломы — 21—80% [3, 6];
• нарушения липидного обмена — 70%;
• замедление или полная остановка роста, особенно у детей [2, 3];
• более редко: полиурия, мочекаменная болезнь — 15%.
Преобладание неспецифических признаков и симптомов затрудняет своевременную диагностику заболевания.
Cреди причин смертности пациентов с БИК лидирующую позицию занимают сердечно-сосудистые заболевания (34%). На долю цереброваскулярных заболеваний приходится 8%, на долю злокачественных образований — 8%, инфекционных заболеваний — 8%. Другие причины, включая неизвестные, обусловливают 34% всех случаев смерти пациентов с БИК [2, 11].
Алгоритм диагностики БИК
Для первичной диагностики ЭГ используются следующие стандартизованные методы: определение свободного кортизола в суточной моче, определение кортизола в слюне в 23 ч, малая проба с дексаметазоном (1 мг) [2, 3, 5, 9, 12].
После подтверждения ЭГ дифференцируют АКТГ-зависимый и АКТГ-независимый гиперкортицизм, определяя уровень АКТГ и его ритм (в 8 и 23 ч) в плазме крови. Нормальный или повышенный уровень АКТГ (>10 пг/мл) исключает наличие кортикостеромы. У пациентов с БИК утренний уровень АКТГ может быть как выше нормы, так и нормальным. Это часто останавливает врача от дальнейшего диагностического поиска и является ошибкой.
Для дифференциальной диагностики АКТГ-эктопированного синдрома (АКТГ-ЭС) и БИК возможно проведение большой пробы с дексаметазоном (БПД), пробы с кортикотропин-рилизинг гормоном (КРГ) и десмопрессином.
Для визуализации аденомы гипофиза используют в основном МРТ головного мозга с контрастированием, что позволяет получить информацию о распространении аденомы и степени вовлечения окружающих структур.
Современные методы лечения БИК
Смертность среди пациентов с БИК крайне высока и коррелирует с уровнем кортизола в крови. Основными целями лечения БИК являются: быстрое купирование клинических проявлений, нормализация уровня кортизола в крови и моче, удаление объемного образования при сохранении функций гипофиза. Необходимо не только быстро купировать гиперкортицизм, но и обеспечить длительное поддержание уровня кортизола в пределах нормы.
C 2000 г. первое место в терапии БИК занимает нейрохирургическая операция — трансфеноидальная аденомэктомия [13]. По данным разных авторов [13, 14], первичная ремиссия развивается в 65—90% случаев после резекции микроаденом (до 1 см) и в 50—70% случаев после резекции макроаденом (более 1 см).В 20—25% случаев в течение 2—4 лет возникают рецидивы [11, 14].
Основным осложнением хирургического лечения является назальная ликворея (3,1—4,6%). Парезы глазодвигательных нервов, зрительные расстройства, кровоизлияния в ложе удаленной опухоли, субарахноидальные кровоизлияния встречаются крайне редко.
Повторная операция может быть успешной только в случае четкой визуализации остаточной ткани опухоли с помощью МРТ. Однако при этом высок риск послеоперационного гипопитуитаризма [14]. По данным P. Valderrábano и соавт. [15], рецидив после повторной операции наблюдается чаще, чем после первой, что позволяет усомниться в ее целесообразности.
Согласно рекомендациям Международной ассоциации радиохирургов (2004), при неэффективности нейрохирургического лечения БИК следует использовать радиохирургию. К лучевым видам терапии относятся: гамма-нож, протонотерапия, дистанционная стереотаксическая радиотерапия. Последний вид лучевого лечения связан с развитием частичного или полного гипопитуитаризма у 50% пациентов [14]. Частота ремиссий после обычной лучевой терапии составляет 55—70% в течение 3—5-летнего периода. Применение стереотаксических методов лечения повышает этот показатель до 65—75%.
Наиболее радикальным подходом к лечению БИК является двусторонняя адреналэктомия, которая устраняет гиперкортицизм, оставляя при этом прогрессирующую опухоль гипофиза. Такой подход — терапия выбора у пациентов с выраженной клинической картиной гиперкортицизма при безуспешносати всех вышеперечисленных методов лечения [9].
Медикаментозная терапия: вчера и сегодня
Применение консервативных методов терапии позволяет предупредить тяжелые осложнения и улучшить качество жизни пациентов с БИК [2, 11]. В настоящее время спектр препаратов для консервативной терапии достаточно широк. Их можно разделить на три группы (таблица).
Таблица. Лекарственные препараты для лечения БИК
Препараты, блокирующие синтез кортизола
Препараты, блокирующие глюкокортикостероидные рецепторы
Препараты центрального действия
Примечание. В скобках — уровень доказанности лечебного эффекта.
А — метаанализы с достаточной статистической мощностью; B — метаанализы, рандомизированные контролируемые исследования с ограничениями или субоптимальной статистической мощностью; C — хорошо организованные исследования случай—контроль. Нерандомизированные контролируемые исследования. Исследования с недостаточным контролем. Ретроспективные или наблюдательные исследования. Серии клинических наблюдений Проспективные когортные исследования; D — мнение экспертов.
Основной целью медикаментозной терапии является нормализация уровня кортизола в крови и суточной моче. Принципиальным эффектом терапии препаратами, блокирующими синтез кортизола и глюкокортикостероидные рецепторы, является способность контролировать негативные эффекты избытка глюкокортикоидов без влияния на рост аденомы гипофиза [8]. Подобная терапия не позволяет восстановить нормальную секреторную активность гипоталамо-гипофизарно-надпочечниковой оси. Эти препараты чаще всего применяются при подготовке к операции, в связи с отсрочкой ее проведения или в ожидании эффекта лучевой терапии.
1. Препараты, блокирующие синтез кортизола
Ингибиторы стероидогенеза реализуют свой эффект путем прямого ингибирования цитохрома Р450. Высокая частота побочных эффектов со стороны желудочно-кишечного тракта ограничивает их использование.
а) Кетоконазол — противогрибковый препарат, ингибитор нескольких ферментативных систем, в том числе Р450, 17,20-лиазы, 11 β-гидроксилазы, 17α-гидроксилазы. В дозе 600—1200 мг/сут этот препарат ингибирует стероидогенез. Он остается самым распространенным медикаментозным средством терапии БИК. Побочные эффекты включают гинекомастию (13% у мужчин), психические расстройства (8%), аллергические реакции (6%), сыпь (2%), а также повышение ферментативной активности печеночных ферментов (15%) [17]. Последнее обычно исчезает после окончания терапии [17]. У некоторых пациентов блокада стероидогенеза не достигается.
б) Метирапон блокирует цитохром P450c11.
В дозах 250—750 мг/сут он нормализует уровень кортизола в плазме у 75% пациентов. Дозозависимые побочные эффекты часто ограничивают его использование. К побочным эффектам относятся кожная сыпь (4%), головокружение и атаксия (15%), тошнота (5%), отеки (8%), гипокалиемия, прогрессирование акне или гирсутизма (у 70% женщин) [8]. Еще одним побочным действием является ингибирование синтеза альдостерона и накопление его предшественников со слабой минералокортикоидной активностью.
в) Митотан (500—3000 мг/сут) — вызывает атрофию пучковой и сетчатой зон коры надпочечников и используется в лечении адренокортикального рака. Ремиссия достигается почти у 80% пациентов. У пациентов часто проявляются такие побочные эффекты, как тошнота, рвота, диарея, аллергические реакции, сонливость, дислипидемия [6, 8].
г) Этомидат ингибирует 11β-гидроксилазу. Его вводят внутривенно в дозе 0,04—0,05 мг/кг/ч. В более высоких дозах (0,3 мг/кг/ч) обладает седативным эффектом [8].
2. Модуляторы глюкокортикостероидных рецепторов (GR)
Мифепристон (RU-486) блокирует действие кортизола, андрогенов и прогестерона. В дозе 6—
25 мг/кг/сут препарат блокирует рецепторы GR-II. Его aффинность к этим рецепторам в 3—4 раза выше, чем у дексаметазона и в 18 раз выше, чем у эндогенного кортизола [16, 18]. Препарат не только не нормализует уровень АКТГ и кортизола в крови, а приводит к еще большему увеличению их концентрации.Побочными эффектами являются усиление гипокалиемии и задержка натрия и жидкости.
3. Препараты центрального действия
Препараты центрального действия являются основными средствами лечения гормонально-активных аденом гипофиза.
Соматостатин и дофамин играют важнейшую роль в регуляции функции гипофиза. Воздействуя на соответствующие рецепторы в тканях-мишенях, они снижают секрецию гормонов и тормозят пролиферации клеток [2].
Выделено 5 подтипов соматостатиновых рецепторов (SSTR), различающихся структурой и распределением в органах и тканях [19]. Клетки кортикотропином в 89% случаев экспрессируют как эти рецепторы, так рецепторы дофамина (DR2).
D. Batista и соавт. [20] сравнили экспрессию разных подтипов рецепторов соматостатина и DR2 в клетках кортикотропином и опухолей с эктопической продукцией АКТГ. В кортикотропиномах преобладали SSTR5 (90%), SSTR2 (70%) и SSTR1 (60%). Коэкспрессия двух и более подтипов SSTR установлена в 81% кортикотропином, в 50% АКТГ-эктопических опухолей. Полученные результаты легли в основу разработки таргетной терапии БИК агонистами дофамина и SSTR.
В клинической практике хорошо известен каберголин, с успехом использующийся при лечении пролактином. Эффект каберголина напрямую коррелирует с экспрессией DR2 на клетках АКТГ-секретирующих аденом. Снижение кортизола в суточной моче было выявлено у 40% пациентов с БИК, кортикотрофы которых экспрессировали DR2 [8]. Доза каберголина титруется от 1 до 7 мг в нед [8]. Первичный ответ проявляется через 3 мес. Препарат хорошо переносится большинством пациентов. Среди побочных эффектов отмечают артериальную гипотонию [8]. Описан также феномен ускользания из-под действия препарата. Использование агонистов дофамина позволяет улучшить состояние пациента при рецидиве БИК.
Соматостатин блокирует выработку ГР, ПРЛ, ТТГ и АКТГ в передней доле гипофиза. Он обладает также антипролиферативным эффектом, активируя апоптоз клеток. Основой таргетной терапии является использование аналога соматостатина, селективного в отношении специфических рецепторов, отвечающих за определенную биологическую реакцию. Это позволяет уменьшить взаимодействие с другими подтипами рецептора, которое могло бы привести к нежелательным эффектам [19]. В кортикотропиномах доминируют SSTR5 [26, 27].
Пасиреотид: эффективность, безопасность и побочные эффекты
Пасиреотид мультилиганд обладает чрезвычайно высоким сродством к SSTR5 и достаточно высокой аффинностью к другим подтипам SSTR [19, 20]. Препарат особенно эффективно тормозит секрецию АКТГ и кортизола через 72 ч после введения. Его применение гораздо реже сопровождается тахифилаксией, чем применение средств, преимущественно связывающихся с SSTR2. Сродство пасиреотида к SSTR1 в 20—30 раз, а к SSTR5 в 40—100 раз выше, чем у октеротида и ланреотида.
Эффективность, переносимость и безопасность пасиреотида были показаны в клиническом исследовании III фазы [22]. У большинства пациентов достигалось быстрое и стойкое снижение уровня кортизола, а у части пациентов уровень кортизола полностью нормализовался, что сопровождалось ослаблением основных проявлений заболевания — снижением артериального давления, уровня холестерина и индекса массы тела.
L. Trementino и соавт. [21] определяли уровень кортизола в слюне в качестве показателя раннего ответа на терапию пасиреотидом. Содержание кортизола в вечерней слюне коррелировало с уровнем свободного кортизола в суточной моче. В исследование были включены 7 пациентов с БИК, получавших пасиреотид (600 мкг 2 раза в сут в течение
15 сут). Наибольшее снижение уровня кортизола в слюне (на 58%) было достигнуто на 5 сут. К 15-м суткам концентрация кортизола в слюне и моче снижалась у всех 7 пациентов. У тех, кто получал препарат в дозе 600 мкг 2 раза сут, объем опухолевой ткани уменьшился на 9,1%, а у получавших по 900 мкг 2 раза в сут — на 48,3% [22]. Профиль безопасности пасиреотида аналогичен таковому других аналогов соматостатина. Отмечались такие побочные эффекты, как диарея (58%), тошнота (52%), прогрессирование желчекаменной болезни (30%), головная боль (28%), боли в животе (24%), сосудистые нарушения (приливы крови к лицу, гипотензия), повышение активности печеночных ферментов (29%) [22]. На фоне приема пасиреотида наблюдалось повышение уровня глюкозы, но в меньшей степени, чем при применении октреотида.
Для β-клеток поджелудочной железы человека характерна преимущественная экспрессия SSTR2 и SSTR5. Блокируя SSTR5, пасиреотид тормозит синтез и секрецию инсулина и ингибирует инкретиновый ответ [24, 25]. Гипергликемия развивается почти сразу после введения препарата. В течение последующих 8 ч уровень глюкозы нормализуется. Через несколько дней гипергликемический эффект пасиреотида становится менее выраженным.
На основании результатов исследований разработан алгоритм сахароснижающей терапии пациентов с БИК, принимающих пасиреотид. Учитывая наличие инсулинорезистентности, рекомендуется использовать метформин в качестве терапии первой линии с последующим добавлением ингибиторов дипептилпептидазы IV типа (иДПП-4) или агонистов глюкагоноподобного пептида-1 (ГПП-1) [24]. Наибольшей эффективностью обладают вилдаглиптин и лираглютид [25].
Показаниями для проведения терапии пасиреотидом являются:
• невозможность проведения нейрохирургического вмешательства как метода терапии первой линии: при тяжелом общем состоянии пациента, высоком анестезиологическом риске, категоричном отказе пациента от проведения нейрохирургического вмешательства;
• неэффективность ранее использованных методов терапии (до адреналэктомии);
• рецидивирующее течение БИК;
• непереносимость других лекарственных препаратов;
• после лучевой терапии до наступления эффекта;
• подготовка к оперативному вмешательству.
При отсутствии противопоказаний рекомендуемая начальная доза препарата 600 мкг 2 раза/сут п/к. При адекватной переносимости пасиреотида в течение 3-х месяцев и слабом положительном эффекте в снижении уровня свободного кортизола в моче дозу повышают до 900 мкг 2 раза/сут с продолжением мониторинга клинико-лабораторных показателей. Следует осуществлять индивидуальный подбор дозы. При возникновении нежелательных явлений может потребоваться временное снижение дозы препарата до 300 мкг 2 р/сут п/к.
Основными противопоказаниями к применению пасиреотида являются тяжелые нарушения функции печени и индивидуальная непереносимость препарата. Однако учитывая профиль безопасности и весь спектр нежелательных явлений, следует провести ряд диагностических процедур для решения вопроса об инициации терапии: оценить степень компенсации углеводного обмена, функцию печени, риски удлинения интервала QT. При умеренных нарушениях функции печени, а также при подтвержденном СД рекомендуемая начальная доза пасиреотида 300 мкг 2 раза/сут с максимальным увеличением дозы до 600 мкг 2 раза/сут.
В связи с дозозависимым гипергликемическим действием пасиреотида предложено использовать различные дозировки для начала терапии в зависимости от состояния углеводного обмена. Так, для пациентов с уже имеющимся СД 2-го типа или нарушением толерантности к углеводам рекомендуют начинать лечение пасиреотидом с дозы 300 мкг 2 раза/сут п/к; для пациентов без нарушений углеводного обмена — 600 мкг 2 раза/сут с последующим увеличением дозы до 900 мкг 2 раза/сут.
Если у пациентов не отмечено ответа на терапию пасиреотидом после 2-х месяцев лечения, следует рассмотреть вопрос о его прекращении.
Заключение
Лечение БИК представляет собой сложную проблему, эффективное решение которой зависит от точности диагностики, правильной оценки активности гиперкортицизма и тяжести заболевания, а также от индивидуального подхода к выбору методов лечения. Внедрение в клиническую практику пасиреотида (Сигнифор, Novartis) позволяет достигнуть клинико-лабораторной ремиссии БИК и уменьшения размеров опухоли. Таким образом, пасиреотид является эффективным препаратом для специфического лечения кортикотропных аденом у пациентов с БИК.
Дополнительная информация
Информация о финансировнии и конфликте интересов.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Для цитирования: Древаль А.В. Синдром Иценко – Кушинга (лекция). РМЖ. Медицинское обозрение. 2016;24(1):2-5.
Лекция посвящена внегипофизарным болезням, вызывающим гиперсекрецию глюкокортикоидов надпочечниками
Для цитирования. Древаль А.В. Синдром Иценко – Кушинга (лекция) // РМЖ. 2016. No 1. С. 2–5.
Клинический синдром, который развивается вследствие повышенного содержания глюкокортикоидов в крови, называют синдромом Иценко – Кушинга.
Эндогенный синдром Иценко – Кушинга развивается при аденоме или карциноме коры надпочечников, а также на фоне гиперпродукции адренокортикотропного гормона (АКТГ) опухолью гипофиза или АКТГ-секретирующей опухолью, локализованной вне гипофиза (эктопический АКТГ-синдром), и очень редко при эктопической секреции опухолью кортикотропин-рилизинг-гормона (КРГ).
Ятрогенный (экзогенный) синдром Иценко – Кушинга — частое осложнение терапии глюкокортикоидами, когда их используют как противовоспалительные или иммуносупрессивные средства.
Перечень патологических состояний, при которых продукция глюкокортикоидов повышена, представлен в таблице 1. Следует заметить, что кроме указанных в таблице болезней описан и ряд очень редких генетически детерминированных заболеваний, при которых развивается синдром Иценко – Кушинга.
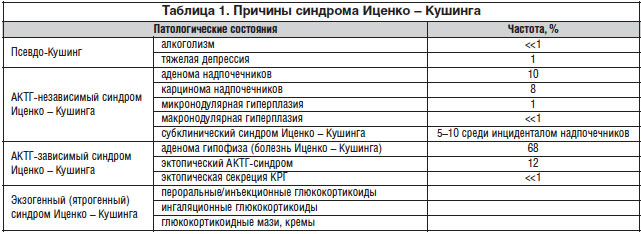
В данной лекции рассмотрим внегипофизарные болезни, вызывающие гиперсекрецию глюкокортикоидов надпочечниками.
Доброкачественная адренокортикальная аденома
Доброкачественная адренокортикальная аденома обычно инкапсулирована, ее размер – менее 4 см в диаметре. Чаще всего она секретирует только глюкокортикоиды.
Лечение хирургическое — односторонняя адренал-эктомия, которую обычно выполняют лапароскопически. В послеоперационном периоде может развиваться надпочечниковая недостаточность. Это следствие атрофии неудаленного надпочечника из-за подавленной секреции АКТГ на фоне гиперпродукции кортизола аденомой. Длительность заместительной терапии глюкокортикоидами может составлять 2 года.
Прогноз после операции благоприятный, вероятность рецидива низкая.
Адренокортикальная карцинома
Адренокортикальная карцинома обычно более 6 см в диаметре, хотя бывают опухоли и меньшего размера. Нередко на момент выявления обнаруживают локальную инвазию опухоли, возможны метастазы. Чаще всего злокачественная опухоль продуцирует несколько гормонов. Наиболее типичная комбинация — кортизол и андрогены (предшественники), реже – минералокортикоиды или эстрогены.
Лечение карциномы надпочечников необходимо проводить в специализированных центрах, где есть хирурги, онкологи и эндокринологи, имеющие достаточный опыт лечения такого рода больных.
Главным методом лечения служит хирургическое удаление опухоли. После операции может понадобиться заместительная терапия. В случае неполного удаления опухоли и/или метастазов назначают препараты, подавляющие секрецию глюкокортикоидов (метирапон, кетоконазол и др.).
Прогноз неблагоприятный. Несмотря на оперативное лечение, 5-летняя выживаемость составляет 22%, а медиана выживаемости — 14 мес. Если больной получает лечение в специализированных центрах, показатели выживаемости оказываются лучше вследствие комплексного лечения, назначаемого онкологами и эндокринологами.
Синдром Иценко – Кушинга, вызванный эктопическим синтезом АКТГ (эктопический АКТГ-синдром)
Эктопический АКТГ-синдром вызывается в 50% случаев злокачественной мелкоклеточной опухолью легкого. Этот синдром может быть и проявлением нейроэндокринных опухолей, которые локализованы в тимусе (15%), поджелудочной железе (10%) или бронхе (10%). Эктопическая продукция КРГ встречается крайне редко.
Отличительные особенности эктопического АКТГ-синдрома:
•Очень высокий уровень кортизола.
•Доминируют клинические проявления артериальной гипертензии, гипокалиемии и метаболического алкалоза, что обусловлено стимуляцией минералокортикоидных рецепторов высоким уровнем кортизола.
•Нет абдоминального ожирения, если злокачественная опухоль быстро прогрессирует, вызывая кахексию.
•Наблюдаются другие симптомы гиперкортизолизма, в частности нарушение толерантности к глюкозе, склонность к инфекциям, тонкая кожа, плохое заживление ран, психические нарушения и др.
•Возможна выраженная гиперпигментация вследствие совместной с АКТГ гиперпродукции проопиомеланокортина, обладающего биологической активностью меланоцит-стимулирующего гормона.
•Уровень АКТГ может быть очень высоким (обычно более 100 пг/мл).
•В 90% случаев в большом дексаметазоновом тесте (2 мг 4 р./сут) содержание кортизола не снижается более чем на 50% от базального уровня, т. к. в опухоли нарушен механизм саморегуляции секреции АКТГ.
•В случае нейроэндокринной опухоли клиническая картина и результаты диагностических тестов могут быть неотличимы от таковых при болезни Иценко – Кушинга (гиперпродукции АКТГ гипофизом), что требует для дифференциальной диагностики проведения селективного забора крови на АКТГ, оттекающей от гипофиза.
•У некоторых больных, несмотря на выраженную клиническую картину гиперкортизолизма, опухоль может быть очень небольших размеров (несколько миллиметров в диаметре), что делает невозможной ее локализацию. В этом случае назначают консервативное лечение гиперкортизолизма, а при очень выраженной клинической картине проводят двустороннюю адренал-эктомию. После устранения симптомов гиперкортизолизма у больного регулярно исследуют потенциально наиболее вероятные зоны локализации опухоли до тех пор, пока она не станет очевидной — тогда ее удаляют.
Лечение заключается в удалении АКТГ-продуцирующей опухоли, где это возможно. В противном случае назначаются препараты, блокирующие продукцию глюкокортикоидов (кетоконазол, например). Если удалить опухоль по тем или иным причинам невозможно, а общее тяжелое состояние больного определяется только гиперкортизолизмом, который трудно контролируется, удаляют надпочечники.
АКТГ-независимая двусторонняя макронодулярная гиперплазия надпочечников
Это редкий эктопический синдром Иценко – Кушинга, который чаще бывает спорадическим, реже – семейным. Наиболее частая причина — эктопический синтез в надпочечниках рецепторов гастроинтестинального полипептида. Секреция этого полипептида клетками желудочно-кишечного тракта повышается после приема пищи, что стимулирует секрецию глюкокортикоидов в надпочечниках, т. е. развивается связанный с приемом пищи гиперкортизолизм. Могут эктопически синтезироваться в надпочечниках и другие рецепторы — к лютеинизирующему гормону или β-адренергические.
Комплекс Карнея
– участки пигментации кожи;
– миксомы сердца, кожи или мукозные;
– чаще всего первичная пигментная узловая гиперплазия надпочечников (может быть как микро-, так и макроузловая), сопровождаемая гиперпродукцией глюкокортикоидов (синдром Иценко – Кушинга);
– СТГ/пролактин-секретирующая опухоль гипофиза, а также гиперплазия соматотрофов/пролактотрофов;
– аденома щитовидной железы;
– псаммоматозная меланотическая шваннома.
Синдром Мак-Кьюна – Олбрайта
Редкая болезнь (частота от 1:100 000 до 1:1000000), генетически обусловленная, но не наследственная, т. к. возникает вследствие постзиготной соматической мутации, что проявляется мозаицизмом. Возможна генетическая диагностика мутации, выявляемой в пораженных тканях или клетках крови.
Диагноз устанавливают, если присутствуют 2 из 3нижеперечисленных признаков.
– появление кист в костях нижних и верхних конечностей, таза, грудной клетки, с чем связаны самопроизвольные переломы с вовлечением нервных стволов и появлением на месте перелома очагов гипертрофии костей;
– чаще всего страдают бедренная кость и кости таза, и эту особенность можно использовать для скрининговой диагностики болезни;
– остеосаркома возникает редко;
– поражение костей проявляется обычно до 10-летнего возраста.
•Пигментация отдельных участков кожи:
– появляются бурые пятна на задней поверхности шеи, спине, в области поясницы и бедер величиной от маленькой родинки до больших пятен;
– контуры пигментации неровные, не пересекают средней линии тела;
– локализованы обычно на стороне поражения костей;
– степень пигментации часто соответствует величине поражения скелета.
– синдром Иценко – Кушинга (гиперплазия надпочечников или аденома);
– преждевременное половое созревание;
– узлы в щитовидной железе;
– СТГ-секретирующая опухоль гипофиза и пролактинома;
Кроме указанных выше диагностически значимых поражений, также возможны:
– кардиомегалия, тахиаритмия, внезапная кардиальная смерть;
– поражение гепатобилиарной системы;
– микроцефалия, задержка психического развития.
Субклинический синдром Иценко – Кушинга
Дать определение субклинического синдрома Иценко – Кушинга несложно: патологическое состояние, при котором, несмотря на повышенную секрецию кортизола, нет характерного (специфического) симптомокомплекса (стрии, центрипетальное ожирение, лунообразное лицо, плетора и др.). Однако это определение не годится для реальной практической работы клинициста-эндокринолога, т. к. оно неконструктивно, т. е. нет явных указаний, в каких клинических ситуациях следует использовать это понятие как диагноз. В связи с этим уточним определение. Сначала ответим на вопрос, который возникает в первую очередь: какие диагностические тесты и алгоритмы следует использовать для диагностики субклинического гиперкортицизма? Ответ: те же, что и для диагностики манифестного гиперкортицизма! При этом эти тесты обычно разбиваются на 2группы: скрининговые (предварительные) и верифицирующие (позволяющие с более высокой надежностью установить диагноз гиперкортизолизма, чем скрининговые).
К скрининговым (стартовым) диагностическим тестам чаще всего относят следующие:
– исследование кортизола в суточной моче (проводится двукратно для верификации гиперкортизолизма, если не сочетается с другим тестом);
– малый ночной (1 мг) дексаметазоновый тест (проводится однократно);
– кортизол слюны в полночь (проводится двукратно, если не сочетается с другим тестом);
В этом случае диагноз субклинического гиперкортизолизма сохраняется до тех пор, пока не будут получены результаты верифицирующих тестов. Если и с их помощью диагноз эндогенного гиперкортизолизма подтверждается, тогда диагноз субклинического синдрома Иценко – Кушинга считают доказанным.
В результате дополнительного обследования у части больных в этих тестах диагноз гиперкортизолизма может не подтвердиться, тогда диагноз субклинического гиперкортизолизма пересматривают, и скрининговые (стартовые) тесты интерпретируют с точки зрения неэндокринной патологии. К примеру, лабораторная ошибка, связанная с недостаточной надежностью скрининговых тестов, или наличие у больного депрессии, при которой секреция кортизола в дексаметазоновом тесте часто не подавляется, и т. п. Очевидно, что в этих случаях ранее поставленный предположительный диагноз субклинического гиперкортизолизма снимают.
Выше был представлен алгоритм обследования больного на субклинический гиперкортизолизм в клинической практике, где ключевым или стартовым поводом для обследования была выявленная инциденталома надпочечника.
Вместе с тем в научных исследованиях может быть поставлена задача выявления субклинического гиперкортицизма в других, кроме пациентов с инциденталомой, группах риска, например среди больных сахарным диабетом, который с высокой частотой сопровождает гиперкортизолизм. В этом случае именно сахарный диабет становится поводом для начала обследования на гиперкортизолизм, и точно так же, как в случае инциденталом, стартовый набор тестов, в котором дифференцируется истинный гиперкортизолизм от функционального, остается тем же. Следует заметить, что при таком подходе появляется возможность выявления не только АКТГ-независимого варианта субклинического синдрома Иценко – Кушинга, но и АКТГ-зависимого, т. е. спектр субклинических синдромов Иценко – Кушинга расширяется. Следовательно, в отличие от случая инциденталом, после подтверждения истинного гиперкортизолизма далее следует уточнять локализацию процесса путем визуализации надпочечников (синдром Иценко – Кушинга) и исследования АКТГ в крови (дифференциальная диагностика АКТГ-зависимого и АКТГ-независимого синдрома Иценко – Кушинга).
Дифференциальная диагностика синдрома Иценко – Кушинга
Первый этап диагностического поиска
Заключается в диагностировании эндогенного гиперкортизолизма. Однако следует заметить, что до сих пор общепринятого набора тестов для диагностики гипекортизолизма нет, и в разных клинических центрах он может существенно различаться. В таблице 2 приведены перечень тестов, которые используют для скрининга при подозрении на синдром Иценко – Кушинга, и их диагностическая значимость.
Второй этап диагностического поиска
К нему приступают после того, как диагностирован эндогенный гиперкортизолизм (синдром Иценко – Кушинга). Этот этап заключается в поиске причины гиперпродукции кортизола надпочечниками, а фактически в определении локализации патологического процесса, с которым связана гиперсекреция кортизола. С одной стороны, очевидно, что только надпочечник может продуцировать кортизол. С другой стороны, синтез кортизола надпочечниками управляется АКТГ, который может вырабатываться как в гипофизе, так и вне его (эктопически). В итоге получаем три точки возможной локализации: надпочечник (опухоль и/или гиперплазия), гипофиз (аденома) или эктопическая секреция опухолью (обычно легкие), что и составляет предмет дифференциальной диагностики второго этапа. Тесты для определения АКТГ-зависимого гиперкортизолизма представлены в таблице 3.
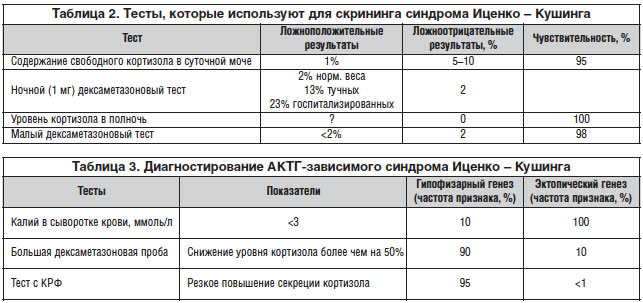
•У больных с подтвержденным на первом этапе диагностики синдромом Иценко – Кушинга определяют базальный уровень АКТГ в сыворотке крови, чтобы с помощью этого исследования дифференцировать АКТГ-зависимый синдром Иценко – Кушинга (уровень АКТГ повышен) от АКТГ-независимого (содержание АКТГ снижено). Уровень АКТГ >4 пмоль/л — показатель АКТГ-зависимого синдрома Иценко – Кушинга.
•По уровню АКТГ дифференцировать гипофизарную гиперсекрецию АКТГ от эктопической практически невозможно, хотя при эктопической секреции содержание АКТГ несколько выше.

Болезнь Иценко-Кушинга – редкое нейроэндокринное заболевание, обусловленное гормонпродуцирующей опухолью или гиперплазией гипофиза. В этом случае резко повышается концентрация адренокортикотропного гормона (АКТГ), посредством которого контролируется и регулируется деятельность надпочечников. В результате форсированной секреторной активности этих желез (а надпочечники, как известно, вырабатывают несколько групп ключевых гормонов) наступает выраженный гормональный дисбаланс, который самым серьезным образом дезорганизует работу всех основных систем организма.
Как и другие редкие заболевания, болезнь Иценко-Кушинга плохо поддается эпидемиологическому учету; оценки встречаемости в разных источниках расходятся в десятки раз. Можно предполагать, в среднем, что ежегодно в общей популяции заболевает один человек примерно из пятисот тысяч. Среди страдающих этим заболеванием от трех до восьми раз больше женщин, чем мужчин, причем преимущественная доля больных пребывает в наиболее активном возрасте – 20-45 лет.
2. Причины
Практически всегда (более 90% случаев) у пациентов с болезнью Иценко-Кушинга обнаруживается доброкачественная микроаденома или гормонпродуцирующая гиперплазия (разрастание ткани), реже злокачественная аденокарцинома.
Этиопатогенез такого рода процессов в гипофизе является объектом исследований и научных дискуссий, но единого мнения пока нет. Вероятно, факторы риска в основном совпадают с таковыми для других железистых нео- и гиперплазий.
Остальные, неонкологические случаи вторичного гиперкортицизма исследуются на предмет возможных причинно-следственных связей с черепно-мозговыми травмами, инфекционными воспалениями мозговых оболочек, интоксикациями и т.д. Преобладание лиц женского пола связывают с гормональными перестройками (особенно послеродовыми).
3. Симптомы и диагностика
Вторичный гиперкортицизм (болезнь Иценко-Кушинга) различают по трем условным степеням тяжести и по типу течения (быстро прогрессирующий, при котором характерные изменения развиваются в течение 0,5-1 года, и торпидный, развитие которого может ощутимо сказаться лишь через несколько лет от истинного начала процесса).
Как правило, выражены признаки вирилизации – в силу неадекватного состава половых гормонов, вырабатываемых надпочечниками, больной приобретает физиологические и внешние черты противоположного пола. У большинства пациентов обнаруживается прогрессирующая сердечнососудистая недостаточность, остеопороз, снижение иммунитета, вторичные заболевания почек и ЖКТ. Отдельную проблему составляет поражение ЦНС, причем часть нарушений (стволовых, мозжечковых, пирамидных) является необратимой. Могут серьезно страдать высшие психические функции: отмечаются невротические (неврастенические, ипохондрические), депрессивные (в т.ч. с апатическим и суицидальным компонентами), эпилептиформные расстройства, интеллектуально-мнестическое снижение.
Диагностика болезни Иценко-Кушинга требует тщательного многопланового обследования и дифференциации с рядом других нейроэндокринных расстройств. Необходим мультидисциплинарный подход (координированное участие эндокринолога, психоневролога, кардиолога и других профильных специалистов). Большое значение имеют многократные развернутые биохимические анализы крови. Из инструментальных методов для выявления опухолевых образований и остеопороза назначают рентгенографию, МРТ, КТ; характерная для вторичного гиперкортицизма двусторонняя гиперплазия надпочечников обнаруживается при УЗИ, томографии, сцинтиграфии.
4. Лечение
На ранних этапах болезни Иценко-Кушинга прибегают к консервативной терапии: назначаются препараты, угнетающие секреторную активность гипофиза и надпочечников; симптоматически корригируются нарушения метаболизма. В настоящее время получили распространение методы лучевой терапии, применяемые обычно при отсутствии доказательных признаков опухоли гипофиза – за несколько месяцев, как правило, удается добиться качественной ремиссии.
В более тяжелых случаях хирургически удаляются оба надпочечника (с последующей пожизненной заместительной терапией гормонами), либо же производится малоинвазивное удаление (или деструкция) гипофизарной неоплазии, однако в каждом пятом случае такая опухоль рецидивирует.
Хирургическое, лучевое и медикаментозное лечение составляют комбинированную терапевтическую стратегию.
При своевременной диагностике и начале лечения прогноз достаточно благоприятный (особенно для пациентов молодого возраста); продолжительное течение болезни Иценко-Кушинга оставляет ряд необратимых изменений в опорно-двигательном аппарате, сердечнососудистой и других системах организма, что во многих случаях приводит к тяжелой инвалидности, сокращению качества и продолжительности жизни. Наконец, в запущенных и нелеченных формах вторичный гиперкортицизм характеризуется высокой летальностью.
Заболевания ![частые заболевания]()
- Заболевания щитовидной железы (гипотериоз, йододефицитные заболевания, опухоли щитовидной железы, хронический аутоиммунный тиреоидит, тиреотоксикоз) и сахарный диабет 2 типа
- Заболевания надпочечников (недостаточность коры надпочечников, гормонально-активные образования, феохромоцитома, альдостерома, артериальная гипертензия эндокринного генеза)
- Гиперпролактинемия
- Заболевания паращитовидных желез (гипопаратиреоз, гиперпаратиреоз)
- Эндокринные заболевания репродуктивной системы (бесплодие, аменорея, поликистоз у женщин, возрастной андрогенный дефицит у мужчин, гипогонадизм, гинекомастия)
- Нейроэндокринные нарушения (остеопороз, аденома гипофиза, гипопитуитаризм)
Жалобы и симптомы ![Жалобы и симптомы]()
Если вы обнаружили у себя подобные симптомы, возможно, это сигнал заболевания, поэтому рекомендуем проконсультироваться с нашим специалистом.
Диагностика ![Диагностика]()
- Диагностика остеопороза
- УЗИ щитовидной железы
Наши цены ![Типичные жалобы]()
Мы стараемся оперативно обновлять данные по ценам, но, во избежание недоразумений, просьба уточнять цены в клинике.
Данный прайс-лист не является офертой. Медицинские услуги предоставляются на основании договора.

Задача кортикотропина состоит в регулировании функционирования надпочечников, поэтому его избыток приводит к повышенному размеру надпочечников. Увеличиваясь в размере, надпочечники также начинают выделять свои гормоны, которые называются кортикостероидами. Обычно появление данного заболевания связано с возникновением хромофобной или базофильной аденомы гипофиза, из которой выделяется адренокортикотропный гормон. Вместе с опухолью также обнаруживают аденокарциному, микроаденому и макроаденому. Существуют и такие случаи, при которых болезнь возникала вследствие перенесенных инфекций, воздействующих на центральную нервную систему. Помимо этого, болезнь может появиться из-за отравления организма ядовитыми веществами и перенесения черепно-мозговых травм.
Конкретно у женщин это заболевание может сопровождать гормональную перестройку, связанную с родами, климаксом и беременностью. Среди причин, приводящих к появление синдрома Иценко-Кушинга, также можно выделить патологию гипоталамо-гипофизарно-надпочечниковой системы – в результате понижения тормозного воздействия дофамина на выделение кортикотропина он начинает секретироваться в большем количестве, чем следует.
Из-за увеличенного уровня синтеза кортикотропина возникают различные надпочечниковые и вненадпочечниковые эффекты – внутри надпочечников повышается синтезирование андрогенов, глюкокортикоидов и в более сниженном количестве – минералокортикостероидов. Повышенное содержание глюкокортикоидов оказывает анаболическое воздействие на углеводный обмен, в результате чего атрофируются соединительная и мышечная ткань, образовывается повышенное содержание сахара и инсулинорезистентность, что в дальнейшем служит причиной возникновения стероидного сахарного диабета.
Вследствие расстройства липидного обмена начинается прогрессирование ожирения.
Симптомы болезни Иценко-Кушинга
Признаки, сопровождающие синдром Иценко Кушинга, бывают различными и являются результатом повышенного выделения кортикотропина, что влечет за собой поражение каждого органа и системы. Кроме того, нарушается липидный обмен.
Симптомы заболевания Иценко - Кушинга:
- Нарушенный режим сна, плохое настроение, психозы;
- Диспластическое ожирение, при котором жир отлаживается на животе, лице, в области плечевого пояса, над шейными позвонками и в надключичных пространствах;
- Вторичный иммунодефицит, включающий в себя долгое заживание ранений, трофические язвы голеней, постоянный пиелонефрит и тому подобное;
- Трофические изменения кожи, состоящие из сухости кожных покровов, легкому появления гематом и стрии в местах накопления липидов;
- Перемены в костной системе, которое у ребенка проявляется затормаживанием роста, а у взрослого – стероидным остеопорозом;
- Миопатия – атрофирование мышц передней брюшной стены и белково-энергетическая недостаточность поперечно-полосатых мышц концовок;
- Гипертоническая болезнь (возможно болезненное увеличение левого желудочка);
- Симптомы повторного гипогонадизма, среди которых имеются нарушение менструаций, бесплодие, понижение мужской потенции;
- Патологии углеводного обмена – прогрессирование инсулинрезистентного сахарного диабета либо нарушение толерантности к глюкозе;
- Женский гирсутизм.
Диагностика болезни Иценко Кушинга

Чтобы определить наличие этого заболевания, достаточно лишь взглянуть на внешность человека. Однако, вместе с тем, также необходимо установить уровень выраженности и первопричину прогрессирования этой болезни. Кроме того, следует учесть то, что бывают случаи, при которых аденому, секретирующую гормоны, невозможно обнаружить, из-за чего место, в котором она размещена, определяют с использованием гормональных тестов.
Диагностика болезни Иценко Кушинга заключается в обследованиях:
- Оценивание количества 17-кортикостероидов в моче;
- Проверка суточного количества выделений кортизола в моче;
- Установление точного количества кортизола в крови;
- Установление точной дневной и ночной дозы адренокортикотропного гормона.
- Также проводятся такие тестирования:
- Тестирование с кортиколиберином (основной гормон, занимающийся стимуляцией выделения кортизола) – при вводе данного гормона содержание кортизола в крови в случае наличия синдрома Иценко Кушинга должно составлять не менее 1,4 мкг;
- Тестирование с дексаметазоном (искусственный глюкокортикоид) – при вводе данного гормона ночью, наутро содержание кортизола в крови должно составлять не менее 1,8 мкг;
- Стандартное тестирование с дексазоном – при таком тесте дексазон выдают в низких дозах через каждые 6 часов на протяжении двух дней. При наличии синдрома Иценко Кушинга степень кортизола в крови должна быть низкой;
- Компьютерная томография грудной полости;
- Магниторезонансная томография гипофиза и надпочечников;
- Радиоизотопное обследование, с помощью которого наблюдают за поглощением употребляемого медикамента каждым надпочечником.
Для того, чтобы определить тяжесть болезни, устанавливают содержание калия, глюкозы и натрия в крови, а также применяют рентгенографию позвоночника.
Лечение болезни Иценко-Кушинга
При лечении болезни Иценко - Кушинга используют патогенетическую терапию, миссия которой заключается в восстановлении нарушенной работы гипофизарно-надпочечниковой системы.
Патогенетическая терапия разделяется на способы лечения:
- Лечение лекарственными препаратами – применяют лекарства, с помощью которых подавляется выделение кортикотропина гипофизом и функционирование коры надпочечников;
- Радиационная терапия – к ней относятся протонное облучение гипофиза и гамма-терапия (она может проводиться как независимый вариант лечения, так и в составе другого метода);
- Оперативное вмешательство – устранение кортикотропиномы гипофиза транссфеноидальным путем.
Прогноз и профилактика болезни Иценко-Кушинга
При поставновки диагноза учитывается возраст пациента, продолжительность и тяжесть болезни. В случае раннего обнаружения и лечения недуга можно добиться полноценного исцеления. Если же лечение не было произведено своевременно – это приведет к летальному исходу. Это связано с тем, что на поздней стадии в довесок добавляются различные септические осложнения и почечная недостаточность.
Больные, страдающие синдромом Иценко-Кушинга, обязаны обследоваться у эндокринологов, гинекологов-эндокринологов, неврологов и кардиологов. Также им противопоказаны большие физические и психологические нагрузки. Не рекомендуется работать ночью.
Читайте также:




