Берут ли в армию с коарктацией аорты
Обновлено: 04.07.2024
Коарктация аорты - врожденное сужение или полное закрытие ее просвета на ограниченном участке. Чаще всего (95 %) это сужение располагается в области перешейка аорты, под которым понимается отрезок от левой подключичной артерии до первой пары межреберных артерий. Возможны и другие локализации сужений - в восходящей, нисходящей грудной или брюшной аорте. Коарктация аорты составляет до 30 % всех врожденных пороков сердца.
Гемодинамическая сущность порока заключается в затруднении тока крови через суженный участок, в результате чего значительно возрастает артериальное давление в аорте и ее ветвях выше места сужения (до 200 мм рт. ст. и более) и понижается ниже него, т. е. развивается синдром артериальной гипертензии в сосудах головного мозга и верхней половины тела, что влечет за собой систолическую перегрузку левого желудочка, гипертрофию миокарда с последующей его дистрофией. Последняя усугубляется и присоединением со временем коронарной недостаточности. В итоге развивается тяжелая декомпенсация левого желудочка. Гипертензия в системе сосудов мозга приводит к появлению ряда церебральных симптомов. В артериальной системе ниже места сужения артериальное давление значительно снижено, и кровоснабжение нижней части тела осуществляется преимущественно за счет коллатерального кровообращения, которое не всегда бывает достаточным.
Клиническая картина и диагностика. Жалобы, как правило, отсутствуют. Лишь с достижением возраста половой зрелости могут появляться общая слабость, головокружение, головные боли, парестезии и повышенная зябкость ног. Диагностика заболевания весьма простая: знание этой патологии и внимательное обследование позволяют точно поставить диагноз в подавляющем большинстве случаев. Отсутствие пульсации на артериях ног при постоянном повышенном давлении в артериях верхних конечностей - почти патогномоничный признак коарктации аорты. При неполной окклюзии просвета аорты в области коарктации пульсация на артериях ног может сохраняться, но быть ослабленной, что подтверждается и сниженным артериальным давлением (у здорового человека артериальное давление на нижних конечностях на 20-40 мм рт. ст. выше, чем на верхних). При осмотре кроме соответствующей формы тела (нередко атлетический тип сложения у мужчин, пикнический - у женщин) можно заметить пульсацию расширенных межреберных артерий. Границы сердца, как правило, расширены влево за счет гипертрофии левого желудочка. При аускультации выслушивается систолический шум по всему левому краю грудины, а также со стороны спины над проекцией сужения аорты, а иногда и над расширенными, пульсирующими межреберными артериями. ЭКГ-данные у детей могут выявить лишь признаки систолической перегрузки левого желудочка, у взрослых - его гипертрофию и коронарную недостаточность, нередко с диффузными мышечными изменениями.
На рентгенограммах определяется преимущественно аортальная конфигурация сердца за счет расширения левого желудочка. Характерным признаком коарктации аорты является наличие узур нижнего края 3-4 пар ребер. Узурация ребер развивается вследствие деформации кости в области нижней бороздки резко расширенными и извитыми межреберными артериями. Как пульсация межреберных артерий, так и узурация ребер могут быть выявлены при пальпации грудной клетки больного. На томограмме, как правило, хорошо видно место сужения аорты. Ангиокардиография показана в неясных случаях или при подозрении на сочетание коарктации аорты с другими пороками. Наиболее частые из них - открытый артериальный проток и стеноз устья аорты. В более поздние сроки может развиваться недостаточность аортального клапана вследствие дистрофических изменений в основании восходящей аорты.
Средняя продолжительность жизни неоперированных больных 25-30 лет. Наиболее часто причиной смерти больных являются внутричерепные кровоизлияния, разрывы аорты, инфаркт миокарда, острая сердечная недостаточность и инфекционный эндокардит.
Дифференциальную диагностику коарктации аорты следует проводить с нейро-циркуляторной дистонией, гипертонической болезнью, вазоренальной гипертонией, пороками сердца и заболеваниями почек, сопровождающимися артериальной гипертензией. Наибольшее число ошибок в распознавании этого порока связано с забвением основных клинических проявлений заболевания, недооценкой общеврачебных методов исследования, пренебрежением к пальпации артериального русла, а также измерению артериального давления на ногах и сравнительной оценкой полученных данных.
Лечение только оперативное. Идеальным видом операции, особенно у растущих детей, является резекция суженного участка аорты с ее анастомозом конец в конец (рис. 18). Однако такая операция нередко невыполнима при выраженной протяженности сужения и тяжелых склеротических изменениях стенки сосуда. В подобной ситуации проводится протезирование аорты синтетическим протезом (рис. 19), а также пластика места сужения синтетической заплатой (рис. 20) или левой подключичной артерией (рис. 21). Ряду пациентов может быть предпринята баллонная дилатация коарктации в условиях рентгеноперационной.
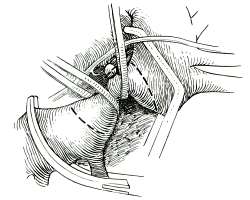 Рис. 18, а. Этап выделения участка коарктации аорты. | 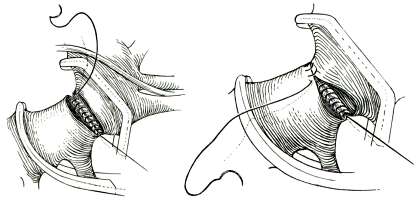 Рис. 18, б. Участок коарктации резецирован с наложением анастомоза конец-в-конец. |
 | Рис. 19. Этапы протезирования аорты при ее коарктации. |
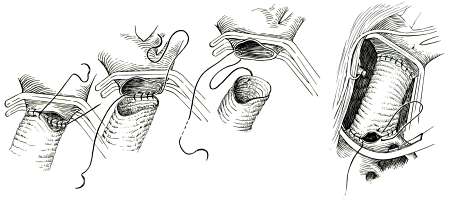
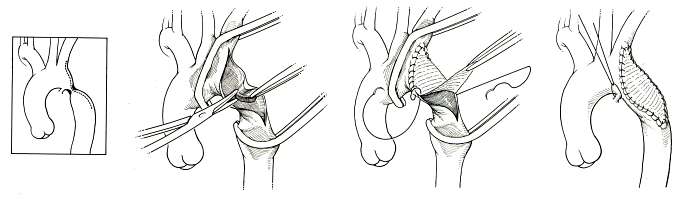 Рис. 20. Этапы пластики коарктации аорты ромбовидной заплатой из синтетического материала. |
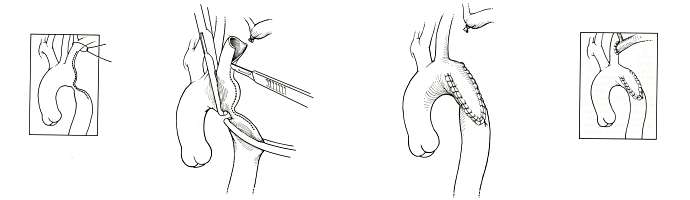 Рис. 21. Этапы пластики коарктации аорты левой подключичной артерией (операция Вальдхаузена). |
Результаты оперативного лечения определяются в значительной степени возрастом больного. Наилучшими они оказываются у детей, оперированных в возрасте до 3 лет, когда нет тяжелых изменений стенки аорты и межреберных артерий и имеются более благоприятные условия для радикальной коррекции порока, устранение которого обычно приводит к нормализации общего артериального давления. Операция у взрослых значительно сложнее в техническом отношении и, как правило, дает значительно менее выраженный гипотензивный эффект, так так в генезе артериальной гипертонии значительную роль играют изменения в центральной регуляции сосудистого тонуса и почечные механизмы формирования гипертонии. Однако после устранения коарктации артериальная гипертония становится более управляемой медикаментозными средствами, что позволяет предупредить развитие перечисленных выше тяжелых осложнений, так как через 1,5-3 года после коррекции порока артериальная гипертония становится менее выраженной. Таким образом, оперативное лечение коарктации аорты у взрослых в комплексе с антигипертензивной медикаментозной терапией в послеоперационном периоде позволяет значительно продлить и жизнь больных, и улучшить ее качество.
-
— круглосуточно. — понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 18:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.

Что такое коарктация аорты?
Аорта – это самый большой и длинный сосуд в нашем организме. Отходит аорта от левого желудочка, который под высоким давлением нагнетает в нее кровь насыщенную кислородом, доставляя кислород до всех органов и тканей нашего тела. Аорта последовательно отдает свои ветви голове, рукам, внутренним органам, ногам. Сужение аорты в средней ее части называется коарктацией (Рис 1). Это сужение может быть разной степени выраженности и разной протяженности. При этом верхняя половина нашего тела получает кровь в избытке под высоким давлением, нижняя же половина страдает от недостатка крови, в ней отсутствует пульсация. Отсутствие пульса на ногах является одним из главных диагностических критериев коарктации аорты.
Естественное течение порока. Или к чему приведет коарктация аорты?
Высокое давление в верхней половине тела приводит к развитию ряда проблем. Почти все пациенты с коарктацией аорты страдают от высокого артериального давления. Иногда пациенты всю жизнь борятся с гипертонической болезнью, не зная о наличии у них коарктации аорты. У некоторых пациентов, артериальное давление в покое может быть нормальным и резко повышаться при физической нагрузке. Высокое давление в сосудах носа приводит к частым носовым кровотечениям. Высокое давление в сосудах головного мозга приводит к их разрыву и развитию жизнеугрожающего геморрагического инсульта. Высокое давление в самой аорте выше места ее сужения приводит к ее расширению и истончению ее стенок. Эта патология называется аневризмой аорты. Аневризмы аорты быстро растут и склонны спонтанно разрываться. Разрыв аневризмы аорты – это фатальное осложнение, которое в 95% случаев приводит к незамедлительной смерти. Также у пациентов с коарктацией аорты раньше развивается ишемическая болезнь сердца. Поэтому всем пациентам с диагностированной коарктацией аорты необходимо максимально ранее лечение, тщательный контроль артериального давления и мониторинг размера аорты.
Степень выраженности симптомов зависит от степени сужения. Таким образом. Если сужение сильно выраженное, коарктация аорты может себя проявить в первые дни или недели жизни. Дело в том, что маленькому новорожденному сердечку приходится нагнетать кровь против выраженного сопротивления. Работая в подобном режиме сверхнагрузки, сердце устает со временем и начинает плохо сокращаться. Симптомами такой выраженной коарктации будут частое дыхание, частое сердцебиение, отказ малыша от пищи и дефицит массы тела. У некоторых маленьких пациентов может быть шок из-за плохой сократимости сердца, и лечение их порока начнется с отделения интенсивной терапии.
Лечение коарктации аорты.
На сегодняшний день существует два способа лечения коарктации аорты: эндоваскулярный способ и хирургическая операция, предусматривающая иссечение узкого участка и восстановление проходимости аорты путем сшивания ее двух концов. Выбор метода лечения зависит от степени сужения, протяженности и точной локализации сужения, а также от общего состояния и возраста пациента. На сегодняшний день хирургическое лечение предпочтительнее у детей до одного года, а эндоваскулярное – у детей после 5 лет (или по достижению ими веса 16 кг) и взрослых. Метод лечения детей от года до пяти определяется в зависимости от конкретного случая.
Процедура эндоваскулярного лечения.
Рис 2 – Баллон (вверху в сложенном состоянии, внизу - в раздутом)
Рис 3 – Схема стентирования аорты
Необходимо все же отметить, что в большинстве случаев лечение коарктации аорты начинается в рентген-операционной. Эндоваскулярное лечение коарктации аорты подразумевает баллонную ангиопластику со стентированием или без стентирования аорты.
Через тоненький прокол артерии на бедре в аорту вводится контрастное вещество, которое под рентгеном помогает визуализировать место сужение, определить его степень и протяженность. Затем в бедренную артерию вводится тоненькая трубочка (катетер), на конце которой в сложенном состоянии находится небольшой баллончик (рис 2). Под контролем рентгена баллонный катетер продвигают к месту сужения. Следующим этапом эндоваскулярный хирург раздувает баллон, растягивая, таким образом, аорту. Баллон сдувается, и катетер извлекается из бедра пациента.
У некоторых пациентов аорта не податлива простой баллонной ангиопластике. В таких случаях применима процедура стентирования аорты (Рис 3). Стент представляет собой металлическое плетение в виде трубочки. Иногда он покрыт тонкой пленкой для предотвращения повреждения стенки сосуда. Такой стент называется стент-графтом (Рис 4, 5) В сложенном состоянии стент располагают поверх баллонного катетера (Рис 6).
Рис 4 – Обычный стент в сложенном состоянии (справа) и раздутый стент-графт (слева)
Рис 5 – Сложенный стент-графт
Рис 6 – Стент-графт, смонтированный поверх баллона
Длится эндоваскулярное вмешательство около двух часов. После операции первые сутки наши пациенты наблюдаются в отделении интенсивной терапии, так как необходим тщательный контроль артериального давления.
Реабилитация после процедуры
Как правило, пациентов выписывают через два дня после процедуры. На месте введения катетера в сосуд еще некоторое время должна оставаться стерильная повязка. В течение 6 месяцев после операции необходимо проводить антибиотикопрофилактику инфекционного эндокардита в случае инфекционных или простудных заболеваний. В течение одного месяца после процедуры необходимо будет ограничить физические нагрузки. Через месяц после устранения коарктации аорты пациенты могут вести привычный образ жизни. Однако пациентам с коарктацией аорты, даже после ее устранения, противопоказано заниматься профессиональным спортом. Пациенты, перенесшие лечение коарктации аорты независимо от метода, должны регулярно проверяться с помощью ЭхоКГ, КТ, МРТ.
У 25% взрослых пациентов, даже после устранения коарктации аорты, артериальное давление остается незначительно повышенным. Из этого следует, что всем пациентам после устранения коарктации аорты необходим тщательный мониторинг артериального давления.
В течение 6 месяцев после процедуры пациентам стоит воздержаться от плановой вакцинации и планирования беременности.
Мы первые в Украине в 2008 году провели стентирование коарктации аорты, и на сегодня у нас наибольший опыт по стентированию – более 100 успешных вмешательств! Опыт же баллонных дилятаций насчитывает сотни случаев. Мы имеем доступ ко всем размерам и типам баллон-катетеров, стентов и стент-графтов для лечения любого типа сужения аорты. Для того чтобы попасть к нам на консультацию или госпитализироваться позвоните по одному из телефонов или запишитесь на прием онлайн.
Видео 1 - На этом красочном видеоролике Вы можете увидеть как происходит процесс стентирования коарктации аорты.
ГУЗ Краевая клиническая больница №1 им. проф. С.В. Очаповского Департамента здравоохранения Краснодарского края
Краевая клиническая больница №1 им. проф. С.В. Очаповского; Центр грудной хирургии, Краснодар
Краевая клиническая больница №1 им. проф. С.В. Очаповского; Центр грудной хирургии, Краснодар
Краевая клиническая больница №1 им. проф. С.В. Очаповского; Центр грудной хирургии, Краснодар
Коарктация аорты у новорожденных
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2010;(10): 89-94
Борисков М. В., Петшаковский П. Ю., Серова Т. В., Карахалис Н. Б. Коарктация аорты у новорожденных. Хирургия. Журнал им. Н.И. Пирогова. 2010;(10):89-94.
Boriskov M V, Petshakovskiĭ P Iu, Serova T V, Karakhalis N B. Aortic coarctation in newborn. Khirurgiya. 2010;(10):89-94.
ГУЗ Краевая клиническая больница №1 им. проф. С.В. Очаповского Департамента здравоохранения Краснодарского края





ГУЗ Краевая клиническая больница №1 им. проф. С.В. Очаповского Департамента здравоохранения Краснодарского края
Краевая клиническая больница №1 им. проф. С.В. Очаповского; Центр грудной хирургии, Краснодар
Краевая клиническая больница №1 им. проф. С.В. Очаповского; Центр грудной хирургии, Краснодар
Краевая клиническая больница №1 им. проф. С.В. Очаповского; Центр грудной хирургии, Краснодар
Коарктация аорты (КоАо) - врожденное сужение аорты, чаще всего расположенное тотчас дистальнее левой подключичной артерии рядом с артериальным протоком (артериальной связкой). Распространенность коарктации 0,2-0,6 на 1000 родившихся живыми, частота составляет 5-8% среди всех ВПС [1, 2]. Эта аномалия часто сочетается с другими пороками сердца: открытым артериальным протоком, двустворчатым аортальным клапаном, дефектом межжелудочковой перегородки (ДМЖП), аномалией митрального клапана как компонентом синдрома Шона и др. [3].
Эмбриология
Существуют две независимые эмбриологические теории, объясняющие возникновение коарктации аорты: теория потока и теория дуктальной петли. Теория потока основана на гипотезе, что поток крови через сердечные камеры и магистральные сосуды в эмбриональном периоде часто определяет их размер к рождению [7]. При увеличении кровотока через правые отделы вследствие интракардиального шунта (ДМЖП) соответственно уменьшается поток крови через левые отделы и, следовательно, через перешеек. Аналогично при обструкции левых отделов (например, митральном или аортальном стенозе) снижается кровоток в восходящей аорте и перешейке. Таким образом, данная теория основывается на сниженном потоке через перешеек во внутриутробном периоде. Внутрисердечные дефекты, которые могут стать причиной коарктации по теории потока, клинически обычно ассоциируются у пациентов с коарктацией. Эти пороки включают ДМЖП, двустворчатый клапан аорты, врожденный стеноз аорты или митрального клапана [3]. P. Venugopalan и соавт. [8] в своих исследованиях доказали, что при коарктации аорты размер митрального клапана значительно меньше, чем в контрольной группе. Незначительные гемодинамические нарушения в эмбриональной циркуляции приводят к уменьшению потока через дугу аорты [9]. Роль лимба овального окна - это отклонение соответствующей порции крови от нижней полой вены в восходящую аорту. Раннее сужение овального окна или неправильный угол лимба может привести к различной степени гипоплазии левых структур сердца. Этим можно объяснить развитие синдрома Шона [10]. Подтверждением данной теории является тот факт, что при пороках с уменьшением кровотока через правые отделы (тетрада Фалло, легочный стеноз, трикуспидальная атрезия) почти никогда не встречается коарктация аорты [7].
Другие исследователи выдвигают альтернативные идеи, которые также могут объяснять возникновение коарктации. A. Kappetein и соавт. [13] полагают, что в патогенезе коарктации аорты играет роль аномалия развития нейрального гребня. Не исключаются генетические факторы с учетом частой встречаемости коарктации у женщин с синдромом Тернера [14].
Патофизиология
Пациенты с коарктацией аорты делятся на две группы. Первая группа - это новорожденные с ювенильной коарктацией, у которых кровоснабжение нижней половины туловища зависит от открытого артериального протока (ОАП). Если заболевание вовремя не диагностировано (т.е. до закрытия протока), то у них развивается кардиогенный шок. В младенчестве коллатерали не развиты, и ишемия органов ниже места коарктации после закрытия ОАП приводит к развитию почечной недостаточности и ацидозу. Одновременно увеличенная постнагрузка на левый желудочек становится причиной острой застойной сердечной недостаточности. Дооперационное ведение таких пациентов облегчилось после начала применения простагландина Е1 (ПГЕ1), который открывает и удерживает в открытом состоянии артериальный проток. Инфузию простагландина впервые (1975 г.) стали успешно применять при лечении младенцев с критическими синими пороками (атрезия легочной артерии, транспозиция магистральных артерий) и позже (1979 г.) стали использовать у новорожденных с прерванной дугой аорты и ювенильной коарктацией [17]. Применение простагландина в сочетании с ИВЛ, инотропной поддержкой, введением бикарбоната улучшает сердечный выброс, купирует метаболический ацидоз и почечную недостаточность. Хирургическую коррекцию необходимо выполнять после стабилизации состояния пациента.
Диагностика
Диагностика коарктации у новорожденных остается значимой проблемой. Пренатально заподозрить порок практически невозможно. Трудность представляет своевременное установление точного диагноза и после рождения. При ювенильной коарктации широкий артериальный проток обеспечивает адекватный кровоток в нисходящую аорту - у таких пациентов на бедренных артериях будут определяться отчетливая пульсация и равное давление на руках и ногах, а по ЭхоКС в абдоминальной аорте регистрироваться магистральный кровоток. При сочетании с ДМЖП не будет разницы данных пульсоксиметрии между руками и ногами. При закрытии артериального протока стремительно развивается клиническая картина заболевания: кардиогенный шок, полиорганная недостаточность.
В последние годы инвазивное исследование применяется крайне редко, однако если имеются сложные сопутствующие внутрисердечные аномалии, то после стабилизации cостояния пациента выполняется зондирование. Во время исследования оценивают органические изменения сосудов, гемодинамические параметры и внутрисердечную анатомию [9].
Показания к оперативному вмешательству и выбор его времени
Методы коррекции
Первая успешная коррекция коарктации была выполнена C. Crafoord и G. Nylin в Швеции в 1944 г. [20]. Резекция коарктации у младенца была ocyщecтвлeнa W. Mustard и соавт. в 1953 г. [21]. Их методика заключалась в создании прямого циркулярного анастомоза (рис. 2). Рисунок 2. Простой циркулярный анастомоз конец в конец (схема). Начало в хирургическом лечении было положено, однако отдаленные результаты были неутешительными вследствие высокой частоты рецидива. Дальнейший путь развития хирургии в этой области сводился к разработке и усовершенствованию новых технологий анастомозирования, а именно к исключению циркулярного анастомоза и полному устранению патологической дуктальной ткани. В 1961 г. T. von Rueden и соавт. [22] предложили процедуру истмопластики по типу аортопластики синтетической заплатой с целью избежать формирования циркулярного анастомоза. J. Waldhusen и D. Nahrwold в 1966 г. [23] предложили оригинальную аортопластику лоскутом левой подключичной артерии (рис. 3). Рисунок 3. Истмопластика лоскутом подключичной артерии (схема). Эта процедура устранила циркулярный анастомоз, но была не в состоянии устранить патологическую дуктальную ткань [24].

В 1977 г. J. Amato и соавт. [25] предложили резекцию коарктации с формированием расширенного анастомоза (рис. 4), Рисунок 4. Резекция коарктации с формированием расширенного анастомоза конец в конец. в 1987 г. M. Elliott [26] усовершенствовал этот анастомоз для пациентов с гипоплазией дуги, назвав его радикально расширенным. Другие инновационные методы, которые были описаны M. Meier и соавт. [27] и J. De Mendonca и соавт. [28], включают пластику подключичным лоскутом с сохранением левой подключичной артерии, а также с использованием реверсивного подключичного лоскута [29].
Сочетание коарктации с другими аномалиями
До сих пор ведутся споры об этапности коррекции коарктации в сочетании с внутрисердечными аномалиями. Фактически последние исследования, сравнивающие оба подхода, демонстрируют преимущество одностадийного хирургического лечения (при условии, что коррекция бивентрикулярная) [30]. Недавно M. Kobayashi и соавт. [31] представили 10-летний опыт лечения 90 новорожденных с обструкцией дуги аорты и сопутствующими аномалиями. Общая летальность составила 4,4-7,8% в разных группах, выживаемость в течение 10 лет - 87%. На сегодняшний день показаниями к лечению в несколько этапов являются масса младенца менее 1500 г, тяжелая инфекция, внутричерепное кровоизлияние, полиорганная недостаточность и очень неблагоприятное анатомическое строение [32].
Коарктация в сочетании с гипоплазией дуги
У новорожденных с коарктацией аорты от 65 до 81% встречается гипоплазия дуги аорты [30, 33]. Чаще гипоплазия присутствует при сочетании коарктации с шунтовыми пороками или недоразвитием левосердечных структур, что подтверждает теорию потока в развитии коарктации [7].
Существуют различные мнения по поводу роста гипоплазированной дуги после коррекции. Некоторые авторы полагают, что дуга будет развиваться после простой резекции коарктации с формированием циркулярного анастомоза конец в конец [35], частота рекоарктации в их исследовании составляет 12,5%. Однако имеются данные о 81% рекоарктации у пациентов с гипоплазией дуги после создания циркулярного анастомоза [36]. Такие данные вызывают сомнения относительно развития дуги в послеоперационном периоде, поэтому предложены методики, устраняющие гипоплазию дуги при отсутствии надежды на ее последующее развитие: радикально расширенный анастомоз конец в конец [26], пластика реверсивным лоскутом подключичной артерии [29]. Некоторые авторы также склонны полагать, что лучшие отдаленные результаты достигаются при реконструкции дуги в условиях искусственного кровообращения при остановке кровообращения [37].
Коарктации аорты и гипоплазия левосердечных структур
Коарктация аорты часто сочетается с недоразвитием различных структур левого сердца, включая митральный и аортальный клапаны [38]. Когда эти структуры гипоплазированы и находятся на грани поддержания системного кровотока, трудно определить оптимальную стратегию дальнейшего лечения. Если левый желудочек слишком мал для поддержания системного кровообращения, следует идти по пути унивентрикулярной коррекции или трансплантации, исключая возможность двужелудочковой коррекции. Несколько исследований показали, что бивентрикулярная коррекция возможна при отклонениях митрального и аортального клапанов более -2Z. Однако эти исследования сосредоточились на раннем выживании [39, 40]. Исследование
M. Puchalski и соавт. [41] показало, что после коррекции KoAo у новорожденных в сочетании с гипоплазией левосердечных структур в динамике отмечаются развитие структур левого сердца, а также блестящий клинический результат. Несмотря на изначальную аннулярную гипоплазию, потребность в интервенционном вмешательстве по поводу митрального или аортального/субаортального стеноза редка.
Коарктация аорты у новорожденных массой менее 2 кг
Недоношенность и малая масса младенцев с коарктацией не являются противопоказаниями к оперативному лечению. Существует мнение, что у таких пациентов высок риск летального исхода и развития рекоарктации [47]. Ранее сообщалось о высокой частоте госпитальной летальности (до 20%) при малой массе детей с КоАо [30]. Однако прогресс в интенсивной терапии, совершенствование хирургической техники определяют неплохие результаты в последнее время. E. Bacha и соавт. [48] представили результаты лечения 18 пациентов массой менее 2 кг с критической коарктацией. Госпитальная летальность составила 5,5%. Анализ результатов лечения коарктации у таких пациентов показал отсутствие корреляции между развитием рекоарктации и массой пациента на момент операции. По мнению многих авторитетных специалистов, в развитии рекоарктации существенную роль играет остаточная дуктальная ткань [49].
Рекоарктация
Интервенционная терапия
Роль баллонной дилатации ограничена узким спектром заболеваний этой области: рекоарктация, коарктация в виде мембраны у младенцев, находящихся в критическом состоянии, коарктационный синдром, который у новорожденных не встречается.
Неинвазивный манометрический градиент между руками и ногами более 20 мм рт.ст. считается рекоарктацией и является показанием к повторному вмешательству. Анализ статей, представляющих результаты коррекции коарктации у новорожденных, при возникновении рекоарктации свидетельствует об успешном применении баллонной дилатации без летальных исходов и осложнений [46, 50].
Таким образом, несмотря на значимый накопленный мировой опыт по данной проблеме, остается ряд дискутабельных вопросов: оптимальный метод коррекции, особенно в сочетании с гипоплазией дуги аорты; проблема рекоарктации и пути ее устранения - баллонная дилатация или повторное хирургическое вмешательство. До сих пор нет единого мнения о преимуществе одно- или двухэтапной коррекции при сочетании коарктации с другими внутрисердечными аномалиями. Детские кардиохирурги, как правило, не меняют стереотипов при условии неплохих собственных результатов лечения. Ответ на эти вопросы возможен после мультицентрового анализа накопленных отдаленных результатов при использовании различных подходов к решению этих проблем.
В работе представлено описание клинического случая двустворчатого аортального клапана у мужчины средних лет. Врожденный порок сердца долгое время оставался бессимптомным.
Ключевые слова
Статья
Введение
Двустворчатый аортальный клапан является наиболее распространенным врожденным пороком сердца. Долго оставаясь бессимптомным, он со временем может осложниться развитием аортального стеноза или аортальной недостаточности. Двустворчатый аортальный клапан также ассоциируется с аневризмой аорты и ее расслоением. Учитывая высокую распространенность данного порока и серьезность осложнений, считается, что он является причиной большего количества смертей, чем все остальные врожденные пороки сердца вместе взятые [1].
Введение
Двустворчатый аортальный клапан является наиболее распространенным врожденным пороком сердца. Долго оставаясь бессимптомным, он со временем может осложниться развитием аортального стеноза или аортальной недостаточности. Двустворчатый аортальный клапан также ассоциируется с аневризмой аорты и ее расслоением. Учитывая высокую распространенность данного порока и серьезность осложнений, считается, что он является причиной большего количества смертей, чем все остальные врожденные пороки сердца вместе взятые [1].
Введение
Двустворчатый аортальный клапан является наиболее распространенным врожденным пороком сердца. Долго оставаясь бессимптомным, он со временем может осложниться развитием аортального стеноза или аортальной недостаточности. Двустворчатый аортальный клапан также ассоциируется с аневризмой аорты и ее расслоением. Учитывая высокую распространенность данного порока и серьезность осложнений, считается, что он является причиной большего количества смертей, чем все остальные врожденные пороки сердца вместе взятые [1].
Клинический случай
Больной А. 51 года поступил 04 марта 2019 г. с жалобами на одышку с затрудненным вдохом и выдохом при подъёме на 4 этаж; головокружение при переходе в вертикальное положение тела; приступы учащенного сердцебиения, возникающие в положении лёжа, длящиеся несколько секунд, купирующиеся самостоятельно.
Считает себя больным в течение полутора лет (с возраста 49 лет), когда впервые стало беспокоить головокружение. С марта 2018 г. при физической нагрузке возникает одышка. В течение полугода неоднократно фиксировалось повышение артериального давления до 140 и 90 мм. рт. ст. С сентября 2018 г. эпизодически в покое возникают приступы учащенного сердцебиения. При обследовании в поликлинике по месту жительства выявлен врожденный порок сердца: двустворчатый аортальный клапан. Направлен в кардиологический стационар.
Из анамнеза жизни известно, что пациент служил в армии, хорошо справлялся с физическими нагрузками, на данный момент работает слесарем на заводе, ранее курил. В детстве были частые ангины. Из перенесенных операций отмечает тонзилэктомию в возрасте 12 лет.
При осмотре обращало на себя внимание астеническое телосложение. При пальпации высокий, усиленный, резистентный, куполообразный верхушечный толчок определялся в 5 межреберье на 1 см кнаружи от левой среднеключичной линии. При перкуссии левая граница относительной сердечной тупости была смещена влево, совпадала с верхушечным толчком. При аускультации тоны сердца были ритмичными, частота сердечных сокращений 72 в минуту. На верхушке первый тон был немного ослаблен, но громче второго тона. Над аортой второй тон был ослаблен, выслушивался грубый систолический шум, проводящийся на сосуды шеи и всю прекардиальную область. Артериальное давление составляло 140 и 80 мм рт ст. Пульс лучевой артерии был одинаковым на обеих руках, ритмичным с частотой 72 в минуту.
Изменений в общем и биохимическом анализах крови от 05.03.2019 выявлено не было.
При электрокардиографии от 4 марта 2019 года (рис. 1) регистрировался синусовый ритм с частотой 72 в минуту. Электрическая ось сердца располагалась горизонтально. Определялись признаки увеличения левого предсердия.
На рентгенограммах органов грудной клетки с контрастированным пищеводом от 5 марта 2019 года (рис. 2) выявлялись признаки расширения восходящего отдела аорты, незначительного увеличения левого желудочка, правосторонний сколиоз грудного отдела позвоночника.
При эхокардиографии от 5 марта 2019 года (рис. 3) визуализировался двустворчатый аортальный клапан, множественные кальцинаты в основании и дистальных частях створок. Выявлялась аортальная регургитация небольшая; аортальный стеноз, степень обструкции тяжелая, максимальный градиент 79 мм рт ст, средний градиент 46-50 мм рт ст, незначительное расширение корня аорты (диаметр 4,2 см). Отмечалось выраженное расширение восходящей части аорты (диаметр 4,6-4,8 см), незначительная легочная гипертензия: систолическое давление легочной артерии 36 мм рт ст. Определялась небольшая гипертрофия левого желудочка: индекс массы миокарда 107 г/м², небольшое увеличение левого предсердия (конечный систолический объем 74 мл). Фракция выброса левого желудочка составляла 66 %. Регистрировался псевдонормальный тип трансмитрального кровотока.
При коронарографии от 06 марта 2019 г. выявлен стеноз правой коронарной артерии во втором сегменте до 80%.
Пациенту был установлен диагноз:
Врожденный порок сердца: двустворчатый аортальный клапан. Комбинированный аортальный порок: аортальный стеноз III-IV степени. Аортальная недостаточность I степени. Артериальная гипертензия III стадии риск 4.
Осложнения: Хроническая сердечная недостаточность II а стадии, функциональный класс 2.
Было назначено лечение: ацекардол 100 мг 1 раз в день вечером, козаар 50 мг 1 раз в день утром, бисопрол 2,5 мг 1 раз в день вечером.
Консилиумом кардиохирургов пациенту было рекомендовано протезирование аортального клапана.
Частота встречаемости двустворчатого аортального клапана составляет от 0,6% до 2% [1]. У мужчин заболевание встречается в 3 раза чаще, чем у женщин.
Частота выявления патологии у родственников больного первой степени родства составляет 9% [2]. В последние годы взгляды на эту патологию существенно изменились, и сегодня, говоря о данном пороке, подразумевают валвуло- и аортопатию наследственного генеза, обусловленную молекулярными и гистологическими изменениями соединительной ткани [3]. Генетические механизмы, приводящие к формированию двустворчатого аортального клапана, изучены недостаточно. В настоящее время NOTCH1 остается единственным подтвержденным геном-кандидатом, наличие мутации в котором ассоциируется как с семейными, так и со спорадическими случаями двустворчатого аортального клапана с сопутствующей аневризмой грудной аорты [4].
Клиническая картина у пациентов с двустворчатым аортальным клапаном может варьировать от выраженных проявлений нарушения функций клапана в младенческом возрасте до полного их отсутствия у пожилых людей [1]. При наличии аортального стеноза или аортальной недостаточности больных беспокоят головные боли, обмороки, головокружение как у нашего пациента. Клинические проявления могут быть также обусловлены расширением восходящей части аорты (аортопатия), коарктацией аорты, развитием инфекционного эндокардита [2].
Обнаружить признаки двустворчатого аортального клапана можно при аускультации. У больных с нормально функционирующим двустворчатым аортальным клапаном выслушивается систолический шум изгнания на верхушке сердца и в проекции аорты. У детей преимущественно 7-11 лет могут определяться аортальные систолические щелчки во 2 межреберье справа от грудины [5]. При аортальной регургитации слышен диастолический шум над аортой и в точке Боткина, а при наличии аортального стеноза (как у нашего больного) грубый систолический шум над аортой, проводящийся на сосуды шеи.
Электрокардиограмма обычно нормальна, однако могут быть признаки гипертрофии левого желудочка. Оплотом диагностики является эхокардиография [6].
В настоящее время у детей с двустворчатым аортальным клапаном при его стенозе могут выполняться следующие виды оперативных вмешательств: баллонная вальвулопластика, протезирование клапана механическими и биологическими протезами, операция Росса и реконструктивно-пластические операции на аортальном клапане [7].
По данным Петрушенко Д. Ю. и соавторов удовлетворительные результаты лечения критического аортального стеноза у новорожденных и детей первых месяцев жизни были представлены как при выполнении баллонной вальвулопластики, так и открытой реконструктивно-пластической операции на клапане. Обе процедуры паллиативные: рано или поздно пациент будет вновь нуждаться в хирургическом лечении, так как после баллонной валвулопластики развивается недостаточность клапана, а после открытой пластики имеется риск развития рестеноза [7]. Протезирование аортального клапана проводится у детей и подростков, у которых выполненная ранее баллонная валвулопластика привела к аортальной недостаточности. Операция выполняется в период, когда завершается рост аорты [5]. Хирургическое лечение двухстворчатого аортального порока сердца у взрослых в тактическом плане особых дискуссий не вызывает: в отличие от детей, вопрос о тактике и методике операции решается значительно проще — абсолютное большинство пациентов нуждается в протезировании аортального клапана [3]. Пациенты с большими размерами аорты имеют существенный риск смертности в течение 5 лет вследствие ее расслоения или разрыва, особенно когда диаметр аорты достигает 6 см [8]. При двустворчатом аортальном клапане хирургическое вмешательство на восходящей аорте показано в случае: расширения корня или восходящей аорты >55 мм; расширения корня или восходящей аорты >50 мм и наличии других факторов риска; расширения корня или восходящей аорты >45 мм при планируемой операции протезирования аортального клапана. При плановом протезировании восходящей аорты (в том числе корня аорты) хирургическая летальность колеблется от 1,6-4,8% [9].
Известно, что у больных с синдромом Марфана β-блокаторы и/или лозартан могут замедлять дилатацию корня аорты и снижать риск аортальных осложнений. По аналогии, общепринятой клинической практикой является рекомендовать эти препараты пациентам с двустворчатым аортальным клапаном и расширением корня или восходящего отдела аорты [10]. Поэтому нашему больному назначен бисопролол и козаар.
При наличии двустворчатого аортального клапана, как и при других пороках сердца при выполнении инвазивных медицинских вмешательств, сопровождающихся бактериемией, необходимо назначение антибиотиков для предупреждения инфекционного эндокардита.
Прогноз при двустворчатом аортальном клапане в целом благоприятный. Однако более половины всех пациентов в мире, которым требуется протезирование аортального клапана – это пациенты с данным пороком сердца [5]. По данным Пелех Д. М., проанализировавшего исходы хирургического лечения больных аортальным стенозом, в том числе у больных с бикуспидальной вальвулопатией, протезирование аортального клапана приводит к хорошим непосредственным и отдаленным результатам: уменьшению размеров левых камер сердца, снижению выраженности гипертрофии миокарда, улучшению сократимости миокарда левого желудочка и, следовательно, самочувствия больных. Большинство пациентов переходит в 1 – 2 функциональный класс по NYHA. После операции возможно развитие острых нарушений мозгового кровообращения, тромбоза протеза, инфекционного эндокардита. Летальность в раннем послеоперационном периоде составляет от 9,3 до 12,3 % [11].
Заключение
Двустворчатый аортальный клапан это распространенный порок сердца, наличие которого предрасполагает к возникновению тяжелых осложнений. Заболевание может долго клинически не проявляться. Для предотвращения развития осложнений необходимо своевременное выявление данного порока сердца, тщательное наблюдение за больным для своевременного определения показаний к оперативному лечению.
Литература
1. Siu S. C., Silversides C. K. Bicuspid aortic valve disease // Journal of the American College of Cardiology. 2009. Vol. 55, № 25. P. 2789–2800
2. Bicuspid aortic valve syndrome: a multidisciplinary approach for a complex entity / Martin M.[et al.] // Journal of Thoracic Disease (Aortic Diseases). 2017. Vol. 9. № 6. P. 454–464
3. Дземешкевич С. Л., Иванов В. А. Двухстворчатый аортальный клапан (эволюция взглядов на особый тип вальвулопатии) // Российский кардиологический журнал. 2014. № 5 (109). С. 49–54
4. Трисветова Е. Л. Двустворчатый аортальный клапан и аортопатии // Международные обзоры: клиническая практика и здоровье. 2015. № 3. С. 38–49
5. Врожденный двустворчатый аортальный клапан у детей / Ю. М. Белозеров [и др.] // Ульяновск: Зебра, 2015. 114 с.
6. Mordi I., Tzemos N. Bicuspid aortic valve disease: a comprehensive review // Cardiology Research and Practice. 2012. Vol. 2012. P. 1 – 7
7. Петрушенко Д. Ю., Харисова А. Е. Результаты реконструктивно-пластических операций на двустворчатом аортальном клапане при его стенозе // Практическая медицина. 2016. № 7 (99). С. 89–92
8. Сейдалин А. О., Туганбеков Т. У. Особенности патофизиологии аортопатии у пациентов с двустворчатым аортальным клапаном // Клиническая медицина Казахстана. 2016. № 3 (41). С. 14–20
9. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases / R. Erbel [et al.] // European Heart Journal. 2014. № 35 (41). P. 2873 – 2926
10. 2017 ESC/EACTS Guidelines for the management of valvular heart disease / H. Baumgartner // European Heart Journal. 2017. № 38 (36). P. 2739 – 2791
11. Пелех Д. М. Отдаленные результаты и качество жизни больных, оперированных по поводу аортального стеноза с имплантацией двустворчатых механических протезов (Мединж-2, St Jude Med, Sorin Bicarbon): дисс. … канд. мед. наук. Москва. 2015. 127 с.
Рисунки

Рисунок 2. Рентгенограммы органов грудной клетки с контрастированным пищеводом 05 марта 2019 г.: слева – прямая проекция; справа – вторая (левая) косая проекция

Рисунок 3. Эхокардиография 05 марта 2019 г.: а – парастернальная позиция, короткая ось на уровне концов створок аортального клапана; б – парастернальная позиция, длинная ось левого желудочка; в – апикальная пятикамерная позиция; г – парастернальная позиция, длинная ось левого желудочка с отклонением на восходящую аорту
Из-за большого диаметра аорта особенно чувствительна к перепадам артериального давления. Ежесекундно ей приходится испытывать серьезную нагрузку, продвигая кровь, которую выталкивает сердце. И если давление повышается, возрастает напряжение в стенках аорты. Выдерживать такие колебания ей удается благодаря своей эластичности. Стенка аорты имеет три слоя:
- внутренний – самый тонкий. Он абсолютно гладкий и является своего рода барьером, не позволяющим вредным веществам из крови проникнуть внутрь стенки;
- средний слой состоит в основном из мышечных и коллагеновых волокон, которые помогают аорте растягиваться и принимать исходное положение;
- наружный слой представляет собой соединительную ткань с микроскопическими нервами и сосудами. Именно через них стенка аорты получает питание.
Заболевания аорты можно разделить на врожденные (синдром Марфана, коарктация аорты) и приобретенные (атеросклероз, аневризма, расслоение аорты). Рассмотрим их подробнее.
Атеросклероз
Под этим термином понимают сужение просвета сосуда вследствие образования атеромы – холестериновой бляшки. Атеросклероз может поразить не только аорту, но и любые иные артерии. Чаще всего страдают сосуды, питающие:
- головной мозг;
- сердце;
- нижние конечности;
- кишечник;
- почки.
Если просвет сосуда сужен, ухудшается кровоток. А значит, внутренние органы не получают кислород и питательные вещества в должном объеме, что негативным образом сказывается на их работе. Но атеросклероз опасен не только по этой причине. Холестериновая бляшка может разрушиться, оставив на гладкой внутренней поверхности сосуда шероховатый след. К таким шероховатостям легко приклеиваются тромбоциты, образуя тромб. А он может оторваться и полностью закупорить сосуд.
Атеросклероз никак не проявляется до тех пор, пока просвет артерии не сузится примерно на 70%. После этого в месте локализации бляшки возникает боль. Остальные симптомы зависят от того, какой именно орган питает пораженный сосуд:
- если нарушена работа головного мозга, наблюдаются расстройства памяти и ухудшение умственных способностей, головокружения, бессонница, повышенная утомляемость, раздражительность, возможны проблемы с координацией движений, со зрением и речью;
- когда питание недополучает сердце, появляется давящая боль в груди, одышка. В редких случаях может кружиться и болеть голова;
- если затруднен кровоток в направлении нижних конечностей, температура ног снижается, может появиться синюшность. При ходьбе начинают болеть икры, но после остановки боль утихает;
- в случае, когда от дефицита питания страдает кишечник, это проявляется в виде колик. Как правило, они возникают после приема пищи. Также может вздуться живот, иногда наблюдается рвота.
Для диагностирования атеросклероза проводится комплексное обследование, включающее анализ крови, рентгенологическое исследование, УЗИ, допплерографию сосудов, дуплексное и триплексное сканирование артерий.
Лечение может быть как медикаментозным, так и хирургическим. В первом случае используются препараты, позволяющие снизить уровень липидов в крови, а во втором выполняется протезирование, стентирование или иная операция. Есть и третий вариант: отказ от вредных привычек, соблюдение диеты, здоровый образ жизни с умеренными физическими нагрузками. Эти меры позволяют остановить развитие атеросклероза.
Аневризма
Аневризма развивается тогда, когда истончившаяся стенка аорты постепенно расширяется, образуя на сосуде выпуклость. При этом диаметр аорты существенно увеличивается, а пораженными оказываются все три слоя стенки. Способствуют таким изменениям повышенное артериальное давление и курение. Но первопричиной все же является снижение прочности сосудистой стенки, вызванное атеросклерозом, травмой, воспалением, инфекционным заболеванием и т. д. Аневризмы бывают:
- мешковидными (наружу выпячивается не вся окружность стенки, а лишь ее часть);
- веретенообразными (участок аорты расширен во всех направлениях).
Чем больше аневризма, тем выше риск, что она разорвется. А это означает внутреннее кровоизлияние, зачастую приводящее к смерти. Поэтому так важно вовремя выявить аневризму и удалить ее. Проблема в том, что расширение стенки сосуда в большинстве случаев происходит незаметно для человека. Лишь когда аневризма достигает значительных размеров и начинает давить на смежные органы и ткани, возникает боль. Но могут быть и другие симптомы:
- при аневризме брюшной аорты ощущается пульсирующее образование в животе, дискомфорт;
- если поражена грудная аорта, может появиться кашель, хрипота, трудности с глотанием;
- аневризма мозговой артерии способна вызывать головокружение, головную боль.
Выявить расширение сосуда можно с помощью рентгенологических исследований, ангиографии, УЗИ, компьютерной томографии, МРТ. Небольшие аневризмы, как правило, подлежат наблюдению. Параллельно могут быть назначены препараты, понижающие артериальное давление. Если же диаметр аневризмы превышает 6 см, ее удаляют хирургическим путем и заменяют иссеченный участок протезом.
Расслоение аорты
Это наиболее опасное заболевание, чреватое летальным исходом. Из-за надрыва внутреннего слоя кровь попадает внутрь сосудистой стенки и отделяет средний пласт от наружного. При этом может образоваться так называемый ложный просвет, который затрудняет ток крови. Чаще всего расслоение происходит в местах, где стенка аорты испытывает наибольшее напряжение. Запустить этот процесс может резкий подъем кровяного давления, а также чрезмерная физическая нагрузка. Симптомами расслоения аорты являются:
- боль в месте надрыва, зачастую невыносимая;
- резкое падение артериального давления;
- обморок;
- онемение конечностей;
- возможно расстройство речи и зрения.
Если наружная стенка не выдерживает напора крови, происходит полный разрыв сосуда. В этом случае велика вероятность летального исхода. Бывает так, что после расслоения аорты кровообращение естественным образом стабилизируется, но это не значит, что опасность миновала. В любой момент сосуд может разорваться, поэтому при таком диагнозе выход только один – операция. Хирург иссекает расслоившийся участок аорты, а затем выполняет протезирование.
Синдром Марфана
При такой наследственной патологии наблюдается неполноценность стенки аорты и других артерий. В частности, средний сосудистый слой непрочный. Из-за этого образуются аневризмы, в конечном итоге происходит расслоение аорты. При отсутствии лечения люди с синдромом Марфана не доживают до 40 лет.
Это заболевание затрагивает не только сердечно-сосудистую, но и костную систему, а также зрение. Поэтому симптоматика очень разнообразная и богатая:
- высокий рост, слишком длинные конечности и пальцы, иногда – вдавленная грудь;
- болезненная худоба, плоскостопие;
- близорукость, вывих или помутнение хрусталика;
- одышка, стенокардия, тахикардия.
В случае с синдромом Марфана полное излечение невозможно. Усилия врачей направлены на устранение симптомов и сведение к минимуму риска развития смертельно опасных осложнений. Чтобы предупредить образование аневризм и расслоение аорты, назначают лекарства, снижающие артериальное давление и частоту сердечных сокращений. При необходимости выполняется хирургическая коррекция.
Коарктация аорты
Данный термин означает аномальное сужение аорты в месте, где дуга переходит в нисходящую аорту. Это врожденная сердечная патология. Из-за слишком узкого просвета ухудшается кровоснабжение нижней части тела, что негативно сказывается на здоровье и развитии ребенка. Признаками коарктации аорты являются:
- боль и ощущение пульсации в голове;
- кровотечения из носа;
- повышенное артериальное давление в верхней части тела и пониженное – в нижней;
- похолодание ног, болезненные ощущения при ходьбе;
- ухудшение зрения;
- усиленная пульсация артерий в верхней части тела.
Диагностировать коарктацию аорты позволяют такие методы, как ЭКГ, УЗИ и допплерография, ангиография, МРТ. Дефект устраняется только оперативным путем. Это может быть пластическая реконструкция, удаление узкого участка аорты с последующим протезированием или шунтирование. Хирургическое вмешательство наиболее эффективно в раннем возрасте.
Находился в отделении в октябре-ноябре 2013 г. Хочу выразить благодарность всему коллективу отделения под руководством Калинина Андрея Анатольевича за внимательность, чуткость и настоящий профессионализм. Огромное спасибо моему лечащему врачу Алдошиной Виктории Викторовне за.
Читайте также:
- Как можно предоставить доступ пользователям к изменению набора таблиц
- Как обозначается группа крови в паспорте
- Со скольки лет можно делать абортирование без согласия родителей в россии
- Где платят за рефералов единовременное вознаграждение
- Кто утверждает вопросы для аттестации сил обеспечения транспортной безопасности

